Дифосфоглицерат и сродство гемоглобина с кислородом

Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
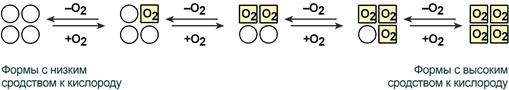
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
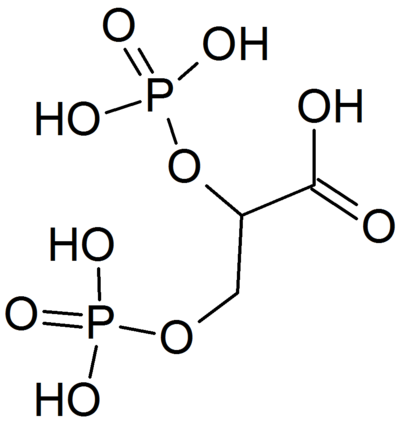
ИЮПАК наименование: 2,3-дифосфонооксипропановая кислота
Другие названия: 2,3-дифосфоглицериновая кислотаа; 2,3-ДФГ; 2,3-бифосфолицерат
Сокращения: 2,3-BPG; 2,3-ДФГ; 23BPG
Химическая формула: C3H8O10P2
Молярная масса: 266,03 г · моль-1
Если не указано иное, данные приводятся для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
2,3-Бисфосфоглицериновая кислота (2,3-BPG), также известная как 2,3-дифосфоглицериновая кислота (2-дифосфоглицерат 2-дифосфоглицерата) – трехуглеродный изомер гликолитической промежуточной 1,3-бисфосфоглицериновой кислоты (1,3-BPG). 2,3-BPG присутствует в эритроцитах человека в количестве примерно 5 ммоль / л. Она связывается с большим сродством с дезоксигенированным гемоглобином (например, когда красная кровяная клетка находится вблизи дыхательной ткани), чем с оксигенированным гемоглобином (например, в легких) из-за пространственных изменений: 2,3-BPG (с оцененным размером около 9 ангстрем) вписывается в дезоксигенированную конфигурацию гемоглобина (11 ангстрем), но не в оксигенированную (5 ангстрем). Она взаимодействует с дезоксигенированными гемоглобинными бета-субъединицами, уменьшая их сродство к кислороду, поэтому она способствует высвобождению оставшихся молекул кислорода, связанных с гемоглобином, тем самым повышая способность эритроцитов выделять кислород вблизи наиболее нуждающихся в нем тканей. 2,3-BPG является, таким образом, аллостерическим эффектором.
Его функция была открыта в 1967 году Рейнхольдом Бенешем и Рут Бенеш 1).
Метаболизм
2,3-BPG образуется из 1,3-BPG ферментом BPG-мутазой. Затем её можно разделить на 2,3-BPG фосфатазу с образованием 3-фосфоглицерата. Таким образом, его синтез и расщепление представляют собой путь вокруг стадии гликолиза с чистым расходом одного АТФ на молекулу 2,3-BPG, вырабатываемой, поскольку высокомолекулярная связь карбоновой кислоты с фосфатом смешанного ангидрида расщепляется бисфосфоглицератной мутазой.
Нормальный гликолитический путь генерирует 1,3-BPG, который может быть дефосфорилирован фосфоглицераткиназой (PGK), генерируя АТФ, или его можно шунтировать в путь Luebering-Rapoport, где бифосфоглицерат мутаза катализирует перенос фосфорильной группы из C1 в C2 1,3-BPG, создавая 2,3-BPG. 2,3-BPG, наиболее концентрированный органофосфат в эритроците, образует 3-PG под действием бисфосфоглицерат фосфатазы. Концентрация 2,3-BPG изменяется пропорционально [H+], что ингибирует каталитическое действие бисфосфоглицератной фосфатазы.
Существует тонкий баланс между необходимостью создания АТФ для поддержания энергетических потребностей в клеточном метаболизме и необходимостью поддержания соответствующего статуса оксигенации / дезоксигенации гемоглобина. Этот баланс поддерживается изомеризацией 1,3-BPG до 2,3-BPG, что усиливает дезоксигенирование гемоглобина. Низкое значение рН активирует активность бифосфоглицеромутазы и ингибирует бисфосфоглицеритную фосфатазу, что приводит к увеличению 2,3-BPG 2).
Эффекты связывания
Когда 2,3-BPG связывается с дезоксигемоглобином, он действует, стабилизируя низкое сродство к кислороду (состояние Т) носителя кислорода. Он аккуратно вписывается в полость дезоксиконформации, используя молекулярную симметрию и положительную полярность, образуя солевые мостики с лизином и гистидиновыми остатками в β-субъединицах гемоглобина. R-состояние с кислородом, связанным с группой гема, имеет другую конформацию и не допускает этого взаимодействия.
Сам по себе, гемоглобин имеет сигмовидную кинетику. При селективном связывании с дезоксигемоглобином, 2,3-BPG стабилизирует конформацию состояния T, что затрудняет связывание кислорода с гемоглобином и, более вероятно, будет высвобождаться в смежные ткани. 2,3-BPG является частью цикла обратной связи, который может помочь предотвратить тканевую гипоксию в условиях, где она, скорее всего, произойдет. Условия низкой концентрации кислорода в тканях, такие как большая высота (уровни 2,3-BPG выше у тех, которые приспосабливаются к большим высотам), обструкция дыхательных путей или застойная сердечная недостаточность будут приводить к тому, что эритроциты будут генерировать больше 2,3-BPG, потому что изменения в pH и кислороде модулируют ферменты, которые производят и восстанавливают его 3). Накопление 2,3-BPG снижает сродство гемоглобина к кислороду. В конечном счете, этот механизм увеличивает выделение кислорода из эритроцитов в условиях, когда это больше всего необходимо. Это высвобождение усиливается эффектом Бора, в котором сродство связывания гемоглобина к кислороду также снижается при более низком рН и высокой концентрации диосида углерода. В тканях с высокими энергетическими запросами, кислород быстро потребляется, что увеличивает концентрацию H+ и углекислого газа. Благодаря эффекту Бора, гемоглобин индуцируется высвобождением большего количества кислорода для снабжения клеток, которые ему нужны. Важно подчеркнуть, что поведение миоглобина не работает одинаково, так как 2,3-BPG не влияет на него. У беременных женщин, наблюдается 30% увеличение внутриклеточного 2,3-BPG. Это снижает сродство к гемоглобину у матери для кислорода и, следовательно, позволяет выгружать больше кислорода для плода в материнских маточных артериях. Плод имеет низкую чувствительность к 2,3-BPG, поэтому его гемоглобин имеет более высокое сродство к кислороду. Поэтому, хотя pO2 в маточных артериях мал, эмбриональная пупочная артерия (которая несет дезоксигенированную кровь) все еще может окисляться от них.
Фетальный гемоглобин
Интересно отметить, что фетальный гемоглобин (HbF) проявляет низкое сродство к 2,3-BPG, что приводит к более высокой аффинности связывания с кислородом. Это повышенное кислородсвязывающее сродство по сравнению с гемоглобином взрослого человека (HbA) обусловлено тем, что HbF имеет два α / γ-димера в отличие от двух α / β-димеров HbA. Положительные гистидиновые остатки HbA-субъединиц, которые необходимы для формирования связывающего кармана 2,3-BPG, заменяются остатками серина в γ-субъединицах HbF. Таким образом, гистидин nº143 теряется, поэтому 2,3-BPG испытывает трудности со связыванием с фетальным гемоглобином, и он похож на чистый гемоглобин. Так O2 переходит от матери к плоду. Эмбриональный гемоглобин имеет большее сродство к кислороду, чем гемоглобин взрослого человека. Более того, миоглобин обладает самым высоким сродством к кислороду.
Заболевания, связанные с 2,3-BPG
Гипертиреоз
В исследовании 2004 года были оценены эффекты тиреоидного гормона на уровни 2,3-BPG. В результате, гипертиреоз модулирует in vivo содержание 2,3-BPG в эритроцитах путем изменения экспрессии фосфоглицератной мутации (PGM) и 2,3-BPG-синтазы. Этот результат показывает, что увеличение содержания 2,3-BPG эритроцитов, наблюдаемое при гипертиреозе, не зависит от какого-либо изменения скорости циркулирующего гемоглобина, но, по-видимому, является прямым следствием стимулирующего действия тиреоидных гормонов на гликолитический эритроцит 4).
Хроническая анемия
Эритроциты увеличивают внутриклеточную концентрацию 2,3-BPG в целых пять раз в течение одного-двух часов у пациентов с хронической анемией, когда снижается ёмкость насыщения кислородом крови. Это приводит к смещению кривой кислородной диссоциации вправо и к увеличению количества кислорода в тканях.
Хроническое респираторное заболевание с гипоксией
Недавно ученые обнаружили сходство между низкими количествами 2,3-BPG с возникновением высокогорного отека легких на больших высотах.
Гемодиализ
В исследовании 1998 года, концентрация эритроцитов 2,3-BPG анализировалась во время процесса гемодиализа. Концентрация 2,3-BPG была выражена относительно концентрации тетрамера гемоглобина (Hb4) в качестве соотношения 2,3-BPG / Hb4. Физиологически увеличение уровней 2,3-BPG должно было бы противодействовать гипоксии, которая часто наблюдается в этом процессе. Тем не менее, результаты показывают, что отношение 2,3-BPG / Hb4 уменьшилось. Это связано с самой процедурой: считается, что механический стресс на эритроцитах вызывает выпадение 2,3-BPG, который затем удаляется гемодиализом. Концентрации кальция, фосфата, креатинина, мочевины и альбумина существенно не коррелировали с общим изменением отношения 2,3-BPG / Hb4. Однако отношение, взятое непосредственно перед диализом, коррелировало значительно и положительно с общей недельной дозой эритропоэтина (основного гормона в образовании эритроцитов), получаемого пациентами 5).
Список использованной литературы:
1)
Benesch, R.; Benesch, R.E. (1967). «The effect of organic phosphates from the human erythrocyte on the allosteric properties of hemoglobin.». Biochem Biophys Res Commun. 26 (2): 162–7. doi:10.1016/0006-291X(67)90228-8. PMID 6030262
2)
Müller-Esterl, W. (2008). «Biochemistry: Fundamentals Of Medicine And The Science Of Life.». Editorial Reverté: 660.
4)
González-Cinca, N; Pérez de la Ossa, P; Carreras, J; Climent, F (2004). «Effects of thyroid hormone and hypoxia on 2,3-bisphosphoglycerate, bisphosphoglycerate synthase and phosphoglycerate mutase in rabbit erythroblasts and reticulocytes in vivo».
5)
Nielsen AL; Andersen EM; Jørgensen LG; Jensen HA. (1998). »«Oxygen and 2,3 biphosphoglycerate (2,3-BPG) during haemodialysis»
2) сродство гемоглобина к кислороду снижается,
кривая диссоциации оксигемоглобина сдвигается вправо
Как влияет снижение концентрации 2,3-дифосфоглицерата на сродство гемоглобина к кислороду и кривую диссоциации оксигемоглобина?
1) сродство гемоглобина к кислороду повышается,
кривая диссоциации оксигемоглобина сдвигается влево
37-24. Как влияет повышение pCO2 крови на сродство гемоглобина к кислороду и кривую диссоциации оксигемоглобина?
2) сродство гемоглобина к кислороду снижается,
кривая диссоциации оксигемоглобина сдвигается вправо
37-25. Как влияет снижение pCO2 крови на сродство гемоглобина к кислороду и кривую диссоциации оксигемоглобина?
1) сродство гемоглобина к кислороду повышается,
кривая диссоциации оксигемоглобина сдвигается влево
Какое явление характеризует эффект Холдейна?
1) зависимость связывания CO2 кровью от степени оксигенации гемоглобина
Какую зависимость описывает эффект Холдейна?
2) чем ниже насыщение гемоглобина кислородом, тем выше степень связывания
углекислого газа кровью
37-28. Начиная с какого значения увеличение РО2 в крови не будет оказывать существенного влияния на насыщение гемоглобина кислородом?
3) 60
Что такое кислородная емкость крови?
4) максимальное количество О2, которое может связать кровь при полном насыщении
гемоглобина
Активация каких рецепторов вызывает инспираторно-тормозящий рефлекс Геринга-Брейера?
4) ирритантных рецепторов легких
Какой рефлекс участвует в саморегуляции дыхания?
2) рефлекс Геринга-Брейера
37-32. Активация каких рецепторов включает “обратную связь” дыхательной мускулатуры и легких с дыхательным центром?
1) рецепторы растяжения дыхательных мышц и рецепторы растяжения легких
37-33. Как изменится чувствительность хеморецепторов к СО2 при активации симпатического отдела нервной системы?
1) увеличится
37-34. Как изменится чувствительность хеморецепторов к СО2 при активации парасимпатического отдела нервной системы?
2) уменьшится
37-35. Как изменится чувствительность хеморецепторов к СО2 в условиях гипероксии?
2) уменьшится
37-36. Аортальные хеморецепторы наиболее чувствительны к:
1)+гипоксемии (низкому РO2 )
Какой из перечисленных параметров внутренней среды организма играет ведущую роль в регуляции минутного объема дыхания у здорового человека?
2) РCO2
Как изменится дыхание при попадании воды в нижние носовые ходы?
2) дыхание угнетается
37-39. Что означает термин “гипероксия”?
4) повышение напряжения О2 в крови
Как изменяется активность дыхательного центра при действии на рецепторы полости носа воздушного потока?
2) снижается
Как меняется дыхание после разрушения пневмотаксического центра и двухсторонней перерезки блуждающих нервов?
3) дыхание становится редким и глубоким
37-42. Центральные хеморецепторы наиболее чувствительны к изменению:
2)+рН и РСО2
Каковы причины уменьшения времени выдоха при гиперпноэ?
1) активация рецепторов растяжения легких
Какой рефлекс увеличивает частоту дыхания при гиперпноэ?
2) рефлекс Геринга-Брейера
Какие процессы характеризуют адаптацию к условиям высокогорья?
1) увеличение количества эритроцитов
2) увеличение количества гемоглобина
3) увеличение вентиляции легких
4) снижение в эритроцитах 2,3-глицерофосфата
5) все ответы правильные
Что меняется в регуляции дыхания при поражении (удалении) лобных долей коры больших полушарий головного мозга?
4) нарушается способность произвольного изменения ритма и глубины дыхания


