До складу гемоглобину входить
Матеріал з Вікіпедії — вільної енциклопедії.
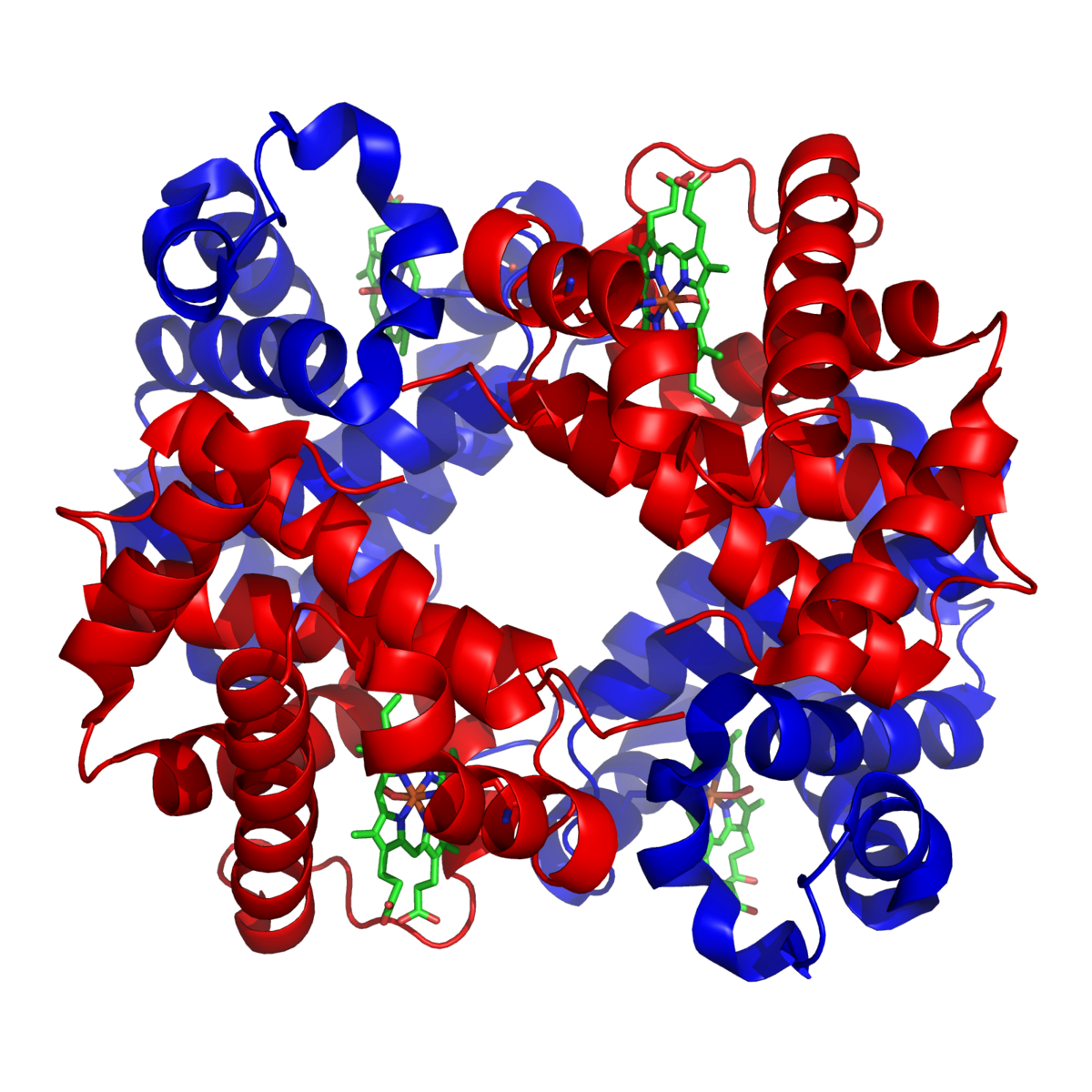
Структура гемоглобіну людини. Субодиниці α та β забарвлено червоним та синім, а залізовмісні гемові групи — зеленим.
Гемоглобі́н (від грец. haima — кров і лат. globus — куля) — складний залізовмісний білок еритроцитів тварин і людини, здатний оборотно зв’язуватися з киснем, забезпечуючи його перенесення до тканин.
Головна функція гемоглобіну полягає в транспорті дихальних газів. У капілярах легенів в умовах надлишку кисню останній з’єднується з гемоглобіном. Потоком крові еритроцити, що містять молекули гемоглобіну із зв’язаним киснем, доставляються до органів і тканин, де кисню мало; тут необхідний для протікання окислювальних процесів кисень звільняється із зв’язку з гемоглобіном. Крім того, гемоглобін здатний зв’язувати в тканинах невелику кількість діоксиду вуглецю (CO2) і звільняти його у легенях. Монооксид вуглецю (CO) зв’язується з гемоглобіном крові міцніше, ніж кисень, необоротно утворюючи карбоксигемоглобін.Сполуки гемоглобіну з нітратами називаються метгемоглобіном (metHb, від мета. і гемоглобін, інакше геміглобін або феррігемоглобін). Таким чином, блокується процеси транспортування кисню. У метгемоглобіні залізо гема знаходиться в комплексі або в тривалентному стані. Метгемоглобін також утворюється в значних кількостях в результаті спадкового захворювання метгемоглобінемії.
В медицині використовують скорочене позначення даного показника — Hb (латинські літери). Нормальним вмістом гемоглобіну в крові людини вважається: у чоловіків 130—170 г/л, у жінок 120—150 г/л; у дітей — 120—140 г/л.
Емпірична хімічна формула найбільш поширеного людського гемоглобіну C2952H4664N812O832S8Fe4.
Будова[ред. | ред. код]
Гемоглобін є складним білком класу хромопротеїнів, тобто таких, що містять простетичну групу, якою виступає особлива пігментна група, що містить хімічний елемент залізо, — гем. Гемоглобін є тетрамером, тобто складається з чотирьох субодиниць. У дорослої людини вони представлені поліпептидними ланцюгами α1, α2, β1 і β2. Субодиниці сполучені одна з одною за принципом ізологічного тетраедра. Основний внесок до взаємодії субодиниць вносять гідрофобні взаємодії. І α, і β-ланцюги відносяться до α містять в своїй структурі виключно α-спіралі. Кожен ланцюг містить вісім спіральних ділянок, що позначаються буквами A-H (від N-кінцю).
Гем є комплексом протопорфірину IX, що відноситься до класу порфіринових сполук, з атомом заліза(II). Ця простетична група нековалентно зв’язується з гідрофобною западиною молекул гемоглобіну і міоглобіну. Залізо(II) характеризується октаедричною координацією, тобто зв’язується з шістьма лігандами. Чотири з них представлені атомами азоту порфіринового кільця, що лежать в одній площині. Дві інших координаційних позиції лежать на осі, перпендикулярній площині порфірину. Одна з них зайнята азотом залишку гістидіну в 93 положенні поліпептидного ланцюга (ділянка F). Молекула кисню, що зв’язується гемоглобіном, координується до заліза зі зворотного боку і виявляється поміщеною між атомом заліза і азотом ще одного залишку гістидіну, розташованого в 64 положенні ланцюга (ділянка E). Всього в гемоглобіні чотири ділянки зв’язування кисню (один гем на кожну субодиницю), тобто одночасно може бути зв’язано чотири молекули кисню на комплекс гемоглобіну.
Фізіологічна роль[ред. | ред. код]
Гемоглобін є одним з основних білків, якими харчуються плазмодії малярії, і в ендемічних щодо малярії районах земної кулі вельми поширені спадкові аномалії будови гемоглобіну, що ускладнюють малярійним плазмодіям живлення цим білком і проникнення до еритроцитів. Зокрема, до таких аномалій, що мають еволюційно-пристосовне значення, відноситься серповидно-клітинна анемія. Проте, на жаль, ці аномалії, як і аномалії будови гемоглобіну, що не мають явно пристосовного значення, супроводжуються порушенням функції транспорту кисню гемоглобіном, зниженням стійкості еритроцитів до руйнування, анемією та іншими негативними наслідками. Аномалії будови гемоглобіну називаються гемоглобінопатіями.
Гемоглобін високо токсичний при попаданні значної його кількості з еритроцитів в плазму крові (що відбувається при масивному внутрішньосудинному гемолізі, геморагічному шоці, гемолітичних анеміях, переливанні несумісної крові та інших патологічних станах). Токсичність гемоглобіну, що знаходиться поза еритроцитами, у вільному стані в плазмі крові, виявляється тканинною гіпоксією — погіршенням кисневого постачання тканин, перевантаженням організму продуктами руйнування гемоглобіну — залізом, білірубіном, порфіринами з розвитком жовтяниці або гострою порфірії, закупоркою ниркових канальців крупними молекулами гемоглобіну з розвитком некрозу ниркових канальців і гострої ниркової недостатності.
Зважаючи на гаптоглобін, що специфічно зв’язує вільний глобін і глобін у складі гемоглобіну. Комплекс гаптоглобіна і глобіну (або гемоглобіну) потім захоплюється селезінкою і макрофагами тканинної ретікуло-ендотеліальної системи і знешкоджується.
Іншою частиною гемоглобінознешкоджуючої системи є білок гемопексин, що специфічно зв’язує вільний гем і гем у складі гемоглобіну. Комплекс гему (або гемоглобіну) і гемопексину потім захоплюється печінкою, гем відщеплюється і використовується для синтезу білірубіну та інших жовчних пігментів, або випускається в рециркуляцію в комплексі з трансферином для повторного використання кістковим мозком в процесі еритропоезу.
Див. також[ред. | ред. код]
- Гемоглобін A
- Гемоглобін C (мутантна форма)
- Гемоглобін E
- Гемоглобін F (ембріональний гемоглобін)
- Гемоглобін S (мутантна форма)
- Міоглобін
- Оксигемоглобін
Посилання[ред. | ред. код]
- ГЕМОГЛОБІН
- Гемоглобін // Універсальний словник-енциклопедія. — 4-те вид. — : Тека, 2006.
- Інтерактивні моделі гемоглобіну
- Гемоглобін. Гемоглобин
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; KE van Holde & KG Ahern (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & C Chothia (1976), “Structural patterns in globular proteins”, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
8 Гемоглобін, його види і значення в організмі
Гемоглобін (Нb) – основна складова частина еритроцитів. Складається Нb з білку глобіну (96%) й простетичної частини – гема (4% молекули). Гем предстваляє собою координаційну сполуку атому заліза з циклічною сполукою протопорфирином. В склад гему входить Fе 2+ . В склад молекули гемоглобіну входить 4 гема, атом заліза координаційно зв’язаний з 4 атомами азоту пірольних кілець. Мr Нb=64458. Молекула має форму стероїда 6,4х5нм, на поверхні якого розташовані 4 гідрофобні заглиблення, що містять гем, який має форму диску. Гем для всіх гемоглобінів однаковий і структурні зміни цього хромопротеїду зумовлені структурою білкової частини – глобіну.
Глобіни можуть мати різний склад, розрізнятися складом аміноксилот та їх послідовністю в поліпептидному ланцюзі, а також співвідношенням поліпеп-тидних лінцюгів (α і β).
З загальної кількості заліза організму (4 гр) приблизно 50% припадає на гем.
Механіз переносу кисню гемоглобіном
Засновником вчення про дихальну функцію крові є російський фізіолог І.Н. Сеченов. Вивчаючи залежність між складом повітря в легенях і вмісту СО2 і О2 в крові, Сеченов вперше доказав, що СО2 переноситься не плазмою, а Нb.
Повітря, яке вдихає людина, містить 20,9% О2 і 0,03% СО2, тиск О2 перевищує тиск СО2. Така різниця сприяє дифузії кисню і зворотньому сполу-ченню його з гемоглобіном. Кожна одиниця гемоглобіну може зв’язувати одну молекулу О2, утворюючи НbО2 – оксигемоглобін.
Оскільки приєднання молекулярного кисню не пов’язано зі зміною валентності гему і не є окисленням, процес називається оксигенацією.
В Нb декілька місць зв’язування молекулярного кисню і насищення його киснем відбувається не одночасно. Зі збільшенням місць, занятих киснем, спорідненість до нього вільних електронів зростає, що прискорює процес оксигенації, такий процес має кооперативний характер.
При дисоціації НbО2 його спорідненість до кожної слідуючої молекули О2 зменщується, що сприяє вивільненню О2 в тканинах.
Серед факторів, що впливають на спорідненість Нb до О2 має значення концентрація протонів водню, концентрації СО2, органічних фосфатів. Оксигенація супроводжується вівільненням протонів Н з оксигемоглобіну в середовище, а деоксигенація приєднання протонів до гемоглобіну, що дуже важливо в капілярах тканин, куди поступає велика кількість продуктів метаболізму.
В артеріальній крові, де О2 міститься 19-20%, тиск досягає 75-100мм.рт.ст., а в тканинній рідині 20-40 мм.рт.ст., що сприяє дисоціації оксигемоглобіну і засвоєння О2 тканинами. Кисень реагує в тканинах з дихальим залізовмістним пігментом цитохромоксидазою і через систему ферментів окислює водень субстратів з утворенням НbО2.
Утворення НbО2 залежить від парціального тиску кисню у повітрі. Коли тиск знижується, кількість НbО2 зменшується. Це явище називається гіпокксемією. При недостатку О2 в в крові може виникнути недостаток його в тканинах – гіпоксія. Розрахунками встановлено, що при наявності в повітрі 20,9% кисню приблизно 99% Нb зв’язується в оксигемоглобін, при наявності 10% О2 – 90% Нb зв’язується в оксигемоглобін, при 2,5% О2 –тільки 50% Нb зв’язується в оксигемоглобін. Це свідчить про те, що в організмі людини є величезні адаптаційні можливості. І.М.Сеченов доказав, що зменшення парціального тиску у альвеолах від 80 до 20 мм.рт.ст. може викликати таке зниження кількості гемоглобіну. що призводить до смерті.
Границею тиску, при якому може існувати людина є 30% від норми атмосферного тиску. Це приблизно 8 км над рівнем моря. Основна причина гірської хвороби – недостаток кисню, але свою роль відіграє СО2 і — гіпоксемія. В тяжких умовах гіпоксемія може перейти в аноксію, зупинитися дихання в тканинах і наступить смерть.
Містить в своєму складі Fе 3+ . В молекулі О2 замінюється гідроксильною групою ОН — , і він не може транспортувати кисень. В крові дорослої людини невелика кількість його 0,3-3 г/л. Фізіологічно він грає захисну роль, зв’язує і знезаражує ціаніди, перетворюючи їх в нешкідливий комплекс, в крові може зв’язувати до 1/3 ціанідних ядів. Крім того знезаражує сірководень, масляну кислоту, тобто має виражену антиоксидантну дію, руйнує токсичні для організму перекисні сполуки. При цьому НbН відновлюється в нормальний гемоглобін. Здатність відновлювати НbН має аскорбінова кислота (вітамін С).
Утворюється при отруєнні СО. Оскільки спорідненість СО до Нb в 300 разів вижче ніж у О2 , то навіть в невеликих кількостях він швидко з’єднується з Нb. Так, при концентрації СО у повітрі 0,07%, 50% Нb перетворюється в карбоксигемоглобін, а при наявності у повітрі 1% СО фактично весь Нb перетворюється у карбоксигемоглобін. У боротьбі з гіпоксемією використовується оксигенотерапія. Вона часто поєднується з добавкою до О2 СО2 (95% О2 + 5%СО2 ). Підвищення тиску О2 у крові сприяє відновленню гемоглобіну з метогемоглобіну і карбоксигемоглобіну, а СО2 подразнює дихальний центр, підсилює вентиляцію легень і надходження О2 в тканини.
Міоглобін – це хромопротеїд м’язів, він складається тільки з одного ланцюга анологічного субодиниці гемоглобіну. Це дихальний пігмент м’язів, він значно краще з’єднується з киснем, але трудніше його віддає. Міоглобін створює запаси кисню в м’язах, де його кількість може досягти 14% всього кисню організму. Це має велике значення для роботи серцевого м’яза. Високий вміст міоглобіну в організмах морських ссавців.
Контрольні запитання до теми
Які сполуки називаються білками?
Який елементарний склад мають білки?
Вміст якого хімічного елементу постійний у білках?
Які мікроелементи входять до складу білків?
Що є мономерами білків? Які властивості мають амінокислоти?
Як класифікують амінокислоти? Назвіть представників кожного класу.
Які рівні організації мають білки?
Яка структура білку найбільш стійка?
Які хімічні властивості маєть білки?
Які фактори стійкості білків у розчині?
Що називають зворотним осадом білків?
Що таке денатурація і чим вона відрізняється від зворотного осаду?
За якими ознаками класифікують білки?
Які білки відносять до простих білків. Дати їм характеристику.
За якими ознаками класифікують складні білки?
Дати характеристику кожному класу складних білків?
До якого класу складних білків відносять гемоглобін? Яка його біологічна роль в організмі?
Назвіть фракції гемоглобіну, їх біологічна роль в організмі.
Лекція № 3. ХІМІЯ ВУГЛЕВОДІВ
Загальна характеристика вуглеводів та їх біологічна роль в організмі людини.
Класифікація вуглеводів. Моносахариди, хімічна будова, властивості, біологічна роль.
Дисахариди, склад, біологічне значення в організмі.
Полісахариди, загальні уявлення про будову та властивості гомополісахаридів.
Гетерополісахариди, склад, біологічне значення в організмі людини.
Загальна характеристика вуглеводів та їх біологічна роль в організмі людини
источник
Что в состав гемоглобина входит
Что такое гемоглобин? Это железосодержащий белок животных, который принимает активное участие в транспортировке кислорода по всем органам человека. У позвоночных гемоглобин содержится в небольших красных тельцах под названием эритроциты. Для каждого возраста характерна своя норма содержания гемоглобина в крови.
Нормальный гемоглобин у женщин колеблется от 110 – 160 г/л, у мужчин от 110 до 180 г/л (верхний предел). В период вынашивания ребенка в организме представительницы прекрасного пола происходит постепенное накопление жидкости, которое со временем приводит к гемодилюции. Гемоглобин медленно снижается до отметки — 100 г/л, так как ребенок очень быстро расходует железосодержащие запасы и фолиевую кислоту.
Гемоглобин способен переносить кислород по всему организму: эритроциты постепенно добавляются тем органам, где кислород в недостатке. Он способствует гармоничному протеканию процессов окисления в организме. Кроме этого данное вещество способно вызвать в тканях некоторое число диоксида углерода, который обязательно будет через некоторое время освобожден.
Что в состав гемоглобина входит, какие элементы
В состав гемоглобина входит специальная группа, в которой находится обязательный компонент, под названием железо. Гемоглобин по-другому еще называют сложным белком, в составе которого четыре субъединицы. Железо представляет собой специальный комплекс протопофирина, который соединён с молекулами миоглобина и гемоглобина.
Железо имеет октаэдрическое направление, в котором можно выделить: атомы азота, которые связаны с кислородом. Повышенное давление в легких у человека может способствовать образованию с кислородом оксигемоглобин.
Гемоглобин обладает большой токсичностью и в процессе самого малого внедрения его в кровь, приводит к развитию серьезных заболеваний. Со временем организм человека испытывает дискомфорт из-за того что гемоглобин разрушается внутри человека: порфирины, железо, билирубин способствуют развитию желтухи, почечной недостаточности, некроза и т.д.
Токсичность гемоглобина можно обезвредить с помощью специальных составляющих, среди которых — гаптоглобин. Важным элементом в цепочке обезвреживания считается белок, под названием гемопексин, который пропускается в рециркуляцию вместе с трансферринами, которые повторно используются костным мозгом.
В состав гемоглобина входят по две цепи двух разных типов . Катастрофическая нехватка гемоглобина может стать причиной развития заболевания, под названием гипоксемия. Оно развивается из-за понижения парциального давления в крови, а также отличается по своим признакам от недостатка гемоглобина. К низкой степени гемоглобина в крови обычно приводит: пищевой дефицит, активная кровопотеря, атипичный гемоглобин и т.д.
На самом деле причин может быть масса и для того чтобы точно выяснить почему же упал гемоглобин в крови стоит немедленно обратиться к врачу. После сдачи всех необходимых анализов вы узнаете, какова причина заниженного гемоглобина.
О чем свидетельствует высокое содержание гемоглобина в крови? Оно связано, прежде всего, с увеличением размера и численности эритроцитов, которое может наблюдаться при полицитемии. Повышение может спровоцировать врожденные болезни сердца или легочный фиброз.
Время от времени стоит сдавать кровь на биохимический анализ, который показывает полный состав крови со всеми ее обязательными компонентами. Доктор сможет диагностировать ваше заболевание только после того, как детально изучит результаты вашего анализа.
источник
Что в состав гемоглобина входит
Что такое гемоглобин? Это железосодержащий белок животных, который принимает активное участие в транспортировке кислорода по всем органам человека. У позвоночных гемоглобин содержится в небольших красных тельцах под названием эритроциты. Для каждого возраста характерна своя норма содержания гемоглобина в крови.
Нормальный гемоглобин у женщин колеблется от 110 – 160 г/л, у мужчин от 110 до 180 г/л (верхний предел). В период вынашивания ребенка в организме представительницы прекрасного пола происходит постепенное накопление жидкости, которое со временем приводит к гемодилюции. Гемоглобин медленно снижается до отметки — 100 г/л, так как ребенок очень быстро расходует железосодержащие запасы и фолиевую кислоту.
Гемоглобин способен переносить кислород по всему организму: эритроциты постепенно добавляются тем органам, где кислород в недостатке. Он способствует гармоничному протеканию процессов окисления в организме. Кроме этого данное вещество способно вызвать в тканях некоторое число диоксида углерода, который обязательно будет через некоторое время освобожден.
Что в состав гемоглобина входит, какие элементы
В состав гемоглобина входит специальная группа, в которой находится обязательный компонент, под названием железо. Гемоглобин по-другому еще называют сложным белком, в составе которого четыре субъединицы. Железо представляет собой специальный комплекс протопофирина, который соединён с молекулами миоглобина и гемоглобина.
Железо имеет октаэдрическое направление, в котором можно выделить: атомы азота, которые связаны с кислородом. Повышенное давление в легких у человека может способствовать образованию с кислородом оксигемоглобин.
Гемоглобин обладает большой токсичностью и в процессе самого малого внедрения его в кровь, приводит к развитию серьезных заболеваний. Со временем организм человека испытывает дискомфорт из-за того что гемоглобин разрушается внутри человека: порфирины, железо, билирубин способствуют развитию желтухи, почечной недостаточности, некроза и т.д.
Токсичность гемоглобина можно обезвредить с помощью специальных составляющих, среди которых — гаптоглобин. Важным элементом в цепочке обезвреживания считается белок, под названием гемопексин, который пропускается в рециркуляцию вместе с трансферринами, которые повторно используются костным мозгом.
В состав гемоглобина входят по две цепи двух разных типов . Катастрофическая нехватка гемоглобина может стать причиной развития заболевания, под названием гипоксемия. Оно развивается из-за понижения парциального давления в крови, а также отличается по своим признакам от недостатка гемоглобина. К низкой степени гемоглобина в крови обычно приводит: пищевой дефицит, активная кровопотеря, атипичный гемоглобин и т.д.
На самом деле причин может быть масса и для того чтобы точно выяснить почему же упал гемоглобин в крови стоит немедленно обратиться к врачу. После сдачи всех необходимых анализов вы узнаете, какова причина заниженного гемоглобина.
О чем свидетельствует высокое содержание гемоглобина в крови? Оно связано, прежде всего, с увеличением размера и численности эритроцитов, которое может наблюдаться при полицитемии. Повышение может спровоцировать врожденные болезни сердца или легочный фиброз.
Время от времени стоит сдавать кровь на биохимический анализ, который показывает полный состав крови со всеми ее обязательными компонентами. Доктор сможет диагностировать ваше заболевание только после того, как детально изучит результаты вашего анализа.
источник
Из чего состоит молекула гемоглобина
Гемоглобин (Hb) — это сложный железосодержащий белок, который находится в эритроцитах. Именно он является основной составляющей эритроцитов и придает им характерный красный цвет. Это один из важнейших компонентов крови, так как основной функцией гемоглобина является перенос кислорода из альвеол легких к клеткам всего организма, а также углекислого газа в обратном направлении (к легким).
В одном эритроците содержится приблизительно 400 000 000 молекул гемоглобина.
Молекулярная масса гемоглобина — 66 800 г/моль (66,8 кДа).
Строение гемоглобина
Строение молекулы гемоглобина простое — в ее состав входит всего 2 компонента:
Гем — это природный пигмент, в состав которого входит соединение порфирина с железом. Общая доля гема в структуре гемоглобина составляет всего 4%. Железо, входящее в гем гемоглобина, имеет валентность Fe2+.
Молекулярная масса гема — 616,5 г/моль.
Наличие в крови сильных окислителей (свободных радикалов) приводит к окислению двухвалентного железа до трехвалентного (Fe3+). Гем в этом случае превращается в гематин, а сам гемоглобин в метгемоглобин. Только двухвалентное железо способно присоединять кислород и транспортировать его от альвеол легких до тканей организма, поэтому окисление железа в составе гема и образование метгемоглобина очень негативно сказывается на способности эритроцитов транспортировать кислород, что приводит к гипоксии.
Антиоксиданты (витамины С, А, Е, селен и др.) препятствуют образованию метгемоглобина за счет инактивации свободных радикалов. А вот уже образовавшийся гематин перевести обратно в гем могут только специальные ферменты — НАДН- и НАДФН-метгемоглобинредуктаза. Именно эти ферменты восстанавливают Fe3+ в составе метгемоглобина до Fe2+ гемоглобина.
Глобин
Глобин — это альбуминовый белок, который составляет 96% массы гемоглобина и состоит из 4 цепей — 2 α и 2 β .
Каждая альфа-цепь глобина состоит из 141 аминокислоты, бета-цепь — из 146 аминокислот. Всего в молекуле гемоглобина присутствует 574 аминокислотных остатка.
Глобин человека, в отличие от глобина животных не содержит в своем составе аминокислот лейцин и цистин.
Молекулярный вес глобина составляет 64 400 г/моль (64,4 кДа).
Альфа- и бета-цепи глобина образуют 4 гидрофобным кармана, в которых располагается 4 гема. Именно гидрофобный карман белка глобина позволяет железу гема присоединять кислород не окисляясь, т.е. без перехода в Fe3+. Особое значение в формировании гидрофобного кармана играют 3 аминокислотных остатка: проксимальный гистидин, дистальный гистидин и валин.
источник
Из чего состоит молекула гемоглобина
Гемоглобин (Hb) — это сложный железосодержащий белок
