Физиологические и аномальные типы гемоглобина
Гемоглобины могут различаться по белковой части. Различают физиологические и аномальные типы гемоглобинов. Физиологические типы образуются на разных этапах нормального развития организма, а аномальные – вследствие нарушения последовательности аминокислот в белке глобине физиологических типов гемоглобина.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различаются следующие физиологические типы гемоглобинов:
а) примитивный НвР, появляется на самых ранних стадиях развития эмбриона (1 – 2 недели) Эмбриональный гемоглобин – тетрамер
б) фетальный гемоглобин НвF (от лат. Fetus – плод). НвF является главным типом гемоглобина плода и составляет к моменту рождения 70% всего гемоглобина – это тетрамер (
в) гемоглобин взрослого НвА, НвА2, НвА3 ( от лат. Adultus – взрослый ). НвА появляется на более поздних стадиях развития плода, в крови взрослого человека примерно 95 – 96% НвА – это тетрамер (2?, 2?). Гемогловин А2 – тетрамер . Его содержание в эритроцитах взрослого человека равно 2%.
Аномальные гемоглобины. Их обнаружено более 200 и отличаются они составом цепей или заменой аминокислот в полипептидных цепях. Из аномальных гемоглобинов часто встречается HвS или серповидно-клеточный Нв. Он обнаруживается у больных серповидно-клеточной анемией. Это широко распространенное заболевание в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Гемоглобин S отличается по ряду свойств от нормального гемоглобина. После отдачи кислорода в тканях он превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов. Последние деформируют клетку и приводят к массивному гемолизу.
Химический дефект при серповидно-клеточной анемии сводится к замене в белке одной аминокислоты на другую. В норме в b – субъединицах тетрамерной структуры гемоглобина в шестом положении со стороны N – конца находится глутаминовая аминокислота, боковая группа которой имеет отрицательный заряд и характеризуется высокой гидрофильностью. При серповидно-клеточной анемии глутаминовая аминокислота заменена на гидрофобную аминокислоту – валин. Однако одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития болезни.
Миоглобин также относится к хромопротеинам. Это белок, имеющий третичную структуру. Вторичная и третичная структура миоглобина и протомеров гемоглобина очень сходны. Функции миоглобина и гемоглобина одинаковы. Оба белка участвуют в транспорте кислорода. Гемоглобин присоединяет кислород из альвеолярного воздуха и доставляет его в ткани. Миоглобин присоединяет кислород, доставленный гемоглобином и служит промежуточным звеном в транспорте кислорода внутри клетки к митохондриям, а также для запасания кислорода в тканях, создавая кислородный резерв, который расходуется по мере необходимости. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в тканях падает, кислород освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения энергии, необходимой для работы мышц.
УГЛЕВОД – БЕЛКОВЫЕ КОМПЛЕКСЫ
Это комплексы белков с небелковой частью, представленной углеводными компонентами.
Смешанные макромолекулы этого типа делятся на :
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Билет
92
К группе гемопротеидов
относятся гемоглобин и его производные,
миоглобин и ферменты – цитохромная
система, каталаза и пероксидаза.
Все хромопротеиды
содержат различные по составу и структуре
белки. Небелковый компонент обладает
структурным сходством.
Строение
гемоглобина.
В молекуле гемоглобина
белковый компонент представлен белком
глобином, небелковый компонент – гем.
Глобин состоит из 4
субъединиц 2![]()
и 2![]() .
.
Каждая
![]() -цепь
-цепь
содержит по 141 аминокислотному остатку,
а
![]()
– по 146.
Внутри каждой
субъединицы имеется гидрофобный
«карман», в котором располагается гем.
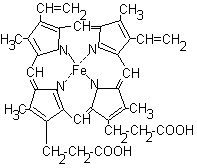
Гем представляет
собой плоскую молекулу, содержащую 4
пиррольных цикла и соединенный с ними
атом железа:

Гем соединяется с
белковой частью (глобином) гидрофобными
связями между пиррольными циклами и
гидрофобными радикалами аминокислот.
Между атомом железа и имидазольным
кольцом одного из остатков гистидина
в глобине имеется координационная
связь. За счет еще одной координационной
связи к атому железа может присоединяться
молекула кислорода с образованием
оксигемоглобина.
Пиррольные кольца
гема расположены в одной плоскости, а
атом железа выступает из этой плоскости.
Присоединение кислорода «выпрямляет»
молекулу гема: железо перемещается в
плоскость пиррольных колец и это вызывает
изменение конформации белка. В молекуле
гемоглобина имеется 4 протомера, каждый
из которых содержит гем и может
присоединять кислород. Присоединение
первой молекулы кислорода изменяет
конформацию протомера. Изменение
конформации одного протомера изменяет
конформацию остальных протомеров.
Изменение конформации протомеров
облегчает присоединение остальных
молекул кислорода. Это явление называется
кооперативным действием. Сродство
гемоглобина к четвертой молекуле О2
примерно в 300 раз больше, чем к первой.
Функция
гемоглобина.
Состоит в связывании
и переносе кислорода от легких к тканям.
Гемоглобин, связанный кислородом,
называется оксигемоглобином.
Производные гемоглобина.
Молекула гемоглобина
имеет большое сродство к оксиду углерода
(II) СО. Это карбоксигемоглобин.
Сродство СО к гемоглобину примерно в
300 раз выше, чем к кислороду. Это
свидетельствует о высокой токсичности
угарного газа, поэтому при отравлении
СО необходимо, пострадавшего вынести
на воздух, чтобы увеличить поступление
кислорода.
Гемоглобин связывает
также СО2 с образованием
карбгемоглобина.
Типы гемоглобинов.
Различают физиологические
и аномальные гемоглобины.
Физиологические
гемоглобины образуются на разных этапах
нормального развития организма, а
аномальные – вседствие нарушений
последовательности аминокислот в
глобине.
Физиологические типы
гемоглобина.
Примитивный – HbP
(относятся гемоглобины, называемые
Говер 1 и Говер 2)Фетальный гемоглобин
HbF (гемоглобин плода).Гемоглобин взрослых:
HbА1, HbА2,
HbА3.
HbР
появляется на ранних стадиях развития
эмбриона. Примитивные гемоглобины
заменяются на HbF. На поздних
стадиях развития плода появляются
гемоглобины взрослых – HbА1,
HbА2.
В крови взрослого
человека примерно 95-96% HbА1,
2-3% HbА3, 0,1-0,2% HbF.
Гемоглобин А1
содержит по 2![]()
и
![]()
цепи. Гемоглобин А2 – по 2
![]()
и
![]() -цепи.
-цепи.
Гемоглобин F – по 2
![]()
и
![]() -цепи.
-цепи.
Гемоглобин Говер 1 содержит 4
![]()
цепи, Говер 2 – 2![]()
и 2
![]() цепи
цепи
по мере созревания плода
![]() -цепи
-цепи
заменяются
![]() -цепями.
-цепями.
Аномальные типы
гемоглобина
В крови человека
открыто около 150 типов мутантных
гемоглобинов. Аномальные гемоглобины
различаются по форме, химическому
составу, величине заряда. Выделены
аномальные гемоглобины при помощи
методов электрофореза и хроматографии.
Передающиеся по наследству изменения
– результат мутации единственного
триплета, который приводит к замене
одной аминокислоты на другую (с резко
отличающимися свойствами – пример
серповидноклеточная анемия – глу
заменен на вал).
Патология обмена
гемоглобина.
Болезни гемоглобинов
(их около 200) называют гемоглобинозами.
Гемоглобинозы делят
на:
Гемоглобинопатии
– в основе лежат наследственные
изменения структуры какой-либо цепи
нормального гемоглобина («молекулярные
болезни»).Талассемии –
нарушение синтеза какой-либо цепи
гемоглобина.Железодефицитные
анемии.
Классическим примером
наследственной гемоглобинпатии является
серповидноклеточная анемия. Глу в 6-м
положении в
![]() -цепи
-цепи
заменен на вал. Эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Такой гемоглобин
после отдачи кислорода превращается в
плохо растворимую форму и начинает
выпадать в осадок в виде веретенообразных
кристаллоидов, которые деформируют
клетку и вызывают массивный гемолиз.
Талассемии – генетически
обусловленной нарушение синтеза одной
из нормальных цепей гемоглобина.
Угнетение синтеза
![]() -цепей
-цепей
вызывает развитие
![]() -талассемии,
-талассемии,
угнетение синтеза
![]() -цепей
-цепей
–
![]() -талассемия.
-талассемия.
При
![]() -талассемии
-талассемии
появляется до 15% HbA2,
повышается до 15-60% содержание фетального
гемоглобина. Болезнь характеризуется
гиперплазией и разрушением костного
мозга, поражением печени, деформацией
черепа и тяжелой гемолитической анемией.
Эритроциты имеют мишеневидную форму.
Механизм изменения формы эритроцитов
не выяснен. Название связано с тем, что
возникает у людей, живущих на побережье
Средиземного моря.
Порфирии.
Порфирии – группа
заболеваний с наследственной
предрасположенностью, возникающих в
результате блокирования начальных
стадий синтеза гема и сопровождающихся
увеличением содержащихся порфиринов
в организме.
Г лицин Сукцинил-КоА
лицин Сукцинил-КоА
![]() -аминолевуленовая
-аминолевуленовая
кислота
![]()
порфобилиноген

![]()
уропорфириноген
![]()
копропорфириноген

![]()
протопорфирин
IX

![]()
феррохелатаза
Гем
Блок – 1 – острая
перемеживающая порфирия. Накапливается
![]() -АМК
-АМК
и порфобилиноген
Блок – 2 – приводит к
накоплению всех предшествующих продуктов.
Молекулярный механизм неизвестен.
Болк – 3 – эритропоэтическая
протопорфирия связана с отсутствием
фермента феррохелатазы, каторая
присоединяет к молекуле протопорфирина
IX Fe2+.
Распад гема
За сутки в организме
распадается около 9 г гемопротеидов.
Период жизни эритроцитов 120 дней,
разрушаются они в кровеносном русле
или в селезенке. Гемоглобин связывается
с гаптоглобином и в виде комплекса
гаптоглобин-гемоглобин поступает в
клетки ретикулоэндотелиальной системы
селезенки. Комплекс гаптоглобин-гемоглобин
распадается и гаптоглобин переходит в
кровь, а гемоглобин окисляется в
метгемоглобин (Fe3+).
В РЭС селезенки
гемоглобин под действием гемоксигеназы
превращается в вердоглобин. Вердоглобин
теряет Fe, которое связывается
трансферином и доставляется кровью в
костный мозг. Вердоглобин отдает белок
глобин и превращается в биливердин. При
восстановлении биливердина НАДФ Н2
образуется билирубин.
Билирубин – плохо
растворимое соединение и в крови
связывается с альбумином. В виде комплекса
альбумин-билирубин идет транспорт
билирубина кровью в клетки печени. В
печени билирубин соединяется с
глюкуроновой кислотой с образованием
моно (20%) и диклюкуронидов (80%), они хорошо
растворимы в воде. Этот вид билирубина
называется конъюгированным билирубином
(связан с глюкуроновой кислотой), а также
называется связанным прямым, т.к. может
быть прямо обнаружен с помощью реактива
Эрлиха.
Билирубинглюкурониды
в незначительных количествах диффундируют
в кровеносный капилляр. В плазме крови
присутствуют 2 формы билирубина:
неконъюгированный (непрямой, свободный)
и конъюгированный (прямой, связанный)
– 25% от общего билирубина. Билирубинглюкурониды
с желчью поступают в кишечник, где от
них отщепляется глюкуроновая кислота
и вновь образуется неконъюгированный
билирубин. В тонком кишечнике небольшая
часть билирубина может всосаться и
через портальную вену вновь поступать
в печень. Остальной билирубин подвергается
действию кишечных бактерий и в тонком
кишечнике билирубин превращается в
уробилиноген. Уробилиноген всасывается
в тонком кишечнике и через воротную
вену поступает в печень, где уробилиноген
разрушается до моно- дипирролов.
Не разрушенный
уробилиноген вновь с желчью поступает
в кишечник и восстанавливается до
стеркобилиногена (бесцветен).
Стеркобилиноген окисляется до стеркобилина
и выделяется с фекалиями. Небольшое
количество стеркобилиногена поступает
в почки, затем окисляется до стеркобилина
и выделяется с мочой.
В норме содержание
общего билирубина в сыворотке крови
составляется 8-20 мкмоль/л.
4
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
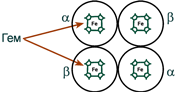
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).

