Формула простетической группы гемоглобина
Гемоглобин (НЬ)– сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
В мышцах внутриклеточный транспорт и кратковременное депонирование кислорода осуществляет другой белок – миоглобин (Mb). Он не является олигомером, так как состоит только из одной полипептидной цепи, конформация которой очень похожа на пространственную структуру β-цепи гемоглобина (рис. 1.20). Большую часть молекулы
Рис. 1.20. Структура миоглобина иβ-цепи гемоглобина
А– миоглобин; Б– β-цепь гемоглобина
Mb и протомеров Hb составляют 8 α-спиральных участков, образующих глобулу с гидрофобным углублением, в котором находится центр связывания с кислородом (активный центр).При этом полипептидные цепи миоглобина и протомеров гемоглобина идентичны всего на 20%.
Оба белка являются холопротеинами, простетическая группа – гем, который находится в активном центре и участвует во взаимодействии с кислородом (рис. 1.21). Гем(ферропротопорфирин) представляет собой органическое соединение с плоской молекулой, включающей 4 пиррольных цикла и ион железа Fe2+. Он является окрашенным соединением и придает красный цвет гемоглобину, эритроцитам (красные кровяные тельца) и крови.
Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а также к радикалу гистидина с помощью атома Fe. Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема (рис. 1.22). В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Рис. 1.21. Строение гемоглобина и гема
А– гемоглобин– сложный белок, олигомер, состоит из 2 α- и 2 β-субъединиц глобина, каждая имеет центр связывания, где располагается небелковая часть молекулы – гем. Он участвует в присоединении молекулы кислорода. Между протомерами образуется аллостерический центр для присоединения регуляторного лиганда гемоглобина 2,3-бисфосфоглицерата;
Б– гем– простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. В центре молеку-
2+
лы расположен ион железа (Fe ), который образует 6 координационных связей: 4 – с атомами азота пиррольных колец гема, 1 – с азотом радикала гистидина цепей глобина, 1 – с молекулой кислорода. В присоединении О2к гему участвует еще один радикал гистидина цепи глобина
Рис. 1.22. Взаимодействие кислорода с гемом в миоглобине и гемоглобине
Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр:
Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода
ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих.
Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями.Они характерны для всех олигомерных белков и используются для регуляции их активности.
Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24).
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях.
График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию – обратимое связывание с
Рис. 1.23. Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом
А– при взаимодействии молекулы дезоксигемоглобина НЬ с О2 происходят кооперативные конформационные изменения, которые сопровождают присоединение каждой последующей молекулы кислорода; Б– в результате изменения конформации активного центра возрастает сродство НЬ к кислороду, 4-я молекула кислорода присоединяется к оксигенированному гемоглобину [НЬ(О2)3] в 300 раз легче, чем 1-я
Рис. 1.24. Кривые насыщения миоглобина и гемоглобина кислородом
кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Изменение сродства гемоглобина к О2 обеспечивает быстрое насыщение крови кислородом в легких, а также освобождение и передачу его в ткани. Миоглобин обладает более высоким сродством к О2, поэтому связывает и передает в митохондрии клеток кислород, транспортируемый НЬ в мышцы.
Гемоглобин доставляет в сутки до 600 л (850 г) О2 в ткани и способствует удалению из них ~ 500 л (1000 г) СО2. Движущей силой этих потоков является градиент концентраций О2 между альвеолярным воздухом и межклеточной жидкостью. Парциальное давление О2 в альвеолярном воздухе составляет 100 мм рт.ст. Парциальное давление О2
в тканях намного ниже (~ 40 мм рт.ст.), что обусловлено поступлением и использованием кислорода митохондриями клеток, где он превращается в Н2О. Таким образом О2 поглощается клетками.
Обмен О2 и СО2 происходит в капиллярах: в легких О2 переходит из альвеолярного воздуха в эритроциты, а СО2 – в обратном направлении; в капиллярах тканей О2 из эритроцитов перемещается в клетки тканей, а СО2 – в обратном направлении (рис. 1.25).
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией,а соединения-регуляторы –аллостерическими лигандами.Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Молекула гемоглобина способна связываться с несколькими лигандами: О2, Н+, СО2, 2,3-бис- фосфоглицератом (БФГ). Н+, СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра.
Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц.
Рис. 1.25. Перенос кислорода и диоксида углерода гемоглобином. Эффект Бора
БФГ образуется из глюкозы в эритроцитах и является одним из регуляторов работы гемоглобина. Его молярная концентрация в крови близка к молярной концентрации НЬ. В центре молекулы гемоглобина полипептидные цепи 4 протомеров образуют полость (аллостерический центр), причем величина ее увеличивается в дезоксигемоглобине и уменьшается в оксигемоглобине. БФГ поступает в полость дезоксигемоглобина, связываясь с положительно заряженными группами на β-протомере (рис. 1.26). При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2.
Рис. 1.26. Связывание БФГ с дезоксигемоглобином
Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию НЬ и освобождению БФГ.
Содержание БФГ в крови человека соответствует содержанию гемоглобина и повышается при понижении содержания кислорода в воздухе (гипоксии) или затруднении дыхания при заболеваниях легких. Понижение его концентрации ухудшает снабжение тканей кислородом.
Это важно учитывать при переливании крови и сохранять необходимую концентрацию БФГ при консервации. Переливание донорской крови с пониженным содержанием БФГ может привести к гипоксии и гибели больных.
В регуляции работы гемоглобина основная роль принадлежит протонам Н+. • В тканиНЬ поступает преимущественно в виде НЬ(О2)4. Но при низком парциальном давлении О2 происходит отщепление части кислорода. Увеличение содержания не полностью оксигенированных форм НЬ облегчает высвобождение О2.
В мышцах образуется много СО2, который под действием карбоангидразы превращается в угольную кислоту Н2СО3, диссоциирующую на Н+ и бикарбонат-ион:
СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Повышение концентрации Н+ вызывает протонирование ионогенных групп НЬ, что приводит к снижению его сродства к О2:
Н+ + НЬ О2 → Н+ НЬ + О2
Далее с дезоксигемоглобином взаимодействует
БФГ:
В легкиепоступает кровь с высоким содержанием дезоксигемоглобина, протонированного, связанного с БФГ или СО2. В такой форме гемоглобин имеет пониженное сродство к О2.
Из капилляров диффундирует СО2, освобождающийся в результате реакции:
Н+ + НСО-3 → Н2СО3 → СО2 + Н2О
Это стимулирует депротонирование гемоглобина:
Н+ НЬ → Н+ + НЬ
Высокое парциальное давление О2 приводит к оксигенированию НЬ, при этом вытесняется БФГ:
НЬ БФГ → НЬ + БФГ
Частичное оксигенирование гемоглобина повышает его сродство к кислороду, все реакции, приведенные выше, происходят в обратном порядке.
Зависимость сродства гемоглобина к кислороду от концентрации ионов водорода (Н+) получила названиеэффекта Борапо имени датского физиолога, изучавшего функционирование гемоглобина (см. рис. 1.25).
Таким образом, количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
274-275
Òêàíè è îðãàíû. Êðîâü
Ãåìîãëîáèí
 Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
(ñì. ñ. 268)
òðàíñïîðò êèñëîðîäà îò ëåãêèõ â òêàíè è ÑÎ2 îò òêàíåé
îáðàòíî â ëåãêèå. Âûñøèå îðãàíèçìû íóæäàþòñÿ äëÿ ýòîãî â ñïåöèàëüíîé
òðàíñïîðòíîé ñèñòåìå, òàê êàê ìîëåêóëÿðíûé êèñëîðîä ïëîõî ðàñòâîðèì â âîäå:
â 1 ë ïëàçìû êðîâè ðàñòâîðèìî òîëüêî îêîëî 3,2 ìë Î2.
Ñîäåðæàùèéñÿ â ýðèòðîöèòàõ áåëîê ãåìîãëîáèí (Hb) ñïîñîáåí ñâÿçàòü
â 70 ðàç áîëüøå 220 ìë Î2/ë. Ñîäåðæàíèå Hb â êðîâè ñîñòàâëÿåò
140-180 ã/ë ó ìóæ÷èí è 120-160 ã/ë ó æåíùèí, ò. å. âäâîå âûøå ïî ñðàâíåíèþ ñ
áåëêàìè ïëàçìû (50-80 ã/ë). Ïîýòîìó Hb âíîñèò íàèáîëüøèé âêëàä â îáðàçîâàíèå
ðÍ-áóôåðíîé åìêîñòè êðîâè (ñì. ñ. 280).
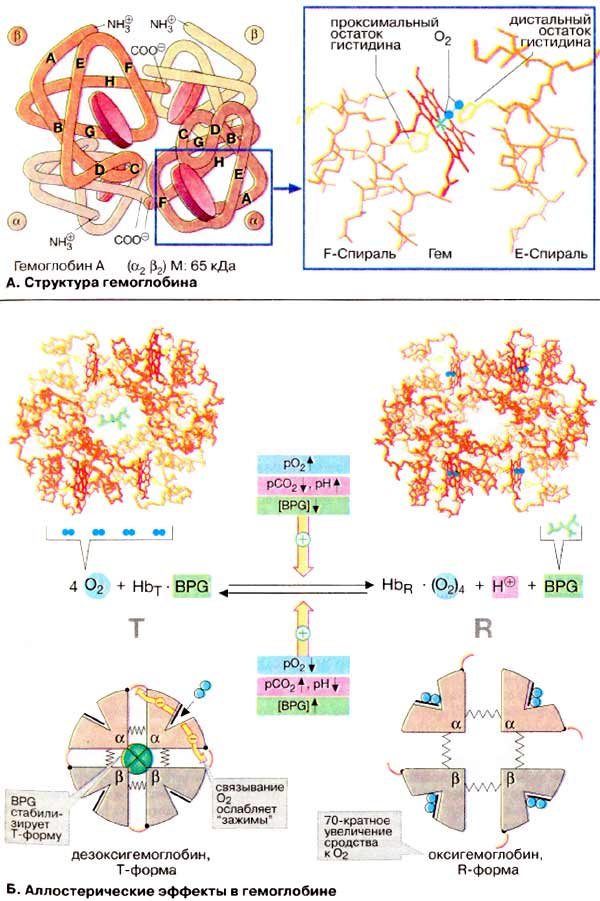
À. Ñòðóêòóðà
ãåìîãëîáèíà
Ãåìîãëîáèí âçðîñëîãî îðãàíèçìà
(HbA, ñì. íèæå) ÿâëÿåòñÿ òåòðàìåðîì, ñîñòîÿùèì èç äâóõ α- è äâóõ
β-ñóáüåäèíèö ñ ìîëåêóëÿðíûìè ìàññàìè ïðèìåðíî 16 êÄà. α- è β-öåïè îòëè÷àþòñÿ
àìèíîêèñëîòíîé ïîñëåäîâàòåëüíîñòüþ, íî èìåþò ñõîäíóþ êîíôîðìàöèþ. Ïðèìåðíî 80%
àìèíîêèñëîòíûõ îñòàòêîâ ãëîáèíà îáðàçóþò α-ñïèðàëè, îáîçíà÷åííûå áóêâàìè
À-Í (ñì. ñõåìó). Êàæäàÿ ñóáúåäèíèöà íåñåò ãðóïïó ãåìà (ôîðìóëó ñì. íà ðèñ.
197) ñ èîíîì äâóõâàëåíòíîãî æåëåçà â öåíòðå. Ïðè ñâÿçûâàíèè
O2ñ àòîìîì æåëåçà â ãåìå (îêñèãåíàöèÿ Hb) è îòùåïëåíèè
O2 (äåçîêñèãåíàöèÿ) ñòåïåíü îêèñëåíèÿ àòîìà æåëåçà íå
ìåíÿåòñÿ. Îêèñëåíèå Fe2+ äî Fe3+ â ãåìå íîñèò ñëó÷àéíûé
õàðàêòåð. Îêèñëåííàÿ ôîðìà ãåìîãëîáèíà, ìåòãåìîãëîáèí, íå ñïîñîáíà
ïåðåíîñèòü O2. Äîëÿ ìåòãåìîãëîáèíà ïîääåðæèâàåòñÿ ôåðìåíòàìè íà
íèçêîì óðîâíå è ñîñòàâëÿåò ïîýòîìó îáû÷íî òîëüêî 1-2%.
×åòûðå èç øåñòè êîîðäèíàöèîííûõ ñâÿçåé
àòîìà æåëåçà â ãåìîãëîáèíå çàíÿòû àòîìàìè àçîòà ïèððîëüíûõ êîëåö, ïÿòàÿ
îñòàòêîì ãèñòèäèíà ãëîáèíà (ïðîêñèìàëüíûé îñòàòîê ãèñòèäèíà), à øåñòàÿ
ìîëåêóëîé êèñëîðîäà â îêñèãåìîãëîáèíå è, ñîîòâåòñòâåííî, Í2Î â
äåçîêñèãåìîãëîáèíå.
Á. Àëëîñòåðè÷åñêèå ýôôåêòû â
ãåìîãëîáèíå
Àíàëîãè÷íî àñïàðòàò-êàðáàìîèëòðàíñôåðàçå
(ñì. ñ. 118) Hb ìîæåò íàõîäèòüñÿ â äâóõ ñîñòîÿíèÿõ (êîíôîðìàöèÿõ):
îáîçíà÷àåìûõ êàê Ò- è R-ôîðìû ñîîòâåòñòâåííî. Ò-Ôîðìà (íàïðÿæåííàÿ îò
àíãë. tense) îáëàäàåò ñóùåñòâåííî áîëåå íèçêèì ñðîäñòâîì ê O2
ïî ñðàâíåíèþ ñ R-ôîðìîé (íà ñõåìå ñïðàâà). Ñâÿçûâàíèå O2 ñ îäíîé èç
ñóáúåäèíèö Ò-ôîðìû ïðèâîäèò ê ëîêàëüíûì êîíôîðìàöèîííûì èçìåíåíèÿì, êîòîðûå
îñëàáëÿþò ñâÿçü ìåæäó ñóáúåäèíèöàìè. Ñ âîçðàñòàíèåì ïàðöèàëüíîãî äàâëåíèÿ
O2 óâåëè÷èâàåòñÿ äîëÿ ìîëåêóë Hb â âûñîêîàôôèííîé R-ôîðìå (îò àíãë.
relaxed). Áëàãîäàðÿ êîîïåðàòèâíûì âçàèìîäåéñòâèÿì ìåæäó ñóáúåäèíèöàìè ñ
ðîñòîì êîíöåíòðàöèè êèñëîðîäà ïîâûøàåòñÿ ñðîäñòâî Hb ê O2, â
ðåçóëüòàòå ÷åãî êðèâàÿ íàñûùåíèÿ èìååò ñèãìîèäàëüíûé âèä (ñì. ñ
276).
Íà ðàâíîâåñèå ìåæäó Ò- è R-ôîðìàìè
âëèÿþò ðàçëè÷íûå àëëîñòåðè÷åñêèå ýôôåêòîðû, ðåãóëèðóþùèå ñâÿçûâàíèå
O2 ãåìîãëîáèíîì (æåëòûå ñòðåëêè). Ê íàèáîëåå âàæíûì ýôôåêòîðàì
îòíîñÿòñÿ CO2, Í+ è 2,3-äèôîñôîãëèöåðàò [ÄÔÃ (BPG)]
(ñì. ñ. 276).
Äîïîëíèòåëüíàÿ
èíôîðìàöèÿ
Hb âçðîñëîãî îðãàíèçìà ñîñòîèò, êàê
óïîìÿíóòî âûøå, èç äâóõ α- è äâóõ β-öåïåé (α2β2). Íàðÿäó ñ
ýòîé îñíîâíîé ôîðìîé (HbA1) â êðîâè ïðèñóòñòâóþò
íåçíà÷èòåëüíûå êîëè÷åñòâà âòîðîé ôîðìû ñ áîëåå âûñîêèì ñðîäñòâîì ê
O2, ó âòîðîé β-öåïè çàìåíåíû δ-öåïÿ-ìè (HbA2,
α2δ2). Äâå äðóãèå ôîðìû Hb âñòðå÷àþòñÿ òîëüêî â
ýìáðèîíàëüíîì ïåðèîäå ðàçâèòèÿ. Â ïåðâûå òðè ìåñÿöà îáðàçóþòñÿ ýìáðèîíàëüíûå
ãåìîãëîáèíû ñîñòàâà ξ2ε2 è α2γ2.
Çàòåì âïëîòü äî ðîæäåíèÿ äîìèíèðóåò ôåòàëüíûé ãåìîãëîáèí (HbF,
α2δ2), êîòîðûé ïîñòåïåííî çàìåíÿåòñÿ íà ïåðâîì ìåñÿöå
æèçíè íà HbÀ. Ýìáðèîíàëüíûé è ôåòàëüíûé ãåìîãëîáèíû îáëàäàþò áîëåå âûñîêèì
ñðîäñòâîì ê Î2 ïî ñðàâíåíèþ ñ HbÀ, òàê êàê îíè äîëæíû ïåðåíîñèòü
êèñëîðîä èç ñèñòåìû ìàòåðèíñêîãî êðîâîîáðàùåíèÿ.
