Формы гемоглобина и их характеристика
Гемоглобин – это необходимый белок для жизнедеятельности человека, он выполняет ряд функций, основной из которых является транспортировка кислорода к клеткам и тканям. Существует несколько форм гемоглобина, каждая из которых обладает своими характеристиками.

Виды по белковому содержанию
В зависимости от белкового содержания формы гемоглобина человека бывают двух видов. Это физиологические и аномальные.
Формы гемоглобина физиологического типа возникают на определенных этапах жизнедеятельности человека. А вот патологические формируются в случае неправильной последовательности размещения ряда аминокислот в глобине.
Основные виды гемоглобина по формам
В человеческом организме могут присутствовать:
- Оксигемоглобин. Это вещество взаимодействует с молекулами кислорода. Присутствует в крови артерий, поэтому она и обладает насыщенно алым цветом.
- Карбоксигемоглобин. Эта разновидность белков взаимодействует с молекулами углекислого газа. Представленные молекулы проникают в ткани легких, где происходит выведение углекислого газа и насыщение кислорода гемоглобином. Эта разновидность белка присутствует в венозной крови, за счет чего она обладает более темным окрасом и большей густотой.
- Метгемоглобин. Это вещество, взаимодействующее с разнообразными химическими агентами. Патологическая форма гемоглобина, а увеличение количества этого вещества может указывать на отравление организма, происходит нарушение насыщаемости тканей кислородом.
- Миоглобин. Выступает в качестве полноценного аналога красных кровяных телец. Основное различие заключается только в том, что местом расположения этого белка являются сердечные мышцы. При повреждении мышц происходит попадание миоглобина в русло крови, после чего он выводится из организма благодаря функционированию почек. Но присутствует вероятность закупорки канальца почек, что может спровоцировать отмирание его тканей. В таких ситуациях не исключается возникновение почечной недостаточности и дефицита кислорода в тканях.
Другие виды гемоглобина
В различных информационных источниках выделяют еще и такие формы гемоглобина:
- Гликированный гемоглобин. Эта форма представляет собой неразделимое соединение глюкозы и белка. Такая разновидность глюкозы может перемещаться по крови на протяжении длительного времени, поэтому его применяют для выявления уровня сахара.
- Фетальный. Форма гемоглобина присутствует в крови эмбриона или новорожденного малыша в первые несколько дней жизнедеятельности. Причислен к активным видам в плане переноса кислорода, под воздействием окружающей среды подвергается быстрому разрушению.
- Сульфгемоглобин. Представленная разновидность белка возникает в крови при употреблении большого количества медикаментозных средств. Как правило, содержание этого белка не превышает 10 %.
- Дисгемоглобин. Формируется при таких связях, которые полностью лишают белок способности осуществлять его функции. Это указывает на то, что этот вид гемоглобина будет транспортироваться по крови в форме дополнительного вещества. По истечении времени он будет переработан селезенкой. При нормальном состоянии здоровья это вещество обнаруживается в организме каждого человека, но если случаи такого рода связок участятся, то органам, занимающимся транспортировкой крови по организму, придется функционировать с повышенной интенсивностью, в результате чего они быстрее истощатся и износятся.
Патологические формы гемоглобина
Выделяется отдельная группа:
- D-Пенджаб;
- S;
- C;
- H.
Свое название форма гемоглобина D-Пенджаб получила благодаря широкому распространению на территории Пенджаба, в Индии и Пакистане. Возникновение белка произошло из-за распространения малярии в различных частях Азии. Согласно статистическим данным, этот белок обнаруживается в 55 % случаев от общего числа патологических форм гемоглобина.
Гемоглобин S сформировался на территории Западной Африки в результате пяти отдельных мутаций.
Белок C входит в число наиболее распространенных структурных разновидностей гемоглобина. Люди, у которых присутствует этот белок, могут страдать от такого заболевания, как гемолитическая анемия.
Гемоглобин H провоцирует развитие такого серьезного заболевания, как альфа-талассемия.
Главные функции
Независимо от форм и производных гемоглобина, это вещество обладает следующими функциями:
- Транспортировка кислорода. Во время вдыхания человеком воздушных масс происходит проникновение молекул кислорода в ткани легких, а оттуда они перемещаются к другим тканям и клеткам. Гемоглобин соединяет молекулы кислорода и осуществляет их транспортировку. При нарушении этой функции возникает дефицит кислорода, что очень опасно для функционирования мозга.
- Транспортировка углекислого газа. В этой ситуации гемоглобин связывает уже молекулы углекислого газа, а затем осуществляет их транспортировку.
- Поддержание уровня кислотности. При скоплении углекислого газа в крови наблюдается ее закисление. Этого категорически нельзя допускать, поскольку обязано происходить постоянное выведение молекул углекислого газа.
Нормальные показатели
Для того чтобы врачи могли определить нормальные формы гемоглобина в организме у человека, осуществляется сдача анализов.
Отмечают, что норма свободного гемоглобина в крови людей различных возрастов может иметь такие показатели:
- мужчины в возрасте от 18 лет – от 120 до 150 г/л;
- женщины в возрасте от 18 лет – от 110 до 130 г/л;
- новорожденные и дети в возрасте до 18 лет – 200 г/л.
Увеличение или снижение количества свободного гемоглобина в крови может спровоцировать переход белка в другую форму – патологическую.
Отмечают ряд методов стабилизации его количества, поэтому если результаты анализов указывают на превышенный или сниженный показатель, нужно незамедлительно обращаться к доктору. В связи с наличием большой численности различных форм гемоглобина, определить присутствующую в организме в состоянии только профессиональный врач в лабораторных условиях. Обнаружение ее становится возможным при биохимическом анализе крови.
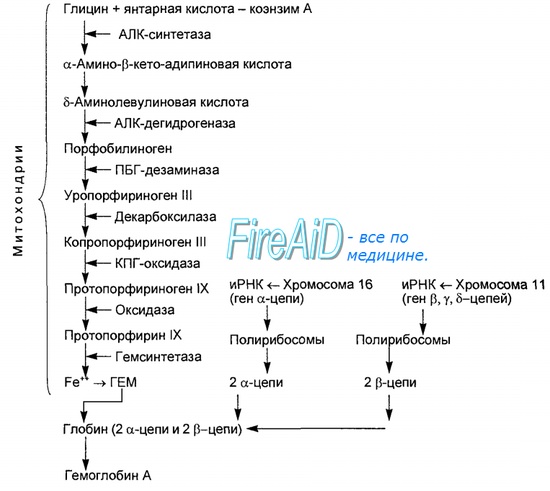
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
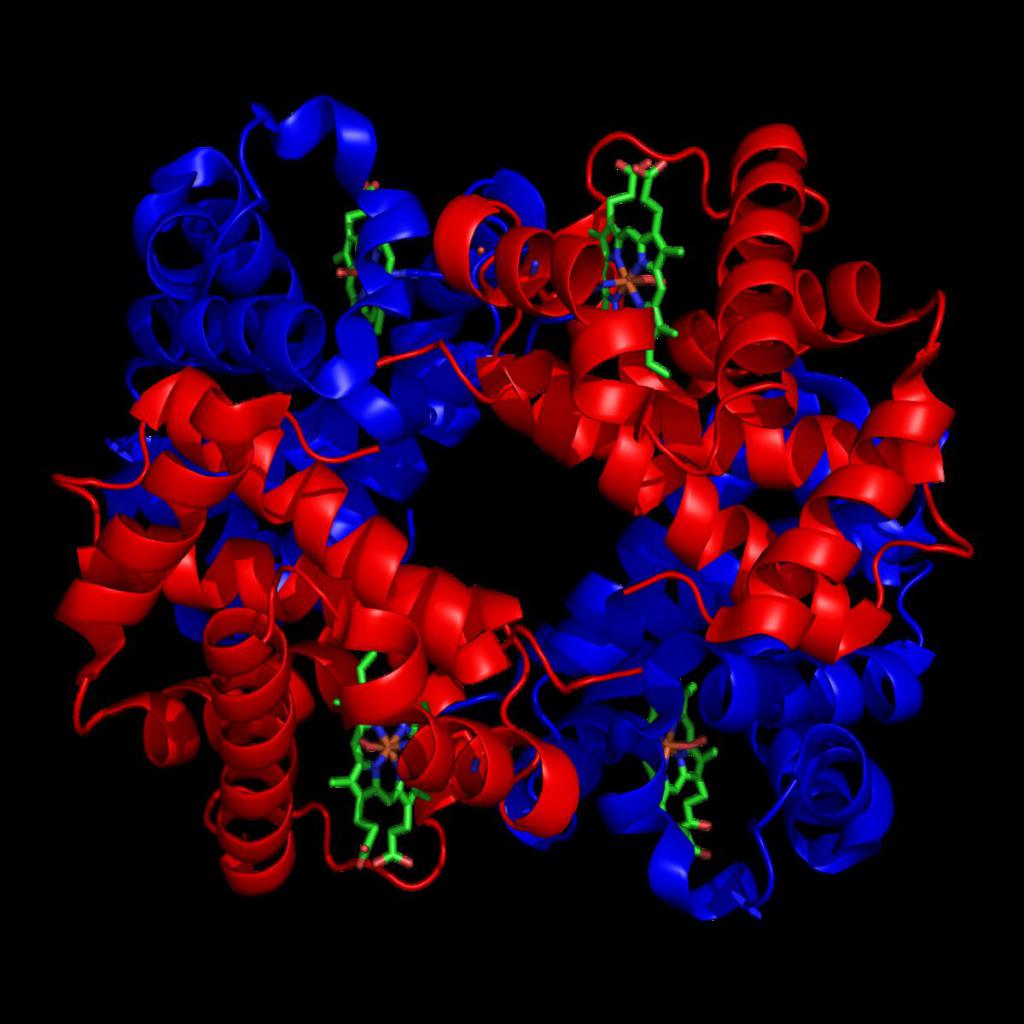
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Гемоглобин (Нb) составляет около 95 % белка эритроцитов. Один эритроцит содержит 280 млн молекул гемоглобина. Hb относится к сложным белкам – хромопротеидам. В его состав входит железосодержащая простетическая группа — гем (4 %) и простой белок типа альбумина — глобин (96 %).
Молекула Hb – тетрамер, состоящий из 4 субъединиц – полипептидных цепей глобина (2 цепи α и 2 цепей β, γ, δ, ε, ζ в разных комбинациях), каждая из которых ковалентно связана с одной молекулой гема. Гем (небелковая пигментная группа) построен из 4 молекул пиррола, образующих порфириновое кольцо, в центре которого находится атом железа (Fe2+). Основная функция Hb – перенос O2.
Синтез Hb происходит на ранних стадиях развития эритробластов. Синтез глобина и гема протекает в эритроидных клетках независимо друг от друга. У всех видов животных гем одинаков; различия свойств Нb обусловливаются особенностями строения белковой части его молекулы, т. е. глобина.
У взрослого человека в норме в крови содержится три типа гемоглобина: НbА (96–98 %); НbА2 (2–3 %) и НbF (1–2 %). Глобин человека состоит из 574 остатков различных аминокислот, образующих четыре попарно одинаковые полипептидные цепи: две α-цепи — по 141 аминокислотному остатку и две β-цепи — по 146 остатков аминокислот. Общая формула молекулы гемоглобина человека — НbА-α2β2.
В состав НbА2 входят две α и две δ-цепи (α2δ2), а НbF — две α- и две γ-цепи (α2γ2). Синтез цепей гемоглобина обусловливается структурными генами, ответственными за каждую цепь, и генами-регуляторами, осуществляющими переключение синтеза одной цепи на синтез другой.
На ранних стадиях эмбриогенеза (с 19-го дня по 6-ю неделю) синтезируются в основном эмбриональные гемоглобины – HbP (Гоуэр1 (ξ2ε2), Гоуэр2 (α2ε2) и Портлад (ξ2γ2)).
В течение указанного времени кроветворение постепенно переключается с желточного мешка на печень. При этом выключается синтез ξ- и ε-цепей и включается синтез γ-, β-, δ-цепей. К 4-му месяцу эритроциты печеночного происхождения доминируют в циркулирующей крови и содержат фетальный гемоглобин (HbF).
Гемоглобины различаются по биохимическим, физико-химическим, иммунобиологическим свойствам. Так, НbF по сравнению с НbА более устойчив к щелочам, менее — к температурным влияниям, обладает более высоким сродством к кислороду и способен быстрее отдавать углекислоту. К моменту рождения имеются оба типа Нb (НbF и НbА). Затем «фетальный» Нb постепенно сменяется «взрослым». Иногда у взрослых может обнаруживаться минимальное (до 2 %) количество НbF, что не имеет патологического значения.
При мутациях в структурных генах, контролирующих синтез Нb, когда заменяются аминокислоты, в полипептидных цепях глобина образуются аномальные гемоглобины.
Известно более 400 аномальных Нb, для которых характерны нарушения первичной структуры той или иной полипептидной цепи НbА (гемоглобинопатии, или гемоглобинозы). Основными видами таких Hb являются:
– серповидно-клеточный гемоглобин (НbS) — возникает при замене глютаминовой кислоты на валин в β-цепи; в этом случае развивается серповидно-клеточная анемия;
– метгемоглобины (около 5 разновидностей) образуются, если гистидин заменяется на тирозин; в этом случае окисление Нb в метгемоглобин, постоянно происходящее в норме, становится необратимым.
Количество гемоглобина в крови является важным клиническим показателем дыхательной функции крови. Оно измеряется в граммах на литр крови:
Лошади – в среднем 80-140 г/л,
КРС – 90-120 г/л,
Свиньи – 90-110 г/л,
Овцы – 70-110 г/л,
Птицы – 80-130 г/л,
Пушные звери – 120-170 г/л,
Человек – 120-170 г/л.
Формы гемоглобина:
Оксигемоглобин – соединение с O2.
Карбогемоглобин (HbCO2) – соединение с CO2.
Метгемоглобин (MetHb) – Hb, содержащий Fe гема в трёхвалентной форме (Fe3+); не переносит О2. Образуется в результате воздействия на эритроциты сильных окислителей (нитраты, нитриты, парацетамол, никотин, сульфаниламиды, лидокаин).
Карбоксигемоглобин – соединение с CO.
Гликозилированный Hb – Hb, модифицированный ковалентным присоединением к нему глюкозы (норма 5,8-6,2%). К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества гликозилированного Hb.
Солянокислый гематин – результат взаимодействия ферментов и соляной кислоты желудочного сока с Hb. Окрашивает дно эрозий и язв в коричневый цвет и придаёт рвотным массам при желудочном кровотечении вид «кофейной гущи».
Кристаллы гемоглобина у животных имеют видовые особенности, что используется для идентификации крови или её следов в судебной ветеринарии и медицине (солянокислый гематин в пробе Тейхмана).
Гемоглобин высоко токсичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. Например, особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.