Г 6 фдг анемия


Гемолитическая анемия, связанная с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) – наследственная гемолитическая анемия, связанная с дефицитом активности ферментов.
В отличие от микросфероцитоза она характеризуются нормальной формой эритроцитов с тенденцией к макропланоцитозу, нормальной или повышенной осмотической резистентностью эритроцитов, рецессивным типом наследования, отсутствием эффекта от спленэктомии.
Что провоцирует Гемолитическая анемия, связанная с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ): Согласно сведениям ВОЗ, в мире насчитывается около 100 миллионов человек с дефицитом активности Г-6-ФДГ. Наиболее часто эта аномалия встречается в странах Средиземноморского побережья (Италия, Греция), в некоторых странах Латинской Америки и Африки. В СНГ дефицит Г-6-ФДГ наиболее распространен среди жителей Азербайджана. Кроме того, носительство патологического гена описано у таджиков, грузин, русских. У детей с недостаточностью Г-6-ФДГ может проявиться фавизм. Дефицит Г-6-ФДГ наследуется по рецессивному типу, сцепленному с полом, в связи с чем клинические проявления данной патологии наблюдаются преимущественно у мужчин. При низкой активности Г-6-ФДГ в эритроцитах нарушаются процессы восстановления никотинамиддинуклеотидфосфата (НАДФ) и превращения окисленного глютатиона в восстановленный, предохраняющий эритроцит от разрушающего действия потенциальных гемолитических агентов (фенилгидразин, некоторые медикаменты, бобовые и т.д.).
Гемолиз происходит преимущественно внутрисосудисто. Кожа и внутренние органы желтушны. Отмечается увеличение и полнокровие печени и селезенки, умеренное увеличение и набухание почек. Микроскопически в почечных канальцах обнаруживают гемоглобинсодержащие цилиндры. В печени и селезенке наблюдается макрофагальная реакция с наличием в макрофагах гемосидерина.
Патогенез (что происходит?) во время Гемолитической анемии, связанной с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ): В основе патогенеза несфероцитарных гемолитических анемий лежит дефицит активности некоторых ферментов эритроцитов, в результате чего эритроциты становятся чувствительными к воздействию различных веществ растительного происхождения, лекарственных средств.
Симптомы Гемолитической анемии, связанной с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ): Как правило, дефицит Г-6-ФДГ не проявляется клинически без воздействия различных гемолитических агентов. Спровоцировать гемолитический криз могут противомалярийные препараты, сульфаниламиды, анальгетики, некоторые химиопрепараты (фурадонин, ПАСК), витамин К, растительные продукты (бобовые, стручковые). Выраженность гемолитического процесса зависит от степени дефицита Г-6-ФДГ и от дозы принятого препарата. Гемолиз наступает не сразу, а через 2 – 3 дня после приема препаратов. В тяжелых случаях у больных появляется высокая температура резкая слабость, боли в животе и спине, обильная рвота. Отмечается выраженная одышка, сердцебиение, нередко развитие коллаптоидного состояния. Характерным симптомом является выделение темной мочи, имеющей иногда черный цвет, что связанно с внутрисосудистым распадом эритроцитов и выделением с мочой гемосидерина. В некоторых случаях вследствие закупорки почечных канальцев продуктами распада гемоглобина и резкого снижения клубочковой фильтрации возможно развитие острой почечной недостаточности. При объективном исследовании отмечается желтушная окраска кожных покровов и слизистых оболочек, увеличение селезенки, реже печени. Через неделю гемолиз прекращается, независимо от того, продолжается прием препарата или нет.
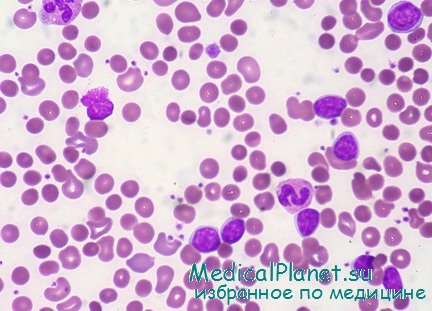
Диагностика Гемолитической анемии, связанной с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ): В течение первых двух суток гемолитического криза у больных развивается выраженная нормохромная анемия с падением гемоглобина до 30 г/л и ниже. Отмечается высокий ретикулоцитоз, наличие нормоцитов в крови. Особенностью эритроцитов является присутствие в них телец Гейнца, представляющих собой денатурированный гемоглобин и выявляющихся при суправитальной окраске. Осмотическая резистентность эритроцитов нормальная или повышена. Со стороны белой крови во время криза отмечается лейкоцитоз со сдвигом влево до миелоцитов и более молодых форм. В костном мозге наблюдается гиперплазия эритроидного ростка и явления эритрофагоцитоза. Диагноз острой гемолитической анемии, связанной с дефицитом Г-6-ФДГ, ставится на основании типичной клинико-гематологической картины острого внутрисосудистого гемолиза, связи заболевания с приемом лекарств и данных лабораторных исследований, выявляющих снижение активности Г-6-ФДГ в эритроцитах больных, а иногда их родственников. При диагностике необходимо учитывать географическую распространенность дефицита Г-6-ФДГ.
Лечение Гемолитической анемии, связанной с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ): Основным методом лечения острой гемолитической анемии при выраженном падении содержания гемоглобина являются повторные переливания свежецитратной одногруппной крови по 250 – 500 мл 1 – 2 раза в неделю внутривенные вливания больших количеств физиологического раствора или 5 % раствора глюкозы. В качестве противошоковых препаратов применяют морфин, преднизолон, промедол. Из сосудистых средств используют кордиамин, камфору. При развитии острой почечной недостаточности проводят обычный комплекс терапевтических мероприятий, при отсутствии эффекта показано проведение гемодиализа. При нетяжелых гемолитических кризах в качестве антиоксидантного препарата назначают эревит внутримышечно по 2 мл 2 раза в день.
Профилактика Гемолитической анемии, связанной с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ): Профилактика гемолитических кризов заключается в тщательном сборе анамнеза перед назначением средств, способных спровоцировать гемолитический криз при дефиците Г-6-ФДГ. При необходимости применения этих препаратов у лиц с дефицитом Г-6-ФДГ рекомендуется использовать средства для восстановления глютатиона. С этой целью применяют ксилит в суточной дозе 30 г в комбинации с рибофлавином в дозе 0,03 г в течение 1 – 2 месяцев. Прогноз неблагоприятен при развитии анурии и почечной недостаточности. При молниеносных формах заболевания смерть наступает от шока или острой аноксии.
Иллюстрации с сайта: © 2011 Thinkstock
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 октября 2013;
проверки требуют 7 правок.
Глюкозо-6-фосфат дегидрогеназа (Г6ФД; G6PD) — цитозольный фермент, входящий в пентозофосфатный путь, метаболический путь, обеспечивающий образование клеточного НАДФ-H из НАДФ+. НАДФ-H необходим для поддержания уровня восстановленного глутатиона в клетке, синтеза жирных кислот и изопреноидов. У человека наследственное нарушение активности Г6ФД, или недостаточность глюкозо-6-фосфатдегидрогеназы, приводит к гемолитической несфероцитарной анемии.
Реакция[править | править код]
Основная катализируемая реакция:
D-глюкозо-6-фосфат + NADP+ ↔ D-глюконо-1,5-лактон-6-фосфат + NADPH
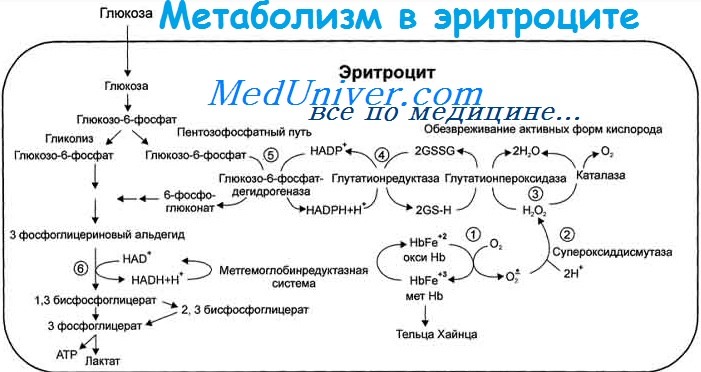
Глюкозо-6-фосфатдегидрогеназа – первый фермент пентозофосфатного гликолиза. Основная функция фермента заключается в восстановлении НАДФ до НАДФН, необходимого для перехода окисленного глутатиона (GSSG) в восстановленную форму. Восстановленный глутатион (GSH) требуется для связывания активных форм кислорода (перекисей). Пентозофосфатный гликолиз обеспечивает клетку энергией.
Недостаточность активности фермента снижает энергетические запасы клетки и приводит к развитию гемолиза, тяжесть которого зависит от количества и варианта глюкозо-6-фосфатдегидрогеназы. В зависимости от тяжести дефицита выделяют 3 класса вариантов Г-6-ФД. Дефицит глюкозо-6-фосфатдегидрогеназы сцеплен с Х-хромосомой, наследуется рецессивно. Больные мужского пола всегда гетерозиготны, женского – гомозиготны.
Наиболее важная функция пентозного цикла состоит в обеспечении достаточного образования восстановленного никотинамидадениндинуклеотидфосфата (НАДФ) для превращения окисленной формы глутатиона в восстановленную. Этот процесс необходим для физиологической дезактивации соединений окислителей, таких как перекись водорода, накапливающихся в эритроците. При снижении уровня восстановленного глутатиона или активности глюкозо-6-фосфатдегидрогеназы, необходимого для поддержания его в восстановленной форме, под влиянием перекиси водорода происходит окислительное денатурирование гемоглобина и белков мембраны. Денатурированный и преципитированный гемоглобин находится в эритроците в виде включений – телец Гейнца-Эрлиха. Эритроцит с включениями быстро удаляется из циркулирующей крови либо путём внутрисосудистого гемолиза, либо тельца Гейнца с частью мембраны и гемоглобина фагоцитируются клетками ретикулоэндотелиальной системы и эритроцит приобретает вид «надкусанного» (дегмацит).
Структура[править | править код]
Фермент состоит из 515 аминокислот (молекулярная масса 59,3 кДа). Находится в димерной или тетрамерной форме.
Изоформы[править | править код]
Существует 2 изоформы фермента: короткая и длинная. Короткая считается канонической как наиболее распространённая. Длинная версия отличается вставкой на месте аргинина-257: R → RGPGRQGGSGSESCSLSLGSLVWGPHALEPGEQGGELRRALASSVPR, что приводит к удлинению молекулы с 515 аминокислот до 561 и увеличению молекулярной массы до 63,8 кДа.
Потенциально опасные субстанции[править | править код]
Существует много субстанций, потенциально опасных для людей с дефицитом фермента G6PD, различные варианты ответа организма на введение этих субстанций затрудняет предсказание конкретного ответа у конкретного человека. Среди противомалярийных препаратов, которые могут вызвать острый гемолиз у людей с дефицитом фермента G6PD: primaquine, pamaquine и chloroquine. Имеются данные о том, что другие противомалярийные препараты также могут усугубить недостаточность G6PD, но в значительно более высоких дозах. Сульфаниламиды (sulfanilamide, sulfamethoxazole и mafenide), thiazolesulfone, метиленовый синий и нафталин также не должны использоваться у людей с недостаточностью G6PD, также как и некоторые анальгетики: аспирин, phenazopyridine и acetanilide, а также некоторые не-сульфонные антибиотики (nalidixic acid, nitrofurantoin и фуразолидон). Есть данные о том, что она вызывает гемолитический криз у новорожденных с недостаточностью G6PD.
Ссылки[править | править код]
- Глюкозо-6-фосфатдегидрогеназа (Г6ФД; G6PD).
- Гемолитическая несфероцитарная анемия (недостаточность глюкозо-6-фосфат дегидрогеназы: генетика.
Недостаточность Г-6-ФДГ является самым важным нарушением гексозомонофосфатного пути, ответственным за два клинически значимых синдрома: эпизодическая гемолитическая анемия, провоцируемая инфекциями, определенными лекарствами или, в редких случаях, употреблением в пищу некоторых сортов бобовых, и спонтанная хроническая несфероцитарная гемолитическая анемия.
В мире зарегистрировано 200 млн людей с этим Х-сцепленным дефицитом фермента; он является примером сбалансированного полиморфизма, который характеризуется эволюционным преимуществом устойчивости гетерозиготных женщин к тропической малярии, которое перевешивает незначительные негативные эффекты, наблюдаемые у зараженных гемизиготных мужчин.
Дефицит вызывается наследованием любого из множества аномальных аллелей гена, ответственных за синтез молекулы Г-6-ФДГ. Идентифицировано минимум 90 мутаций гена G6PD. Некоторые из них, вызывающие эпизодический и хронический гемолиз, показаны на рис. 556.2. Более легкие проявления связаны с мутациями около аминного конца молекулы Г-6-ФДГ, а хроническая несфероцитарная анемия — с мутациями в участке карбоксильного конца.
Нормальный фермент, обнаруживаемый у большей части населения, обозначается Г-6-ФДГ В+. Для афроамериканцев нормальным вариантом является Г-6-ФДГ А+. Более 100 вариантов Г-6-ФДГ обусловливают широкий спектр проявлений гемолитической болезни.
Г-6-ФДГ является ключевым ферментом в гексозомонофосфатном шунте метаболизма глюкозы; он катализирует превращение Г-6-Ф в 6-фосфоглюкуроновую кислоту (6-ФГ). В этом процессе образуется НАДФ-Н, который необходим для поддерживания глутатиона в восстановленном состоянии, т. е. GSSG —> GSH. Глутатион присутствует в эритроцитах в миллимольном количестве и нейтрализует агенты, которые потенциально окисляют гемоглобин или компоненты мембраны эритроцита.
Если не поддерживается восстановленное состояние глутатиона, при котором удаляются кислородные радикалы, образуемые препаратами-окислителями, то гемоглобин преципитирует с образованием телец Гейнца, вызывающих критическое разрушение мембраны. Преципитация гемоглобина и повреждение эритроцитарной мембраны приводят к преждевременному разрушению эритроцита или к гемолизу.
Синтез Г-6-ФДГ в эритроцитах определяется геном на Х-хромосоме. Следовательно, заболевания, связанные с поражением этого фермента, чаще встречаются у мужчин, чем у женщин. Примерно 13 % мужского афроамериканского населения имеет мутантный фермент (Г-б-ФДГ А-), результатом чего является снижение активности Г-б-ФДГ в эритроцитах до 5-15 % нормы. У итальянцев, греков и других жителей Средиземноморья, Среднего Востока, у африканцев и азиатов наиболее распространенным (5-40 % населения) является В- вариант Г-б-ФДГ (Г-б-ФДГ Средиземноморского типа).
В этих вариантах активность Г-6-ФДГ у гомозиготных женщин и гемизиготных мужчин составляет менее 5 % нормы. У гетерозиготных женщин наблюдается промежуточная активность фермента; как пример произвольной инактивации Х-хромосомы (по гипотезе Лайона (Lyon)) у них присутствуют две популяции эритроцитов: одна нормальная, а другая с дефицитом активности Г-6-ФДГ. У большей части гетерозиготные женщин не наблюдается клинически выраженного гемолиза после приема лекарств окислительного действия. В редких случаях большая часть эритроцитов у гетерозиготных женщин имеет дефицит Г-6-ФДГ в результате произвольной инактиваций” нормальной Х-хромосомы.
Отмечается значительная вариабельность дефекта у разных расовых групп. Например, у американцев африканского происхождения дефект выражен не так сильно, как у американцев европейского происхождения. У афроамериканцев электрофоретически определяемый вариант фермента нестабилен in vivo и его активность снижается с возрастом циркулирующего эритроцита. Ферментная активность эритроцитов, содержащих вариантный фермент (Г-6-ФДГ В-), у американцев европейского происхождения очень низкая и часто составляет менее 1 % нормальной активности остальных эритроцитов. Третий распространенный мутантный фермент со значительно сниженной активностью (Г-6-ФДГ Canton) встречается у 5 % китайского населения.
Большая группа других редких вариантов ферментов ассоциируется с медикаментозно-индуцированным гемолизом.
– Рекомендуем далее ознакомиться со статьей “Диагностика и лечение анемии при недостатке глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ)”
Оглавление темы “Анемии у детей”:
- Недостаточность глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Эпизодическая или индуцированная гемолитическая анемия
- Диагностика и лечение анемии при недостатке глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ)
- Аутоиммунные гемолитические анемии у детей. Причины
- Клиника и диагностика аутоиммунных гемолитических анемий
- Лечение аутоиммунных гемолитических анемий. Прогноз
- Холодовые антитела и анемия при ней. Пароксизмальная холодовая гемоглобинурия
- Внеклеточные причины гемолитических анемий. Фрагментированный гемолиз
- Полицитемия у детей. Первичная и вторичная полицитемии
- Панцитопении у детей. Конституциональная панцитопения – причины
- Диагностика и лечение наследственных панцитопений. Осложнения
Клиника недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах
Клиническая симптоматология недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах сводится к свойственным гемолитической анемии проявлениям. Явление гемолиза наблюдается лишь у тех носителей дефицита, количество активного фермента которых сокращено до менее 20% от нормальной концентрации.
Наиболее часто расплавление крови носит случайный характер, причем в этих случаях она относится за счет контакта с отдельными медикаментами или химическими веществами, инфекции — в основном вирусной (грипп, гепатит) — заглатывания фасоли вида Vicia faba.
На перинатальном периоде расплавление крови также может проявиться с достаточной силой и создать одинаковые проблемы с наблюдаемыми при гемолитической болезни новорожденного за счет несовместимости группы крови.
Отдельные редкие варианты фермента обусловливают гемолиз с хроническим течением (несфероцитная врожденная гемолитическая анемия).
При гемолитической анемии, вызванной контактом эритроцитов с медикаментозными веществами в условиях недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) клиническое проявление отмечается относительно быстро — спустя 1—2 дня после исходного контакта. В периферической крови наблюдаются красные кровяные клетки с тельцами Гейнца (составленными из денатурированного и осевшего гемоглобина) и понижение концентрации гемоглобина.
В последующие дни тельца Гейнца исчезают из кровообращения вместе с содержащими их эритроцитами, которые подвергаются быстрому разрушению сетчатой системой селезенки. Когда процесс гемолиза протекает с большой интенсивностью ощущаются боли в пояснице и животе, моча окрашивается в темный, иногда почти черный цвет, развивается ретикулоцитоз (на 4—5 день после появления гемолиза и лишь когда отсутствует инфекция).
При менее тяжелых формах дефицита, которые, впрочем, и наиболее частые, расплавление крови носит самоограничивающий характер, что объясняется ростом численности ретикулоцитов в кровообращении. В этих молодых элементах имеется значительная концентрация Г-6-ФД, способная сопротивляться обусловленному назначенным медикаментом стрессу.
У лиц, страдающих недостатком глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах при лихорадочных заболеваниях бактериальной или вирусной природы наблюдаются симптомы гемолиза, чаще умеренной силы. Несмотря на то, что, в основном, симптомы проявляются при гепатите и гриппе, тем не менее их могут обусловить и иные факторы.
Метаболизм эритроцитов – последствия энзимопатий, недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД)
У детей, страдающих этим дефицитом, гемолитические явления проявляются с особой силой на перинатальном периоде, приобретая аспект гемолитической болезни новорожденного, без возможности определения плодно-материнской несовместимости систем групп крови. Когда подобные случаи не отождествляются своевременно и не подвергаются соответствующему лечению (обменнозамещающее переливание крови — в случае интенсивного гемолиза) существует риск развития окончательных поражений, таких как ядерная желтуха.
Как уже отмечалось, определенные изоферменты глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) могут обусловить развитие гемолитической анемии хронического характера, средней интенсивности и лишь редко сопровождающейся острым падением показателя гемоглобина.
В связи с продолжительностью течения (первые проявления в раннем детском возрасте), спленомегалией — сопутствующей почти всем случаям, нередко семейного характера болезни и эпизодов усугубления (после лихорадочного заболевания или назначения медикаментов), с клинической точки зрения данный синдром часто рассматривается как наследственный сфероцитоз. Отсутствие характерных морфологических элементов, равно как и неэффективность удаления селезенки и положительные результаты отдельных специфических лабораторных тестов — делают возможным постановку точного диагноза.
И наконец, одно из наиболее тяжелых проявлений недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах это острое расплавление крови. Оно сопровождается массивной гемоглобинурией и, ведущим к смертельному исходу, шоковым состоянием, которое наступает через несколько часов после введения внутрь фасоли вида Vicia faba. Тяжелые несчастные случаи чаще наблюдаются у детей.
Патофизиология клинических признаков и биологических изменений недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах
Вопреки большому числу проведенных исследований полученные патофизиологические данные еще не привели к отождествлению всех факторов, способствующих сокращению продолжительности жизни эритроцитов с недостатком Г-6-ФД, в условиях стресса (контакт с медикаментами, инфекция и пр.).
Весьма вероятно, что контакт дефицитных эритроцитов с веществами окислительного действия составляет один из механизмов образования телец Гейнца в данных клетках. Процесс образования телец Гейнца сложный и еще неполно вскрыт. Предполагается, что химическое соединение, располагающее весьма большой окислительной способностью определяет, либо непосредственно, либо посредством перекиси водорода, окисление восстановленного глютатиона и образование дисульфидных комплексов между последним и гемоглобином.
Это «рассредоточивает» и денатурирует гемоглобин, способствуя его оседанию. Аггрегаты денатурированного гемоглобина закрепляются на внутренней поверхности оболочки (не исключается возможность реакции с белками оболочки эритроцитов). Оболочка становится жесткой, непрерывно искажается, в связи с чем данный эритроцит с «отпечатком» измененной присущей ему формы, быстро отождествляется и задерживается сетчатой системой селезенки, где подвергается разрушению.
Тельца Гейнца образуются в эритроцитах с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФД), поскольку имеющийся в них запас восстановительного потенциала не достаточен, чтобы воспрепятствовать окислительному действию отдельных химических веществ. В нормальных эритроцитах необратимое окисление гемоглобина предупреждается непрерывным образованием восстановленным НАДФ, который, в свою очередь, образуется из НАДФ под воздействием Г-6-ФД.
Образование телец Гейнца сопровождается повышением концентрации метгемоглобина в неполноценных эритроцитах. Это явление объясняется одинаковым механизмом — недостаточность восстановительных запасов при отсутствии действенной концентрации Г-6-ФД.
У новорожденных развитие желтухи за счет недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах объясняется низким уровнем гликемии — перинатальная характеристика —, равно как и «незрелостью ферментов » в эритроцитах на этом периоде жизни. Эти элементы значительно увеличивают риск расплавления крови у подобных детей, в частности при назначении матери, на дородовом периоде или во время вскармливания грудью, медикаментов окислительного действия.
Что касается механизма, при помощи которого инфекции (бактериальные или вирусные) обусловливают развитие гемолиза эритроцитов с недостатком глюкозо-6-фосфатдегидрогеназы (Г-6-ФД), то располагаемые нами данные еще более скудны. Видимо одним из воздействующих факторов следует считать значительное количество перекиси водорода, вырабатываемое пожирающими инфекционных агентов лейкоцитами. Не исключается и возможность, что, в условиях инфекции, отдельные вещества, нормально находящиеся в кровообращении, в том числе аскорбиновая кислота, становятся аггрессивным окислительным агентом для чувствительных эритроцитов.
И наконец, гемолиз обусловливаемый заглатыванием фасоли вида Vicia faba видимо развивается и под влиянием иммунологических факторов. Кроме того, из этой фасоли выделены некоторые вещества, способные сокращать в эритроцитах концентрацию восстановленного глютатиона, и тем самым уменьшать сократительную способность эритроцитов с недостатком Г-6-ФД.
– Также рекомендуем “Течение недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах – осложнения, лечение”
Оглавление темы “Анемии”:
- Клиника недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах
- Течение недостатка глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах – осложнения, лечение
- Недостаток пируваткиназы в эритроцитах – история изучения, причины, патофизиология
- Течение, осложнения и лечение недостатка пируваткиназы в эритроцитах
- Редкие энзимопатии цикла Эмбден-Мейергоффа эритроцитов – клиника, диагностика
- Метгемоглобинемии – история изучения, причины
- Клиника метгемоглобинемии – течение, осложнения
- Лабораторная диагностика метгемоглобинемии – анализы
- Механизмы развития метгемоглобинемии – патофизиология
- Лечение метгемоглобинемии – терапия
