Гемоглобин дыхательна функция крови

Одним из самых сложных процессов, что происходят в организме человека, несомненно, является дыхание. И сложность эта не только в танце легких, благодаря которому человек получает кислород, но и в процессах, с помощью которых этот кислород проникает дальше, в ткани, где превращается в углекислый газ, что отправляется в обратное путешествие. О данных процессах и пойдет речь далее.
Итак, приступим. Человек делает вдох, иии… Далеко не весь кислород поступает в легкие, а затем и в кровь. Часть вдыхаемого воздуха остается в так называемом мертвом пространстве. Мертвое пространство, в свою очередь, делится на анатомическое (дыхательные пути), в котором остается около 30 % вдыхаемого воздуха, и функциональное (вентилируемые, но по каким-то причинам не перфузируемые альвеолы).
Ухудшение альвеолярного газообмена может происходить при неглубоком и частом дыхании (причиной может стать перелом ребер, паралич дыхательной мускулатуры различного генеза и др.), а также при увеличении мертвого пространства, вызванном разнообразными причинами (нарушение перфузии альвеол в результате воспалительных заболеваний легких, удаление доли или целого легкого и др.), при снижении скорости кровотока по альвеолярным капиллярам (ТЭЛА, инфаркт легкого), при наличии диффузионного барьера (отек легких) и в результате ослабления альвеолярной вентиляции при обтурации просвета бронха. Газообмен между легкими и кровью происходит путем диффузии в соответствии с законом Фика. В легочных капиллярах она происходит за счет разности парциальных давлений в альвеолах и эритроцитах.
В альвеолах парциальное давление кислорода значительно превышает таковое для углекислого газа и составляет примерно 13,3 кПа (100 мм рт. ст.) и 5,3 кПа (40 мм рт. ст.) соответственно. Альвеолы омываются приносимой легочными артериями венозной кровью, в которой соотношение парциальных давлений этих двух газов обратно пропорционально и составляет приблизительно 5,3 кПа (40 мм рт. ст.) для кислорода и 6,1 кПа (46 мм рт. ст.) для углекислого газа. В среднем разница парциальных давлений составляет около 8 кПа (60 мм рт. ст.) для кислорода и около 0,8 кПа для углекислого газа.
Как уже было сказано выше, кислород путем диффузии проникает в кровь легочных капилляров. Диффузионное расстояние для кислорода при этом составляет 1–2 мкм, то есть именно на такое расстояние он проникает внутрь капилляра. Обмен крови в легочном капилляре происходит примерно за 0,75 секунды, но этого времени хватает на то, чтобы парциальные давления в альвеолах и в крови пришли в равновесие.
Кровь, в которой показатели парциального давления для кислорода и углекислого газа примерно равны таковым в альвеолах, называется артериализированной. Однако за счет наличия в легких артериовенозных шунтов и притока венозной крови из бронхиальных вен такой она остается недолго. В результате парциальное давление кислорода в аорте составляет примерно 12,0 кПа (как уже было сказано выше, парциальное давление в артериализированной крови равно таковому в альвеолах и составляет 13,3 кПа), а давление углекислого газа меняется незначительно и не приводит к затруднению его диффузии из крови в альвеолы.
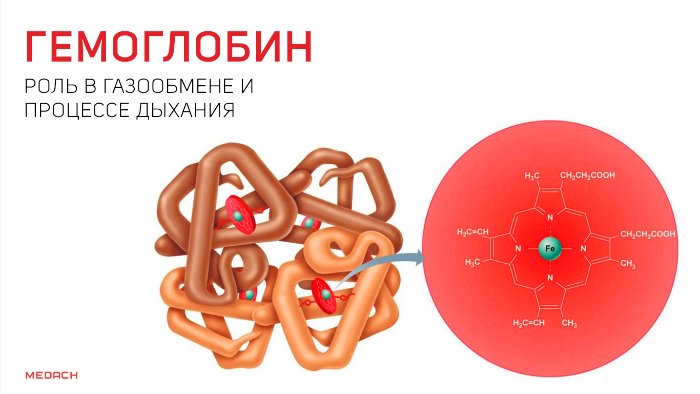
Но кислород непосредственно в ткани попадает лишь в крайне незначительных количествах: для свободного перемещения по организму ему необходим транспортер. Эту функцию выполняет содержащийся в эритроцитах белок — гемоглобин. Гемоглобин существует в оксигенированной и неоксигенированной формах. В дезокси-гемоглобине железо находится на уровне порфиринового кольца и стабилизируется электростатическими силами, что обеспечивает поддержание всей структуры. Появившись, кислород начинает «тянуть» за железо, которое переносится на проксимальный гистидин на другом конце полипептидной цепи и меняет структуру всего протеина.
В результате гемоглобин переходит в оксигенированную форму, альфа- и бета-цепи при этом поворачиваются относительно друг друга на 15 градусов, облегчая присоединение остальных молекул кислорода. В итоге каждый из четырех содержащихся в нем атомов двухвалентного железа обратимо связывается с молекулой кислорода, что превращает молекулу гемоглобина в оксигемоглобин. По сравнению с миоглобином гемоглобин имеет низкое сродство к кислороду, однако оно не статично. Так, миоглобин может связывать кислород только одним участком, поэтому кривая его связывания — гипербола. Кривая связывания гемоглобина с кислородом имеет S-образную форму, демонстрируя, что при его связывании с первой молекулой кислорода гемоглобин имеет очень низкое сродство к кислороду, но при связывании последующих молекул кислорода сродство остальных его субъединиц к нему значительно увеличивается и в конечном счете повышается примерно в 500 раз.
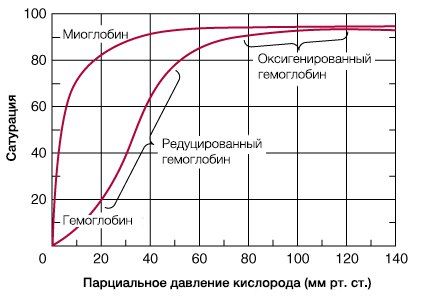
При этом альфа-цепи связывают кислород легче, чем бета-цепи. Этот процесс назван кооперативным взаимодействием. По мере снижения парциального давления кислорода в крови происходит его высвобождение из гемоглобина и поступление в ткани. Например, парциальное давление кислорода в работающих мышцах составляет всего 26 мм рт. ст, и при прохождении эритроцитов через капилляры, кровоснабжающие мышцы, происходит высвобождение и поступление в мышечные клетки примерно ⅓ всего переносимого гемоглобином кислорода. При повышении температуры тела также возрастает потребность в кислороде, что, в свою очередь, стимулирует высвобождение и поступление его в ткани. При снижении температуры, напротив, развивается гипоксия тканей, способствующая компенсаторному увеличению сродства гемоглобина к кислороду.
Гемоглобин также осуществляет перенос от тканей к легким продуктов тканевого дыхания — углекислого газа и ионов водорода. В ходе окислительных процессов в клетке выделяется углекислый газ, в результате гидратации которого образуются ионы водорода, что, в свою очередь, приводит к снижению рН. Давно известно, что снижение рН и повышение концентрации углекислого газа в крови оказывает сильное влияние на способность гемоглобина связывать кислород.
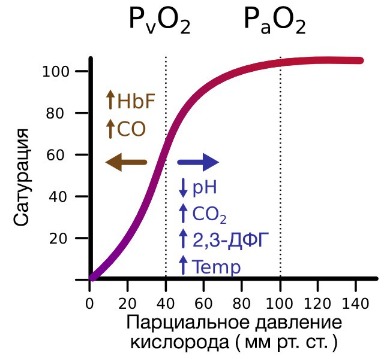
В периферических сосудах показатели рН низкие, и по мере связывания гемоглобина с ионами водорода и углекислым газом происходит снижение его сродства к кислороду. Это влияние величины рН и концентрации углекислого газа на способность гемоглобина связывать кислород называют эффектом Бора.
Обратная ситуация имеет место в альвеолярных капиллярах, где присоединение кислорода к гемоглобину превращает тот в более сильную кислоту.
При этом сродство гемоглобина к углекислому газу снижается, а повышение кислотности гемоглобина приводит к высвобождению излишка ионов водорода и образованию в крови из бикарбоната угольной кислоты, которая затем распадается на воду и углекислый газ. В обоих случаях углекислый газ из крови поступает в альвеолы, а затем в атмосферу. Данный процесс назван эффектом Холдейна. Стоит отметить, что важную роль в образовании углекислого газа в эритроцитах играет ион хлора, поступающий в плазму крови в обмен на бикарбонат при участии белка-переносчика АЕ1. Данный процесс в англоязычной литературе получил название «Chloride shift» или «перенос Хамбургера».
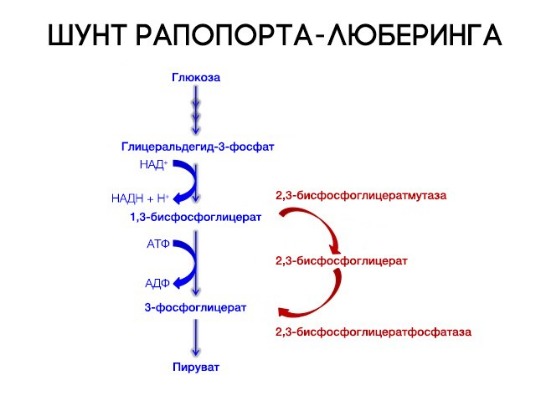
На сродство гемоглобина к кислороду оказывает влияние и присутствующее в эритроцитах вещество, получившее название 2,3-бисфосфоглицерат (БФГ). Его образование — своего рода побочная реакция анаэробного гликолиза, происходящего в эритроцитах в ходе ферментативного превращения глюкозы в пируват под действием фермента бифосфоглицератмутазы. БФГ способен самостоятельно связываться с неоксигенированной формой гемоглобина, образуя солевой мостик между двумя его бета-субъединицами и снижая сродство к кислороду.
При этом гемоглобин способен связать только одну молекулу БФГ, а при присоединении кислорода БФГ вытесняется из полости. В обычных условиях в эритроцитах крови содержится достаточно большое количество БФГ, которое может увеличиваться в условиях гипоксии (например, у дайверов при погружении на глубину), а также при восхождении на большую высоту. В первые часы подъема концентрация БФГ в эритроцитах будет возрастать, а сродство кислороду снижаться. Но на большой высоте парциальное давление будет значительно ниже такового на уровне моря, а значит, оно снизится и в тканях. При этом БФГ будет облегчать передачу кислорода от гемоглобина к тканям.
Некоторые вещества способны прочно связываться с гемоглобином или же вовсе менять его структуру. Одним из них является угарный газ, чье сродство к гемоглобину в 200 раз превышает таковое для кислорода. Отравления угарным газом часто происходят в помещениях с печным отоплением, при пожарах и авариях на производстве. Со временем кислород вытесняет угарный газ из гемоглобина, и в легких случаях пациенты помещаются под наблюдение и получают ингаляции с увлажненным кислородом. Необходимой мерой при тяжелых отравлениях угарным газом является переливание эритроцитарной массы.
К веществам, способным изменять структуру гемоглобина, относятся метгемоглобинобразователи — соединения, способные окислять двухвалентное железо в геме до трехвалентного. К ним относятся нитриты, нитраты, некоторые местные анестетики, аминофенолы, хлораты, примахин и некоторые сульфаниламиды. Состояние, характеризующееся появлением в крови окисленного гемоглобина, называют метгемоглобинемией. При высокой метгемоглобинемии капля крови, помещенная на фильтровальную бумагу, имеет характерный коричневый цвет, а при пропускании кислорода через пробирку с такой кровью ее цвет не меняется. Метгемоглобинемия выше 70 % от общего содержания гемоглобина часто приводит к гибели пациента еще до момента постановки диагноза.
Источники:
- Harrison’s hematology and oncology Longo, Dan L (Dan Louis), Third edition. New York : McGraw-Hill Education Medical, 2017.
- Наглядная физиология, С. Зильбернагль, А. Деспопулос, 2013.
- Ленинджер А. Основы биохимии: В 3-х т. Т. 1. /Д. Нельсон, М. Кокс ; Пер. с англ.-М.: БИНОМ: Лаборатория знаний, 2011.- 694 с.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Дыхательная функция крови
| Таблица 49. Состав вдыхаемого, альвеолярного и выдыхаемого воздуха (по Уайту и др., 1981) | ||||||
| Газ | Вдыхаемый воздух | Альвеолярный воздух | Выдыхаемый воздух | |||
| Р (гПа) | об.% | Р (гПа) | об.% | Р (гПа) | об.% | |
| О2 | 210,9 | 20,95 | 134,9 | 14,0 | 154,9 | 16,1 |
| CO2 | 4,0 | 0,04 | 53,3 | 5,6 | 38,0 | 4,5 |
| N2 | 795,3 | 79,0 | 762,4 | 80,0 | 757,7 | 79,2 |
| H2O | 6,67 | – | 62,7 | – | 62,7 | – |
| 1013,3 | 99,99 | 1013,3 | 99,6 | 1013,3 | 99,8 | |
Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислоты от тканей к легким (табл. 49).
Перенос кислорода кровью
Кровь осуществляет свою дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как
переносчика кислорода основана на способности обратимо связывать кислород в зависимости от его напряжения в крови. Поэтому в легочных капиллярах
происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода
тканям.
В состоянии покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При тяжелой физической работе количество потребляемого
тканями кислорода возрастает в 10 и более раз (до 2-3 л O2 в 1 мин). Доставка от легких к тканям такого количества кислорода в виде
газа, физически растворенного в плазме, невозможна вследствие малой растворимости кислорода в воде и плазме крови (табл. 50).
| Таблица 50. Коэффициенты абсорбции (растворимости) вдыхаемых газов (в мл/мл среды при давлении 1013,3 гПа – 760 мм рт. ст.) | ||||
| Среда | 1°С | Газ | ||
| 02 | СО2 | N2 | ||
| Вода | 0,049 | 1,71 | 0,024 | |
| 20 | 0,031 | 0,87 | 0,016 | |
| 40 | 0,023 | 0,53 | 0,012 | |
| Плазма | 38 | 0,024 | 0,51 | 0,012 |
Исходя из приведенных в табл. 50 данных, а также зная парциальное давление кислорода в артериальной крови 107-120 гПа (80-90 мм рт. ст.),
нетрудно видеть, что количество физически раствoренного кислорода в плазме крови не может превышать 0,3 об%. При расчете кислородной емкости
крови этой величиной можно пренебречь.
Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула гемоглобина построена из четырех субъединиц
(полипептидных цепей), каждая из которых связанна с гемом -(см. с. 80). Следовательно, молекула гемоглобина имеет четыре гема, к которым может
присоединяться кислород. При этом гемоглобин переходит в оксигемоглобин.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщении кислoродом связывает
1 грамм-молекулу O2 (22 400 мл). Таким образом, 100 г гемоглобина может связать
0,335 x 22 400/ 55,84 = 134 мл 02,
а каждый грамм гемоглобина – 1,34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13-16%, т. е. в 100 мл крови
находится 13-16 г гемоглобина. При РО2 в артериальной крови 107-120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих
условиях 100 мл крови содержит 19-20 об%, кислорода:
15 х 1,34 х 96/ 100 = 19,3 мл О2 (в среднем 19-20 об. %).
В венозной крови при покое РO2 = 53,3 гПа, и в этих условиях гемоглобин насыщен кислородом лишь на 70-72%, т. е. содержание
кислорода в 100 мл венозной крови не превышает
15 x 1,34 x 70 / 100 = 14,1 O2 (~ 14 об.%)
Артериовенозная разница по кислороду будет равна ~6 об.%. (Артериовенозная разница по кислороду в разных органах далеко не одинакова и зависит
от уровня метаболизма органа. В миокарде А-В-разница составляет 12 об.%, в мозге – 6, в желудочно-кишечном тракте – 3, в почках – 1,5 об.%.)
Таким образом, за 1 мин ткани в состоянии покоя получают 200-240 мл 02 (при условии, что минутный объем крови, протекающей через
сердце, в покое составляет 4 л).
Возрастание интенсивности окислительных процессов в тканях, например при усиленной мышечной работе, всегда связано с более полным
извлечением кислорода из крови. Кроме того, при физической работе резко увеличивается скорость кровотока. Зависимость между степенью насыщения
гемоглобина кислородом и РO2 можно выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации оксигемоглобина,
которая имеет S-образную форму и характеризует сродство гемоглобина к кислороду (рис. 129).
Характерная для гемоглобина S-образная кривая насыщения кислородом свидетельствует о том, что связывание первой молекулы кислорода одним
из гемов гемоглобина облегчает связывание последующих молекул кислорода тремя другими оставшимися темами. Долгое время механизм, лежащий в основе
этого эффекта, оставался загадкой, ибо, по данным рентгеноструктурного анализа, четыре гема в молекуле гемоглобина довольно далеко отстоят друг
от друга и вряд ли могут оказывать взаимное влияние. В последнее время принято следующее объяснение происхождения S-образной кривой. Считают,
что молекула гемоглобина способна обратимо распадаться на две половинки, каждая из которых содержит одну α-цепь и одну β-цепь:
При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина происходит присоединение кислорода (обозначим звездочкой) к одной
из половинок молекулы гемоглобина (допустим, к α-цепи этой половинки). Как только такое присоединение произойдет, α-полипептидная
цепь претерпевает конформационные изменения (условно обозначим эту форму О):
После этого конформационные изменения α-цепи механически передаются на тесно связанную с ней β-цепь, которая также подвергается
конформационным сдвигам:
β-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одной молекулы кислорода благоприятствует
связыванию второй молекулы:
После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулы гемоглобина,
которое вынуждает и вторую половинку гемоглобина изменить конформацию:
Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой1 молекулы гемоглобина, образуя оксигемоглобин:
S-образная форма кривой насыщения гемоглобина кислородом имеет большое физиологическое значение. При такой форме кривой обеспечивается
возможность насыщения крови кислородом при изменении РO2 в довольно широких предела. Например, дыхательная функция крови
существенно не нарушается при снижении РO2 во вдыхаемом воздухе с 133,3 до 8-93,3 гПа.
Численно сродство гемоглобина к кислороду принято выражать через величину P50-парциальное напряжение О2, при
котором 50% гемоглобина связано с кислородом (pH 7,4, температура 37°С). Нормальная величина Р50 около 34,67 гПа. Смещение
кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно,
сопровождается повышением Р50. Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду,
величина Р50 снижена.
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду
в первую очередь связано о pH. Чем ниже pH, тем меньше способность гемоглобина связывать кислород и тем больше Р50. В тканевых
капиллярах pH ниже (поступает большое количество СO2), в связи с чем гемоглобин легко отдает кислород. В легких
СO2 выделяется, pH повышается и гемоглобин жадно присоединяет кислород.
Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких),
тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления.
Количество гемоглобина в крови, а также в какой-то мере способность связывать кислород (характер кривой диссоциации оксигемоглобина)
несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20-21% (вместо обычных для взрослого 13-16%).
У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и отличаются по своему
сродству к кислороду.
Рассмотрим нарушения дыхательной функции крови при некоторых патологических состояниях.
Различные формы гипоксии
Гипоксия (кислородное голодание) – состояние, возникающее при недостаточном снабжении тканей организма кислородом ли нарушении его
утилизации в процессе биологического окисления. Согласно классификации, предложенной И. Р. Петровым (1949), гипоксии делятся на две
группы:
- Гипоксия вследствие понижения РO2 во вдыхаемом воздухе (экзогенная гипоксия)
[показать]. - Гипоксия при патологических процессах, нарушающих снабжение тканей кислородом при нормальном содержании его в окружающей среде,
или утилизацию кислорода тканями. Сюда относятся следующие типы:- дыхательный (легочный)
[показать]. - сердечно-сосудистый (циркуляторный)
[показать]. - кровяной (гемический)
[показать]. - тканевый (гистотоксический)
[показать]. - смешанный.
- дыхательный (легочный)
Перенос углекислоты кровью от тканей к легким
В организме человека, не выполняющего физической работы (состояние покоя), от тканей к легким каждую минуту переносится примерно
180 мл СO2.
Это легко рассчитать. Если дыхательный коэффициент равен 0,85, то при поглощении тканями человека в покое 200 мл
O2 в минуту должно образовываться (200-0,85) около 170 мл СO2. На самом деле эта величина несколько больше, поскольку
количество поглощаемого в покое кислорода колеблется от 200 до 240 мл в 1 мин. В целом за сутки с вдыхаемым воздухом в организм человека
поступает примерно 600 л кислорода и выделяется в окружающую среду 480 л углекислого газа (примерно 942,8 г), что соответствует – 21,4 моль
СO2.
Организм располагает несколькими механизмами переноса СO2 от тканей к легким. Часть СO2 переносится в физически
растворенном виде. Хотя растворимость СO2 в плазме крови в 40 раз превышает растворимость в ней кислорода, тем не менее при небольшой
артериовенозной разнице в РCO2 (напряжение СO2 в венозной крови, притекающей к легким по легочной артерии, равно 60 гПа, а
в артериальной крови – около 53,3 гПа) в физически растворенном виде может быть перенесено в покое 12-15 мл СO2, что составляет 6-7%
от всего количества переносимой углекислоты.
Некоторое количество СO2 может переноситься в виде карбаминовой формы. Оказалось, что СO2 может присоединяться к
гемоглобину посредством карбаминовой связи, образуя карбгемоглобин, или карбаминогемоглобин (впервые мысль о наличии углекислоты, непосредственно
связанной с гемоглобином, была высказана И. М. Сеченовым):
Карбгемоглобин – соединение очень нестойкое и чрезвычайно быстро диссоциирует в легочных капиллярах с отщеплением СO2. Количество
карбаминовой формы невелико: в артериальной крови оно составляет 3 об.% (1,0 ммоль/л), в венозной – 3,8 об.% (1,5-2,0 ммоль/л). В виде
карбаминовой формы из тканей к легким переносится от 3 до 10% всей углекислоты, поступающей из тканей в кровь. Основная масса СO2
транспортируется с кровью к легким в форме бикарбоната, при этом важнейшую роль играет гемоглобин эритроцитов.
Как уже отмечалось, кислотный характер оксигемоглобина выражен значительно сильнее, чем гемоглобина (константа диссоциации ННbO2
примерно в 20 раз больше константы диссоциации ННb. Важно также запомнить, что поступающий в ткани с кровью оксигемоглобин, являющийся более
сильной кислотой, чем Н2СO3, связан с катионами калия. Эту калийную соль оксигемоглобина можно обозначить как
КНbO2 (рис. 130). В периферических капиллярах большого круга кровообращения гемоглобин эритроцитов отдает кислород тканям
(КНbO2 -> O2 + КНb), его способность связывать ионы водорода увеличивается. Одновременно в эритроцит поступает продукт
тканевого обмена – углекислый газ. Под влиянием фермента карбоангидразы, который может существовать в нескольких молекулярных формах
(изоферменты А, В и С), разделяемых при помощи электрофореза, углекислый газ взаимодействует с водой, при этом образуется угольная кислота
(Н2СO3). Возникающий за счет угольной кислоты избыток водородных ионов связывается с гемоглобином, отдавшим кислород,
а накапливающиеся анионы НСO3 выходят из эритроцита в плазму. Артериальная кровь содержит 25,5 ммоль/л НСO3-
в плазме и 12,7 ммоль/л в эритроцитах; венозная кровь – соответственно 26,4 и 13,9 ммоль/л.
КНb + Н2СO3 –> K+НСO3- + ННb
В обмен на эти ионы в эритроцит поступают анионы хлора, для которых мембрана эритроцита проницаема, в то время как натрий – другой составной
элемент натрия хлорида, содержащегося в крови, остается в плазме. В итоге в плазме крови повышается содержание бикарбоната натрия
(NaНСO3). Этот процесс способствует восстановлению щелочного резерва крови, т. е. бикарбонатная буферная система находится в
довольно тесных функциональных связях с буферной системой эритроцитов.
В легочных капиллярах, опять таки в эритроцитах, происходит процесс вытеснения угольной кислоты из бикарбоната калия оксигемоглобином:
ННbO2 + K+НСO3- –> КНbO2 + Н2СO3.
Образующаяся Н2СO3 быстро расщепляется при участии карбоангидразы на углекислый газ и воду. Низкое РO2 в
просвете альвеол способствует диффузии углекислого газа из эритроцитов в легкие.
По мере снижения в эритроцитах концентрации бикарбоната из плазмы крови в них поступают новые порции ионов НСO3-, а
в плазму выходит эквивалентное количество ионов хлора. Концентрация бикарбоната натрия в плазме крови в легочных капиллярах быстро падает,
но одновременно в плазме повышается концентрация натрия хлорида, а в эритроцитах свободный гемоглобин превращается в калийную соль
оксигемоглобина.
Итак, в форме бикарбоната при участии гемоглобина эритроцитов транспортируется с кровью к легким более 80% всего количества углекислоты.
Продолжение: Свертывающие и противосвертывающие системы крови
Виртуальные консультации
На нашем форуме вы можете задать вопросы о проблемах своего здоровья, получить
поддержку и бесплатную профессиональную рекомендацию специалиста, найти новых знакомых и
поговорить на волнующие вас темы. Это позволит вам сделать собственный выбор на основании
полученных фактов.
Обратите внимание! Диагностика и лечение виртуально не проводятся!
Обсуждаются только возможные пути сохранения вашего здоровья.
Подробнее см. Правила форума
Последние сообщения
Реальные консультации
Реальный консультативный прием ограничен.
Ранее обращавшиеся пациенты могут найти меня по известным им реквизитам.
Заметки на полях
Нажми на картинку –
узнай подробности!
Новости сайта
Ссылки на внешние страницы
20.05.12
Уважаемые пользователи!
Просьба сообщать о неработающих ссылках на внешние страницы, включая ссылки, не выводящие прямо на нужный материал,
запрашивающие оплату, требующие личные данные и т.д. Для оперативности вы можете сделать это через форму отзыва, размещенную на каждой странице.
Ссылки будут заменены на рабочие или удалены.
Тема от 05.09.08 актуальна!
Остался неоцифрованным 3-й том МКБ. Желающие оказать помощь могут заявить об этом на
нашем форуме
05.09.08
В настоящее время на сайте готовится полная
HTML-версия МКБ-10 – Международной классификации болезней, 10-я редакция.
Желающие принять участие могут заявить об этом на нашем форуме
25.04.08
Уведомления об изменениях на сайте можно получить через
раздел форума “Компас здоровья” – Библиотека сайта “Островок здоровья”
