Гемоглобин это фибриллярный белок

Существует четыре наиболее важных класса органических соединений, которые входят в состав организма: нуклеиновые кислоты, жиры, углеводы и белки. О последних и пойдет речь в этой статье.
Что такое белок?
Это полимерные химические соединения, построенные из аминокислот. Белки имеют сложную структуру.
Как синтезируется белок?
Это происходит в клетках организма. Существуют специальные органоиды, которые отвечают за этот процесс. Это рибосомы. Они состоят из двух частей: малой и большой, которые объединяются во время работы органеллы. Процесс синтезирования полипептидной цепочки из аминокислот называется трансляцией.
Какие бывают аминокислоты?
Несмотря на то что разновидностей белков в организме несметное количество, аминокислот, из которых они могут быть сформированы, существует всего двадцать. Такое разнообразие белков достигается за счет различных комбинаций и последовательности этих аминокислот, а также разного размещения построенной цепочки в пространстве.
Аминокислоты содержат в своем химическом составе две противоположные по своим свойствам функциональные группы: карбоксильную и аминогруппу, а также радикал: ароматический, алифатический или гетероциклический. Кроме того, в состав радикалов могут входить дополнительные функциональные группы. Это могут быть карбоксильные группы, аминогруппы, амидные, гидроксильные, гуанидовые группы. Также радикал может содержать в своем составе серу.
Вот список кислот, из которых могут быть построены белки:
- аланин;
- глицин;
- лейцин;
- валин;
- изолейцин;
- треонин;
- серин;
- глутаминовая кислота;
- аспарагиновая кислота;
- глутамин;
- аспарагин;
- аргинин;
- лизин;
- метионин;
- цистеин;
- тирозин;
- фенилаланин;
- гистидин;
- триптофан;
- пролин.
Из них десять являются незаменимыми — такими, которые не могут быть синтезированы в организме человека. Это валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, гистидин, аргинин. Они обязательно должны поступать в организм человека с пищей. Много таких аминокислот содержится в рыбе, говядине, мясе, орехах, бобовых.
Первичная структура белка — что это такое?
Это последовательность аминокислот в цепочке. Зная первичную структуру белка, можно составить точную его химическую формулу.

Вторичная структура
Это способ скручивания полипептидной цепочки. Существует два варианта конфигурации белка: альфа-спираль и бета-структура. Вторичная структура белка обеспечивается водородными связями между СО- и NH- группами.
Третичная структура белка
Это пространственная ориентация спирали или способ ее укладки в определенном объеме. Ее обеспечивают дисульфидные и пептидные химические связи.
В зависимости от типа третичной структуры существуют фибриллярные и глобулярные белки. Последние имеют шаровидную форму. Структура фибриллярных белков напоминает нить, которая формируется путем многослойной укладки бета-структур или параллельного расположения нескольких альфа-структур.
Четвертичная структура
Она свойственна для белков, которые имеют в своем составе не одну, а несколько полипептидных цепочек. Такие белки называются олигомерными. Отдельные цепочки, входящие в их состав, называют протомерами. Протомеры, из которых построен олигомерный белок, могут обладать как одинаковой, так и разной первичной, вторичной или третичной структурой.
Что такое денатурация?
Это разрушение четвертичной, третичной, вторичной структур белка, вследствие чего он теряет свои химические, физические свойства и больше не может выполнять свою роль в организме. Этот процесс может происходить в результате действия на белок высоких температур (от 38 градусов Цельсия, но для каждого белка эта цифра индивидуальна) или агрессивных веществ, таких как кислоты и щелочи.
Некоторые белки способны к ренатурации — возобновлению своей первоначальной структуры.
Классификация белков
Учитывая химический состав, их разделяют на простые и сложные.
Простые белки (протеины) — это те, в состав которых входят только аминокислоты.
Сложные белки (протеиды) — те, которые имеют в своем составе простетическую группу.
В зависимости от вида простетической группы белки можно разделить на:
- липопротеиды (содержат липиды);
- нуклеопротеиды (в составе есть нуклеиновые кислоты);
- хромопротеиды (содержат пигменты);
- фосфопротеиды (имеют в составе фосфорную кислоту);
- металлопротеиды (содержат металлы);
- гликопротеиды (в составе есть углеводы).
Кроме того, в зависимости от типа третичной структуры существует глобулярный и фибриллярный белок. Оба могут быть как простыми, так и сложными.
Свойства фибриллярных белков и их роль в организме
Их можно разделить на три группы в зависимости от вторичной структуры:
- Альфа-структурные. К ним относится кератины, миозин, тропомиозин и другие.
- Бета-структурные. Например, фиброин.
- Коллаген. Это белок, который обладает особой вторичной структурой, которая не является ни альфа-спиралью, ни бета-структурой.
Особенности фибриллярных белков всех трех групп заключаются в том, что они обладают нитевидной третичной структурой, а также не растворимы в воде.
Поговорим об основных фибриллярных белках подробнее по порядку:
- Кератины. Это целая группа разнообразных белков, которые являются главной составляющей волос, ногтей, перьев, шерсти, рогов, копыт и т. д. Кроме того, фибриллярный белок этой группы цитокератин входит в состав клеток, формируя цитоскелет.
- Миозин. Это вещество, которое входит в состав мышечных волокон. Наряду с актином, этот фибриллярный белок является сократительным и обеспечивает функционирование мышцы.
- Тропомиозин. Это вещество состоит из двух переплетенных альфа-спиралей. Он также входит в состав мышц.
- Фиброин. Этот белок выделяется многими насекомыми и паукообразными. Он является основной составляющей паутины и шелка.
- Коллаген. Это наиболее распространенный фибриллярный белок в организме человека. Он входит в состав сухожилий, хрящей, мышц, сосудов, кожи и т. д. Это вещество обеспечивает эластичность тканей. Выработка коллагена в организме с возрастом снижается, в связи с чем возникают морщины на коже, ослабевают сухожилия и связки и т. д.
Далее рассмотрим вторую группу белков.
Глобулярные белки: разновидности, свойства и биологическая роль
Вещества данной группы имеют форму шара. Они могут быть растворимыми в воде, растворах щелочей, солей и кислот.
Наиболее распространенными глобулярными белками в организме являются:
- Альбумины: овальбумин, лактальбумин и др.
- Глобулины: белки крови (напр., гемоглобин, миоглобин) и др.
Подробнее о некоторых из них:
- Овальбумин. Из этого белка на 60 процентов состоит яичный белок.
- Лактальбумин. Основная составляющая молока.
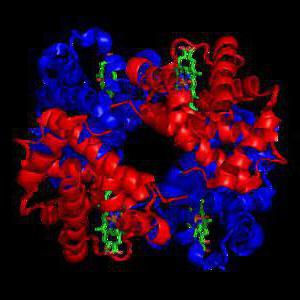
- Гемоглобин. Это сложный глобулярный белок, в составе которого в качестве простетической группы присутствует гем — это пигментная группа, содержащая железо. Гемоглобин содержится в эритроцитах. Это белок, который способен связываться с кислородом и транспортировать его.
- Миоглобин. Это белок, похожий на гемоглобин. Он выполняет ту же функцию — перенос кислорода. Такой белок содержится в мышцах (поперечнополосатых и сердечной).
Теперь вы знаете основные различия между простыми и сложными, фибриллярными и глобулярными белками.
Человеческий организм вмещает больше пятидесяти тысяч белков, которые разнятся между собой по структуре, строению и функциям. Они состоят из разных аминокислот, каждая из них занимает свое положение в цепи полипептидов. На сегодняшний день не существует единой классификации, которая учитывает разные параметры белков. Одни из них отличаются по форме молекул, здесь выделяют глобулярные и фибриллярные белки, о них и пойдет сегодня речь.
Белки глобулярные
Сюда относятся белки такие, в чьих молекулах наблюдаются цепи полипептидов, что имеют шароподобную форму. Такое строение белка связано с гидрофильными (имеют соединения водорода с водой) и гидрофобными (отталкивают воду) взаимодействиями. К данному виду относятся экзимы, гормоны, которые имеют белковую природу, иммуноглобулины, протеиды, альбумины, а также белки, которые выполняют регуляторную и транспортную функции. Это большая часть белков человека.
Экзимы
Экзимы (ферменты) находятся во всех клетках, с их помощью одни вещества превращаются в иные, так как они резко изменяют скорость превращений, способствуя распаду, расщеплению и синтезу веществ из продуктов распада. Во всех протекающих в организме реакциях они играют роль катализатора, регулируют обмен веществ. Известно более пяти тысяч разных ферментов. Все они выполняют до нескольких миллионов действий в секунду. Но они способствуют ускорению определенных реакций, оказывая действие только на определенные вещества. Ферменты удаляют погибшие клетки, шлаки и яды. Они являются катализаторами всех процессов в организме, а если их недостаточно, то у человека увеличивается вес за счет накопления отходов в теле.
Иммуноглобулины
Антитела (иммуноглобулины) представляют собой соединения белков, что появляются вследствие ответной реакции на поступление в организм бактерий и вирусов, а также токсинов. Они не дают им размножаться и нейтрализуют отравляющие вещества. Иммуноглобулины распознают и связывают чужеродные вещества, их уничтожают, образуя иммунные комплексы, а потом удаляют эти комплексы. Также они защищают организм от повторного инфицирования, так как антитела против болезней, которые были перенесены, длительный период сохраняются. Иногда в организме вырабатываются аномальные антитела, что нападают на собственный организм. Происходит это чаще всего из-за наличия аутоиммунных болезней. Таким образом, глобулярные и фибриллярные белки выполняют незаменимые функции в организме человека, поддерживая его нормальную жизнедеятельность.
Гормоны белковой природы
Сюда относятся гормоны поджелудочной, паращитовидной желез и гипофиза (инсулин, глюкагон, СТГ, ТТГ и другие). Одни регулируют углеводный обмен, увеличивая и понижая уровень сахара в крови, другие стимулируют рост клеток и деятельность щитовидной железы, третьи проводят регуляцию половых желез. Таким образом, все они регулируют физиологические функции. Эта их работа сводится либо к ингибированию, либо к активации систем ферментов.
Белки фибриллярные
Фибриллярные белки те, что имеют структуру в виде нити. Они не растворяются в воде и имеют массу молекулы очень большую, структура которой высокорегуляторная, она приходит в устойчивое состояние благодаря взаимодействиям между разными цепями полипептидов. Эти цепи находятся синхронно друг для друга на одной плоскости и создают так называемые фибриллы. К фибриллярным белкам относятся: кератины (волосы и иные роговые покровы), эластин (сосуды и легкие), коллаген (сухожилия и хрящи). Эти все белки выполняют в организме структурную функцию. Также сюда входит миозин (мышечное сокращение) и фибрин (свертывание крови). Этот вид белков выполняет опорные функции, которые придают прочности тканям. Таким образом, все типы фибриллярных белковвыполняют незаменимую роль в анатомии и физиологии. Из них образуются защитные покровы человека, также они принимают участие в создании опорных элементов, поскольку входят в состав соединительной ткани, хрящей, сухожилий, костей и глубоких кожных слоев. В воде они не растворяются.
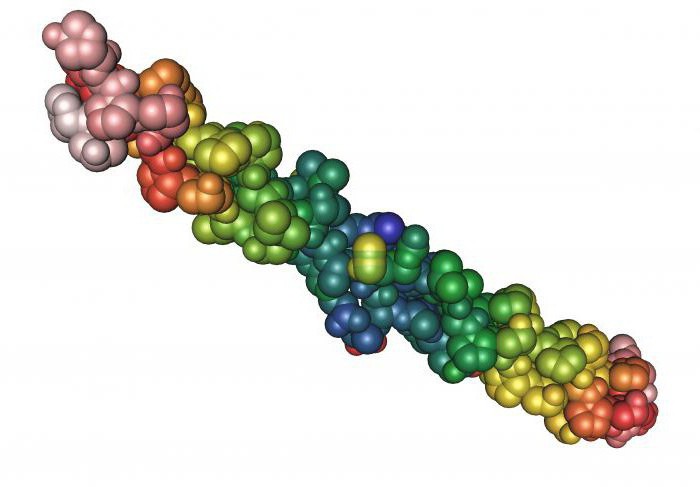
Кератины
К фибриллярным белкам относятся кератины (альфа и бета). Альфа-кератины представляют собой основную группу фибриллярных белков, из них формируются покровы, которые выполняют защитную функцию. Они представлены в сухом весе волос, ногтей, перьев, шерсти, панцирей и так далее. Разные белки имеют сходство в составе аминокислот, они содержат цистеин и имеют цепи полипептидов, которые располагаются одинаково. Бета-кератины содержат аланин и глицин, они входят в состав паутины и шелка. Таким образом, кератины бывают «твердыми» и «мягкими».
В ходе возникновения различий между эпителиальными клетками, в процессе развития особи, они ороговевают, в них приостанавливается обмен веществ, наступает угасание клетки и она ороговевает. Клетки кожи вмещают кератин, он совместно с коллагеном и эластином образует влагонепроницаемый слой эпидермиса, кожа становится упругой и прочной. При натирании и давлении клетки вырабатывают кератин в огромных количествах с защитной целью. Вследствие этого появляются мозоли или наросты. Ороговевшие клетки кожи начинают беспрерывно отшелушиваться и заменяются новыми. Таким образом, бета-кератины играет большую роль для животного мира, так как представляют собой основной компонент рогов и клювов. Альфа-кератины характерны для организма человека, они являются составной частью волос, кожи и ногтей, а также входят в костный скелет, определяя его крепость.
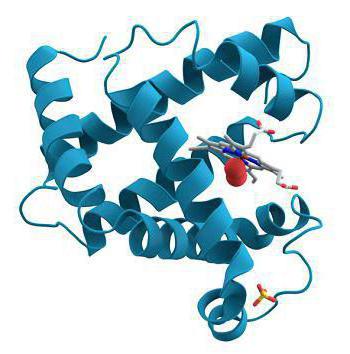
Коллаген
Фибриллярные белки, в частности коллаген с эластином, являются компонентами соединительной ткани, они составляют основную долю хрящей, стенок сосудов, сухожилий и прочего. Коллаген представлен у позвоночных третьей частью всей массы белков. Его молекулы производят полимеры, которые называются коллагеновыми фибриллами. Они очень прочны, выдерживают огромную нагрузку и не растягиваются. Коллаген состоит из глицина, пролина и аланина, в нем нет цистеина и триптофана, а тирозин и метионин присутствуют здесь в малом количестве.
Также большую роль в образовании фибрилл играют гидроксипролин и гидроксилизин. Изменения в строении коллагена приводят к развитию наследственных заболеваний. Коллагены очень прочны, они не растягиваются. Для каждой ткани присущи свои типы коллагенов. Этот белок выполняет множество функций:
- защитную, характеризующуюся обеспечением прочности тканей и их защитой от травм;
- опорную, обусловленную скреплением органов и формированием их форм;
- восстановительную, характеризующуюся регенерацией на клеточном уровне.
Также коллагены придают тканям эластичности, предотвращают развитие меланом кожи, участвуют в образовании оболочек клеток.
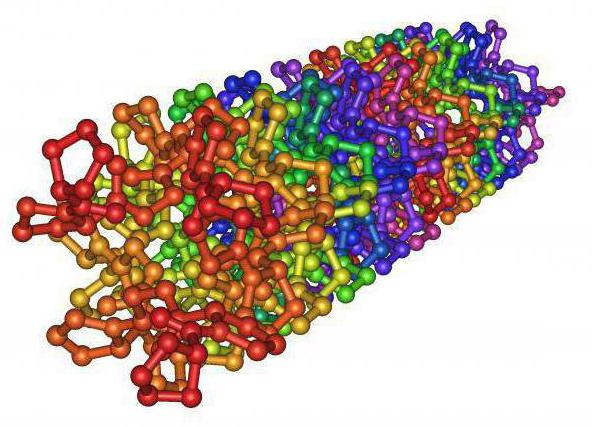
Эластин
Выше мы рассмотрели, какие белки относятся к фибриллярным. Еще сюда включают эластин, что имеет резиноподобные свойства. Его нити, которые находятся в легочной ткани, сосудистых стенках и связках, могут растягиваться во много раз больше своей обычной длины. После того, как нагрузка прекращает свое воздействие, они возвращаются в первичное положение. В составе эластина больше всего содержится пролина и лизина, гидроксилизина здесь нет. Таким образом, функции фибриллярных белков очевидны. Они играют большую роль в развития организма. Эластин обеспечивает растяжение и сжатие органов, артерий, сухожилий, кожи и прочего. Он помогает органам восстанавливать первоначальные размеры после растяжения. Если в организме человека недостает эластина, то у него образуются кардиоваскулярные изменения в виде аневризм, дефектов клапанов сердца и так далее.
Сравнение глобулярных и фибриллярных белков
Эти две группы белков разнятся между собой по форме молекул. Глобулярные белки имеют цепи полипептидов, что скручены очень плотно в овальные структуры. Фибриллярные белки имеют цепи полипептидов, которые находятся параллельно друг другу и образуют слой. По механическим свойствам ГБ не сжимаются и не распрямляются, а ФБ, наоборот, имеют такую способность. ГБ не растворяются в воде, а ФБ растворяются. Также эти белки разнятся по своим функциям. Первые выполняют функцию динамическую, а вторые – структурную. Глобулярные белки могут быть представлены в виде ферментов и антител, а также гемоглобина, инсулина и прочего. Примеры фибриллярных белков: коллаген, кератин, фиброин и прочие. Все эти виды белков незаменимы, недостаточное их количество в организме приводит к серьезным нарушениям и патологиям.
Таким образом, глобулярные и фибриллярные белки выполняют незаменимую роль в нормальной жизнедеятельности организма позвоночных. Они обеспечивают деятельность органов, тканей, кожи и прочего, выполняют множество функций, необходимых для полноценного развития организма.
§ 10. КЛАССИФИКАЦИЯ БЕЛКОВ
Существуют несколько подходов к классификации белков: по форме белковой молекулы, по составу белка, по функциям. Рассмотрим их.
Классификация по форме белковых молекул
По форме белковых молекул различают фибриллярные белки и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками (рис. 18,б). Эти белки отличаются высокой механической прочностью, нерастворимы в воде. Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
В глобулярных белках одна или несколько полипептидных цепей свернуты в плотную компактную структуру – клубок (рис. 18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
Рис. 18. Форма белковых молекул:
а – глобулярный белок, б – фибриллярный белок
Классификация по составу белковой молекулы
Белки по составу можно разделить на две группы: простые и сложные белки. Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Сложные белки, помимо полипептидных цепей, содержат другие химические компоненты.
К простым белкам относятся РНКаза и многие другие ферменты. Фибриллярные белки коллаген, кератин, эластин по своему составу являются простыми. Запасные белки растений, содержащиеся в семенах злаков, – глютелины, и гистоны – белки, формирующие структуру хроматина, принадлежат также к простым белкам.
Среди сложных белков различают металлопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины и др. Рассмотрим эти группы белков подробнее.
Металлопротеины
К металлопротеинам относят белки, в составе которых имеются ионы металлов. В их молекулах встречаются такие металлы, как медь, железо, цинк, молибден, марганец и др. Некоторые ферменты по своей природе являются металлопротеинами.
Хромопротеины
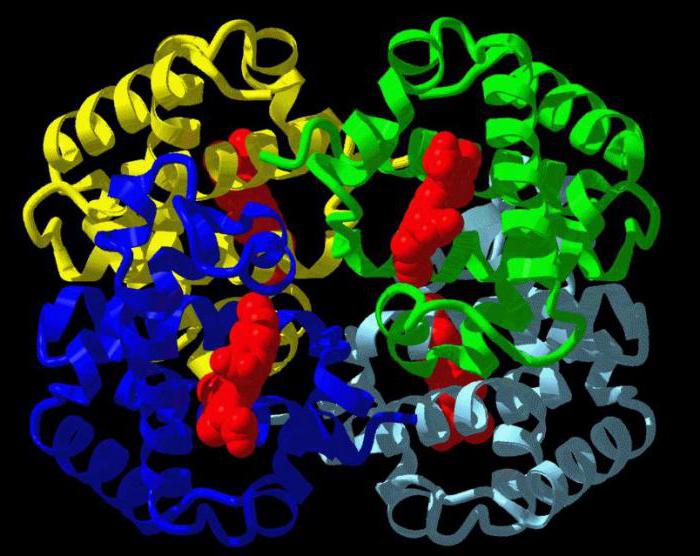
В составе хромопротеинов в качестве простетической группы присутствуют окрашенные соединения. Типичными хромопротеинами являются зрительный белок родопсин, принимающий участие в процессе восприятие света, и белок крови гемоглобин (Hb), четвертичная структура которого рассмотрена в предыдущем параграфе. В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
.
Гемоглобин может образовывать соединение с оксидом углерода (II), которое называется карбоксигемоглобином:
.
Карбоксигемоглобин не способен присоединять кислород. Вот почему происходит отравление угарным газом.
Гемоглобин и другие гем-содержащие белки (миоглобин, цитохромы) называют еще гемопротеинами из-за наличия в их составе гема (рис. 19).
Рис. 19. Гем
Фосфопротеины
Фосфопротеины в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью (рис. 20).
Рис. 20. Фосфопротеин
К фосфопротеинам относится белок молока казеин. В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
фосфопротеин + Н2 протеин + Н3РО4
Дефосфорилированные белки могут при определенных условиях быть снова фосфорилированы. От наличия фосфатной группы в их молекуле зависит их биологическая активность. Одни белки проявляют свою биологическую функцию в фосфорилированном виде, другие – в дефосфорилированном. Посредством фосфорилирования – дефосфорилирования регулируются многие биологические процессы.
Липопротеины
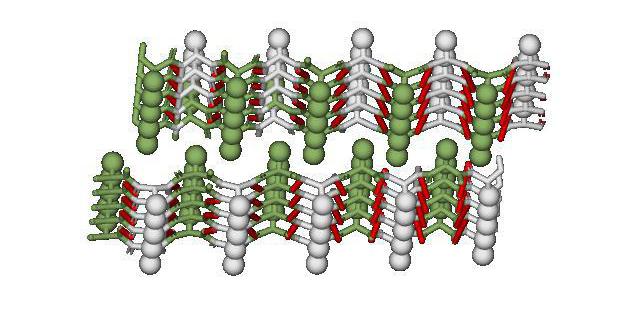
К липопротеинам относятся белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент удерживает белок в мембране (рис. 21).
Рис. 21. Липопротеины в клеточной мембране
К липопротеинам относят также белки крови, участвующие в транспорте липидов и не образующие с ними ковалентную связь.
Гликопротеины
Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Углеводные группировки истинных гликопротеинов содержат обычно до 15 – 20 моносахаридных компонентов, у протеогликанов они построены из очень большого числа моносахаридных остатков (рис. 22).
Рис. 22. Гликопротеины
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани и т.д. Многие ферменты и транспортные белки являются гликопротеинами.
Классификация по функциям
По выполняемым функциям белки можно разделить на структурные, питательные и запасные белки, сократительные, транспортные, каталитические, защитные, рецепторные, регуляторные и др.
Структурные белки
К структурным белкам относятся коллаген, эластин, кератин, фиброин. Белки принимают участие в формировании клеточных мембран, в частности, могут образовывать в них каналы или выполнять другие функции ( рис. 23).
Рис. 23. Клеточная мембрана.
Питательные и запасные белки
Питательным белком является казеин, основная функция которого заключается в обеспечении растущего организма аминокислотами, фосфором и кальцием. К запасным белкам относятся яичный белок, белки семян растений. Эти белки потребляются во время развития зародышей. В организме человека и животных белки в запас не откладываются, они должны систематически поступать с пищей, в противном случае может развиться дистрофия.
Сократительные белки
Сократительные белки обеспечивают работу мышц, движение жгутиков и ресничек у простейших, изменение формы клеток, перемещение органелл внутри клетки. Такими белками являются миозин и актин. Эти белки присутствуют не только в мышечных клетках, их можно обнаружить в клетках практически любой ткани животных.
Транспортные белки
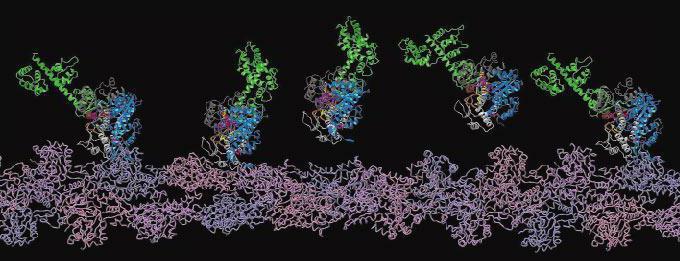
Гемоглобин, рассмотренный в начале параграфа, является классическим примером транспортного белка. В крови присутствуют и другие белки, обеспечивающие транспорт липидов, гормонов и иных веществ. В клеточных мембранах находятся белки, способные переносить через мембрану глюкозу, аминокислоты, ионы и некоторые другие вещества. На рис. 24 схематически показана работа переносчика глюкозы.
Рис. 24. Транспорт глюкозы через клеточную мембрану
Белки-ферменты
Каталитические белки, или ферменты, представляют собой самую многообразную группу белков. Почти все химические реакции, протекающие в организме, протекают при участии ферментов. К настоящему времени открыто несколько тысяч ферментов. Более подробно они будут рассмотрены в следующих параграфах.
Защитные белки
К этой группе относятся белки, защищающие организм от вторжения других организмов или предохраняющие его от повреждений. Иммуноглобулины, или антитела, способны распознавать проникшие в организм бактерии, вирусы или чужеродные белки, связываться с ними и способствовать их обезвреживанию.
Другие компоненты крови, тромбин и фибриноген, играют важную роль в процессе свертывания крови. Они предохраняют организм от потери крови при повреждении сосудов. Под действием тромбина от молекул фибриногена отщепляются фрагменты полипептидной цепи, в результате этого образуется фибрин:
фибриноген фибрин.
Образовавшиеся молекулы фибрина агрегируют, формируя длинные нерастворимые цепи. Сгусток крови вначале является рыхлым, затем он стабилизируется за счет межцепочечных сшивок. Всего в процессе свертывания крови участвует около 20 белков. Нарушения в структуре их генов является причиной такого заболевания, как гемофилия – сниженная свертываемость крови.
Рецепторные белки
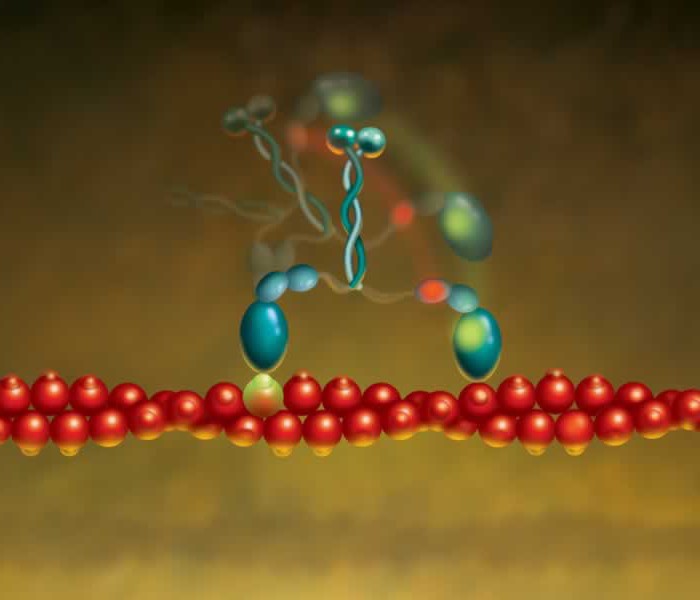
Клеточная мембрана является препятствием для многих молекул, в том числе и для молекул, предназначенных для передачи сигнала внутрь клеток. Тем не менее клетка способна получать сигналы извне благодаря наличию на ее поверхности специальных рецепторов, многие из которых являются белками. Сигнальная молекула, например, гормон, взаимодействуя с рецептором, образует гормон-рецепторный комплекс, сигнал от которого передается далее, как правило, на белковый посредник. Последний запускает серию химических реакций, результатом которых является биологический ответ клетки на воздействие внешнего сигнала (рис. 25).
Рис.25. Передача внешних сигналов в клетку
Регуляторные белки
Белки, участвующие в управлении биологическими процессами, относят к регуляторным белкам. К ним принадлежат некоторые гормоны. Инсулин и глюкагон регулируют уровень глюкозы в крови. Гормон роста, определяющий размеры тела, и паратиреоидный гормон, регулирующий обмен фосфатов и ионов кальция, являются регуляторными белками. К этому классу белков принадлежат и другие протеины, участвующие в регуляции обмена веществ.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
