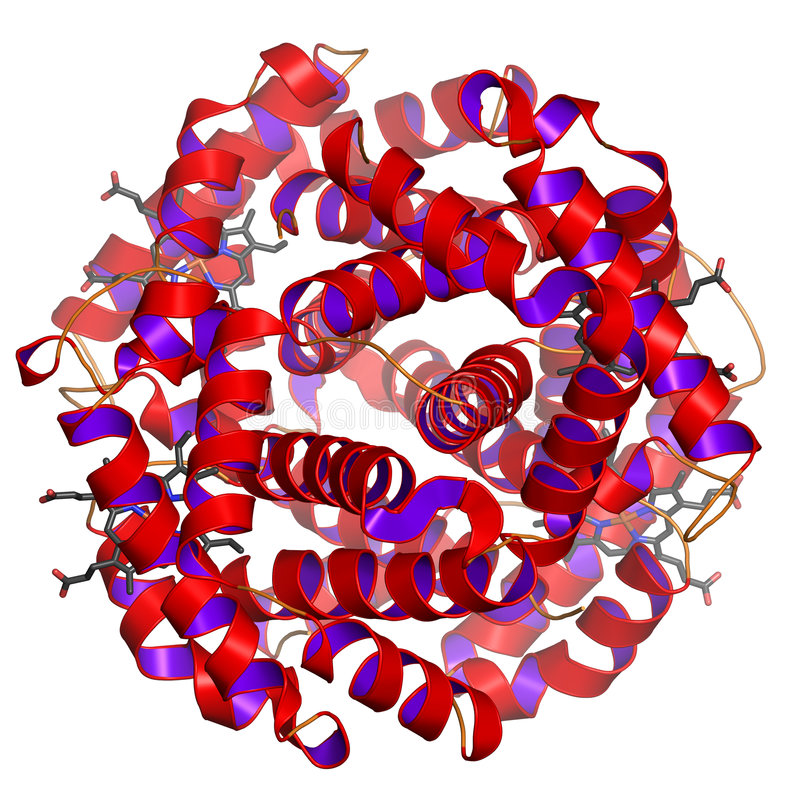
Гемоглобин это глобулярный белок
Большое количество органических веществ, входящих в состав живой клетки, отличаются крупными размерами молекул и представляют собой биополимеры. К ним относятся и белки, составляющие от 50 до 80% от сухой массы всей клетки. Мономерами белков являются аминокислоты, связывающиеся между собой с помощью пептидных связей. Белковые макромолекулы имеют несколько уровней организации и выполняют в клетке целый ряд важнейших функций: строительную, защитную, каталитическую, двигательную и др. В нашей статье мы рассмотрим особенности строения пептидов, а также приведем примеры глобулярных и фибриллярных белков, входящих в состав организма человека.
Формы организации макромолекул полипептидов
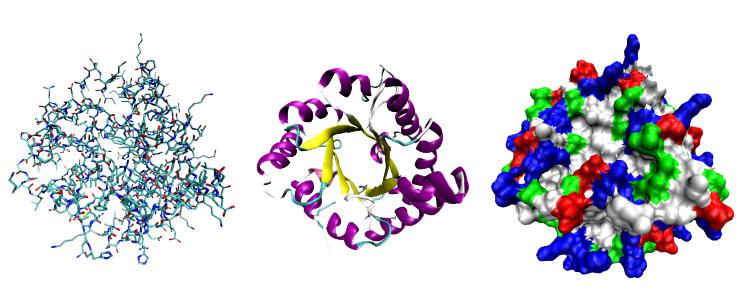
Аминокислотные остатки последовательно соединяются между собой прочными ковалентными связями, называемыми пептидными. Они достаточно прочные и удерживают в стабильном состоянии первичную структуру белка, имеющую вид цепи. Вторичная форма возникает в момент закручивания полипептидной цепи в альфа-спираль. Она стабилизирована дополнительно возникающими водородными связями. Третичная, или нативная, конфигурация имеет принципиальное значение, так как большинство глобулярных белков в живой клетке имеют именно такое строение. Спираль упаковывается в виде шара или глобулы. Ее устойчивость обусловлена не только появлением новых водородных связей, но и формированием дисульфидных мостиков. Они возникают вследствие взаимодействия атомов серы, входящих в состав аминокислоты цистеина. Не последнюю роль в образовании третичной структуры играют гидрофильные и гидрофобные взаимодействия между группами атомов внутри пептидной структуры. Если глобулярный белок объединяется с такими же молекулами посредством небелкового компонента, например, иона металла, то возникает четвертичная конфигурация – высшая форма организации полипептида.
Фибриллярные белки
Сократительную, двигательную и строительную функции в клетке выполняют белки, макромолекулы которых имеют вид тонких нитей – фибрилл. Полипептиды, входящие в состав волокон кожи, волос, ногтей, относят к фибриллярным видам. Наиболее известные из них – это коллаген, кератин и эластин. Они не растворяются в воде, но могут набухать в ней, образуя клейкую и вязкую массу. Пептиды линейного строения входят также в состав нитей веретена деления, образуя митотический аппарат клетки. Они прикрепляются к хромосомам, сокращаются и растягивают их к полюсам клетки. Этот процесс наблюдается в анафазу митоза – деления соматических клеток тела, а также в редукционной и эквационной стадии деления половых клеток – мейозе. В отличие от глобулярного белка фибриллы способны быстро растягиваться и сокращаться. Реснички инфузории-туфельки, жгутики эвглены зеленой или одноклеточной водоросли – хламидомонады построены из фибрилл и выполняют функции движения у простейших организмов. Сокращение мышечных белков – актина и миозина, входящих в состав мышечной ткани, обусловливают разнообразные движения скелетных мышц и поддержание мышечного каркаса человеческого тела.
Структура глобулярных белков
Пептиды – переносчики молекул различных веществ, защитные белки – иммуноглобулины, гормоны – это неполный перечень протеинов, третичная структура которых имеет вид шара – глобулы. В крови присутствуют определенные белки, которые имеют на своей поверхности определенные участки – активные центры. С их помощью они распознают и присоединяют к себе молекулы биологически активных веществ, вырабатываемых железами смешанной и внутренней секреции. С помощью глобулярных белков гормоны щитовидной и половых желез, надпочечников, тимуса, гипофиза доставляются к определенным клеткам организма человека, снабженным специальными рецепторами для их распознавания.
Мембранные полипептиды
Жидкостно-мозаичная модель строения клеточных мембран наилучшим образом приспособлена к выполнению ими важных функций: барьерной, рецепторной и транспортной. Белки, входящие в нее, осуществляют транспорт ионов и частиц некоторых веществ, например глюкозы, аминокислот и др. Изучить свойства глобулярных белков-переносчиков можно на примере натрий-калиевого насоса. Он осуществляет переход ионов из клетки в межклеточное пространство и обратно. Ионы натрия постоянно движутся в середину клеточной цитоплазмы, а катионы калия – из клетки наружу. Нарушение нужной концентрации этих ионов приводит к гибели клетки. Чтобы предотвратить эту угрозу, в клеточную мембрану встроен специальный протеин. Строение глобулярных белков таково, что они переносят катионы Na+ и K+ против градиента концентрации с использованием энергии аденозинтрифосфорной кислоты.
Строение и функции инсулина
Растворимые белки шаровидной структуры, находящиеся в третичной форме, выполняют функции регуляторов обмена веществ в организме человека. Вырабатываемый бета-клетками островков Лангерганса инсулин осуществляет контроль уровня глюкозы в крови. Он состоит из двух полипептидных цепей (α- и β- формы), соединенных несколькими дисульфидными мостиками. Это ковалентные связи, возникающие между молекулами серосодержащей аминокислоты – цистеина. Гормон поджелудочной железы в основном состоит из упорядоченной последовательности аминокислотных звеньев, организованных в форме альфа-спирали. Незначительная его часть имеет вид β- структуры и аминокислотных остатков без строгой ориентации в пространстве.
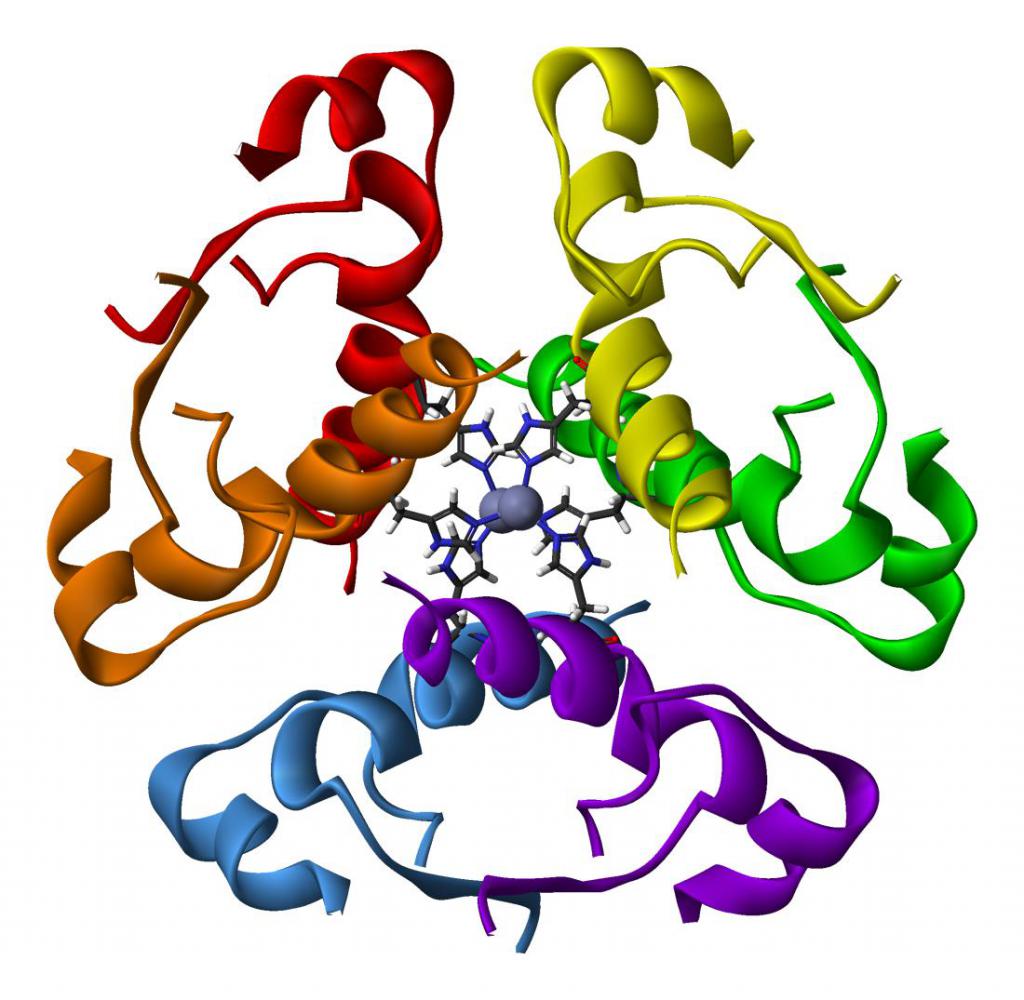
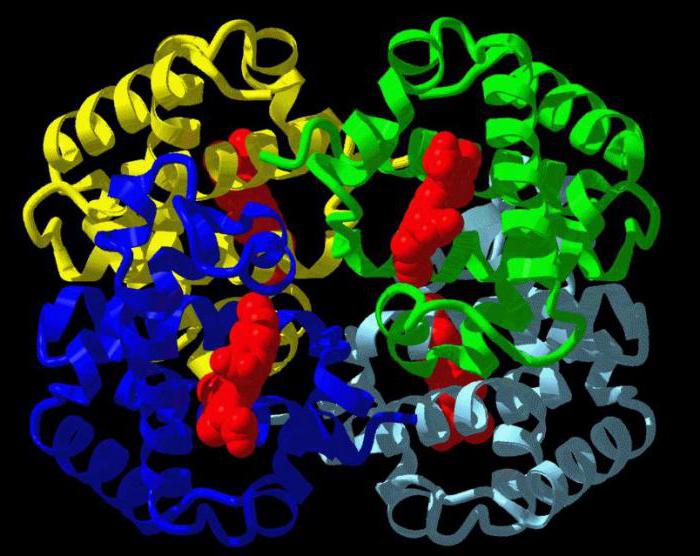
Гемоглобин
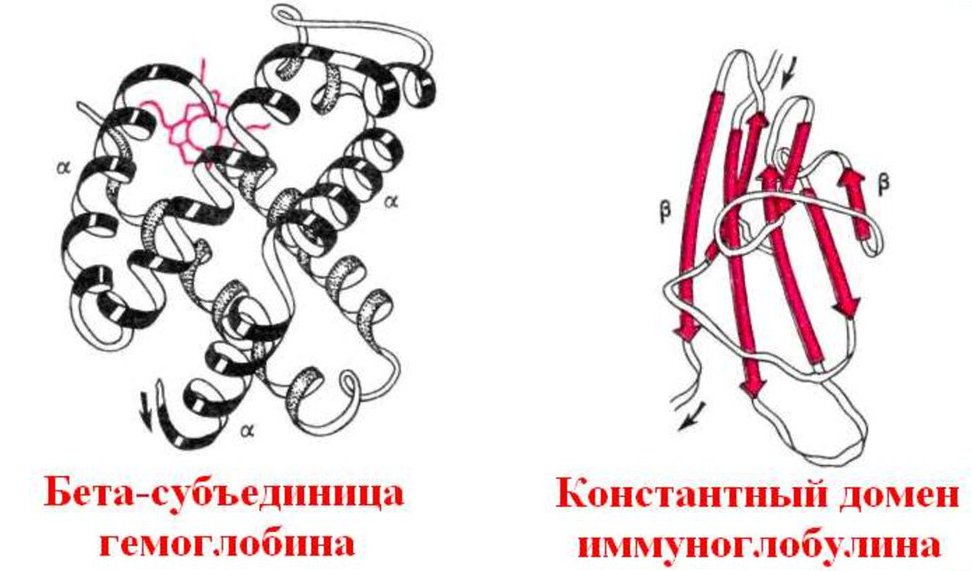
Классическим примером глобулярных пептидов служит белок крови, обусловливающий красную окраску крови – гемоглобин. Протеин содержит четыре полипептидных участка в виде альфа- и бета-спирали, которые связаны небелковым компонентом – гемом. Он представлен ионом железа, связывающим полипептидные цепи в одну конфирмацию, относящуюся к четвертичной форме. К молекуле протеида присоединяются частицы кислорода (в таком виде он называется оксигемоглобином) и далее транспортируются к клеткам. Это обеспечивает нормальное протекание процессов диссимиляции, так как для получения энергии клетка окисляет поступившие в нее органические вещества.
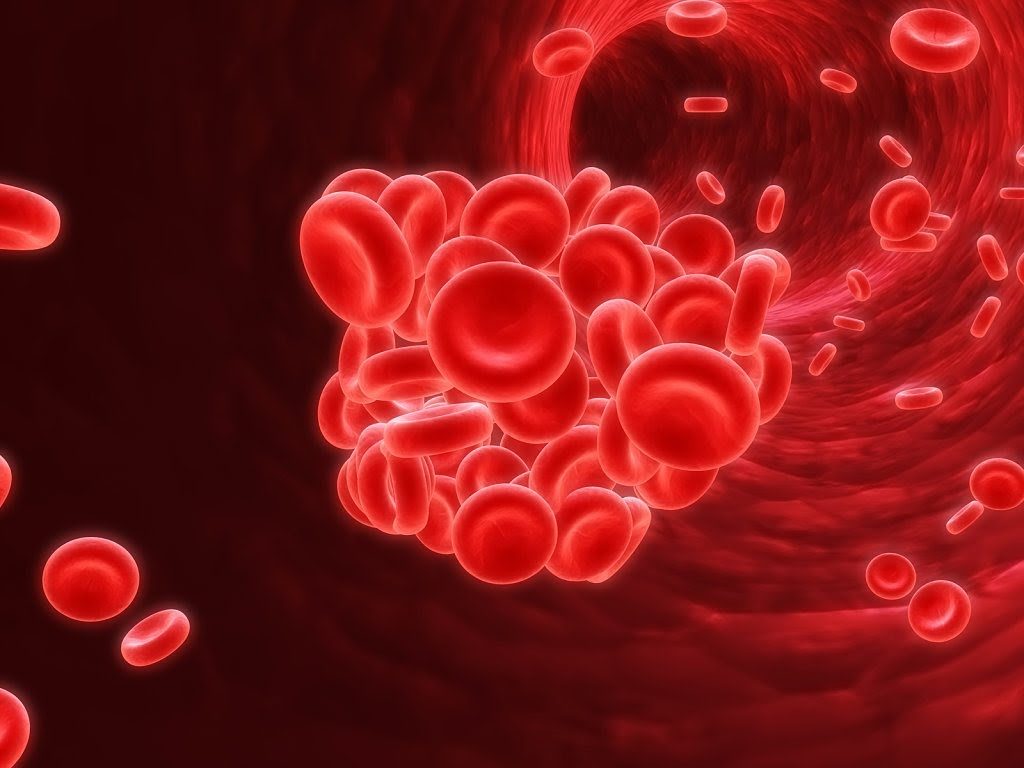
Роль белка крови в транспорте газов
Кроме кислорода гемоглобин способен также присоединять углекислый газ. Диоксид углерода образуется как побочный продукт катаболических клеточных реакций и подлежит удалению из клеток. Если во вдыхаемом воздухе присутствует монооксид карбона – угарный газ, он способен образовывать прочное соединение с гемоглобином. В этом случае токсическое вещество без цвета и запаха в процессе дыхания быстро проникает к клеткам организма, вызывая отравление. Особенно чувствительны к высокой концентрации угарного газа структуры головного мозга. Возникает паралич дыхательного центра, расположенного в продолговатом мозге, что влечет за собой смерть от удушья.
В нашей статье мы рассмотрели структуру, строение и свойства пептидов, а также привели примеры глобулярных белков, выполняющих в организме человека ряд важных функций.
Для возникновения простейшей биологической системы в условиях нашей планеты достаточно присутствия всего двух видов органических веществ: нуклеиновых кислот и белков. Структура этих соединений имеет как черты сходства, так и кардинальные различия. Например, они являются биополимерами, находятся во всех без исключения клетках живых организмов. Соединения под действием негативных факторов могут изменять свою нативную структуру – подвергаться денатурации и деструкции. В нашей статье мы рассмотрим, какую роль выполняют белки в молекулах сложных веществ, например, таких как гликопротеиды и липопротеиды. Также изучим особенности строения глобулярных белков и приведем примеры различных их видов.
Строение пептидов
Гигантские размеры белков (по сравнению с величиной других клеточных органических соединений – углеводов, жиров, витаминов и т. д.) объясняются их строением. Все белки, иначе называемые протеинами, представляют собой сложные комплексы – полимеры. Они имеют не только большую молекулярную массу, но и несколько форм пространственного расположения собственной макромолекулы. Элементарные частицы белкового полимера – это 20 видов аминокислот, участвующих в реакции поликонденсации. Они соединяются между собой посредством пептидных связей -CO—NH-, благодаря которым и образуется простейшая форма макромолекулы. Такая структура белков носит название первичной или линейной конфигурации. Образование дополнительных, сначала водородных связей, а затем и дисульфидных мостиков приводит к появлению спиральной и глобулярной форм белка. Третичная конфигурация в форме сферических молекул – глобул– распространена в живых биосистемах: клетках, органах, тканях. Она может усложняться в виде нескольких глобул, связанных небелковым компонентом, и образовывать высшую форму организации – четвертичную структуру.
Гемоглобин
В систему жидких сред организма входит кровь. Ее главная функция – это транспорт различных соединений. Кроме питательных веществ, например глюкозы, содержащейся в кровяной плазме, к клеткам поступает кислород, а удаляется из них углекислый газ. Молекулы O2 соединяются со специальным белком – гемоглобином – и далее, в связанном состоянии, разносятся к клеткам. Кислород необходим им для процесса дыхания, которое заключается в окислении органических веществ. Гемоглобин представляет собой глобулярный белок, который состоит из четырех аминокислотных цепей. Они удерживаются вместе благодаря небелковому компоненту, который называется гемом и содержит ион железа. Комплекс кислорода и протеина называется оксигемоглобином. В процессах метаболизма в клетках образуется побочный продукт распада – углекислый газ. Его молекулы также способны соединяться с гемоглобином, образуя карбоксигемоглобин. Углекислый газ поступает в органы дыхания и путем диффузии, затем удаляется из организма во время выдоха.
Свойства глобулярных белков
В основе гуморального вида иммунитета лежит способность специфических белков к выполнению функции защиты клеток, органов и тканей от повреждающего действия патогенной микрофлоры и микрофауны: вирусов, бактерий, простейших, грибков и т. д. Глобулярные белки-антитела взаимодействуют как с самими возбудителями, так и с их токсинами по принципу “ключ – замок”. Антитела включаются в обмен веществ бактерии или вируса и блокируют его. Чем выше сродство защитных протеинов и их специфичность, тем быстрее антитела уничтожают патогенные факторы. Человечество успешно борется с такими тяжелыми заболеваниями, как столбняк, корь или дифтерия, вводя здоровым людям, побывавшим в контакте с заболевшими, уже готовые антитела в виде сывороток. Эти вещества получают из крови предварительно зараженных животных: свиней, коров или обезьян, содержащей антитела. Сыворотка имеет в своем составе необходимый защитный глобулярный белок и помогает предотвратить заражение или облегчить протекание уже начавшейся болезни.

Ферменты
Химические реакции в клетках, в отличие от аналогично проведенных в лаборатории или происходящих в природе, протекают очень быстро. Объясняется это участием в них особых веществ – энзимов или ферментов. Биологический активатор скорости определенной реакции процесса обмена веществ – это глобулярный белок, имеющий сложное строение. В его составе есть специфическое образование – активный центр, связывающийся с субстратом реакции. Он и влияет на скорость процесса, происходящего с веществом. Все ферменты специфичны и влияют только на определенный химический процесс.
Классификация
Протеины, имеющие шаровидную форму молекулы и влияющие на протекание реакций ассимиляции и диссимиляции, можно разделить на несколько видов. Критериями будут типы реакции, форма и локализация фермента в клетке. К глобулярным белкам относится класс ферментов: пепсин, амилаза, глутаминсинтетаза, синтаза жирных кислот и т. д. Приведем несколько примеров.
Виды и функции глобулярных протеинов
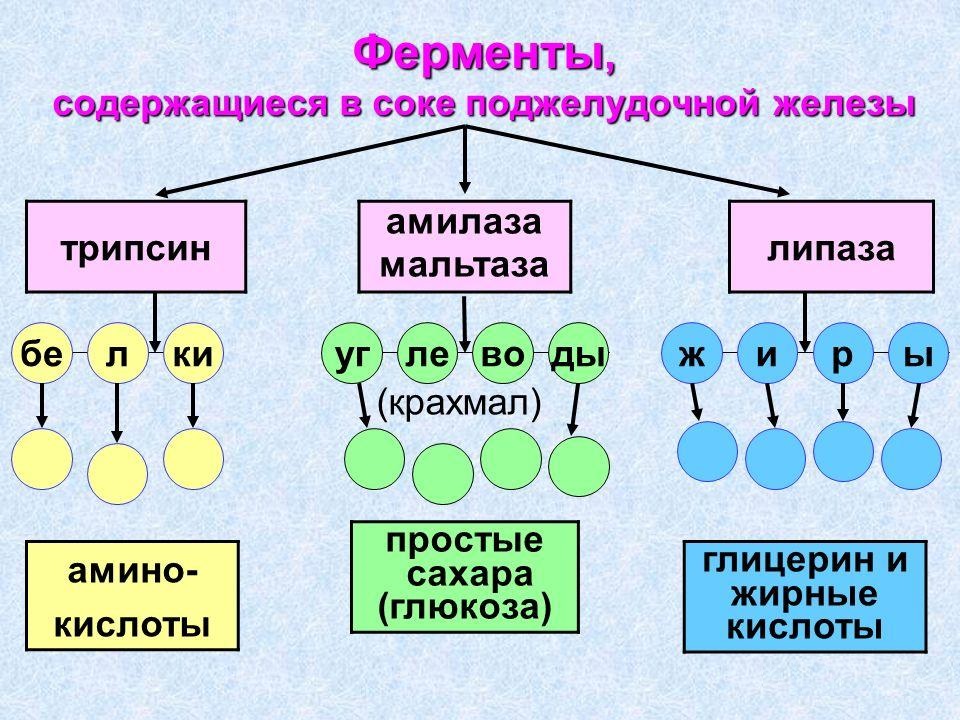
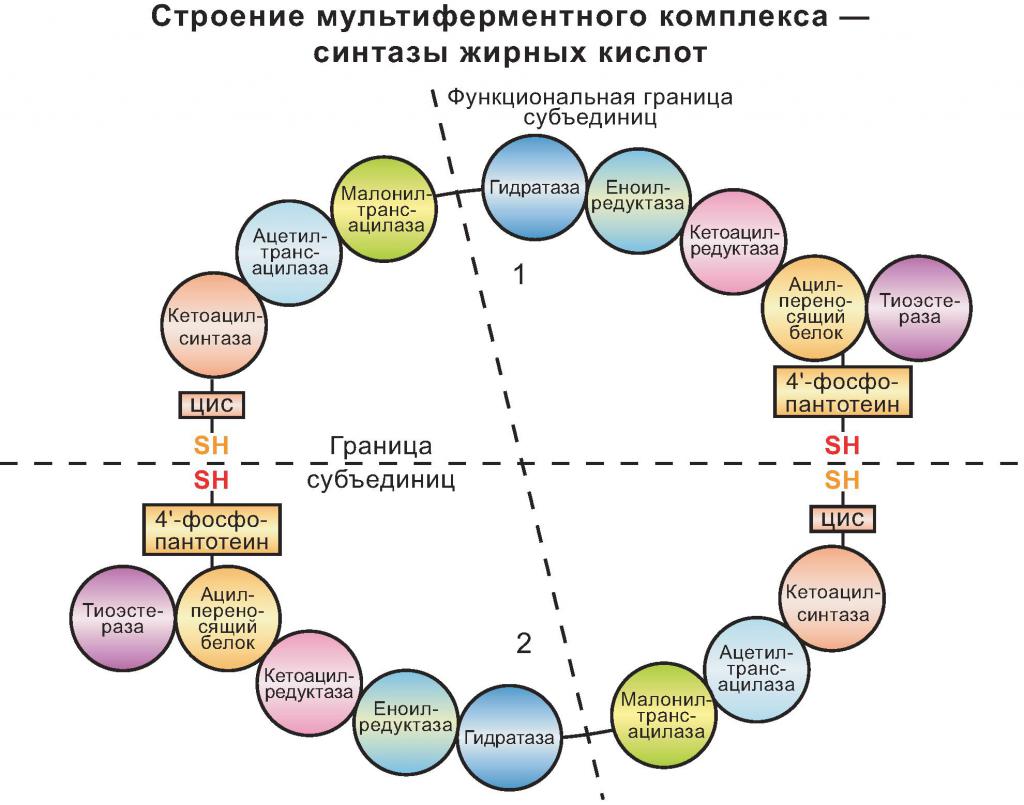
Пепсин осуществляет расщепление пищевых белков в желудке в процессе энергетического обмена. Он синтезируется слизистым слоем желудочных клеток, состоящим из железистого эпителия. Амилаза, в отличие от пепсина, содержится не только в организме человека или животных, но и у растений. У них фермент образуется в момент прорастания семени, синтезируясь в летках зародыша. Он и ускоряет расщепление крахмала до глюкозы, необходимой для прорастания семени. У млекопитающих амилаза входит в состав панкреатического сока и расщепляет сложные углеводы. Синтаза жирных кислот – это крупный фермент цитоплазмы, обеспечивающий синтез жиров и высших жирных кислот.
В нашей статье мы изучили строение и свойства глобулярных белков.
Существует четыре наиболее важных класса органических соединений, которые входят в состав организма: нуклеиновые кислоты, жиры, углеводы и белки. О последних и пойдет речь в этой статье.
Что такое белок?
Это полимерные химические соединения, построенные из аминокислот. Белки имеют сложную структуру.
Как синтезируется белок?
Это происходит в клетках организма. Существуют специальные органоиды, которые отвечают за этот процесс. Это рибосомы. Они состоят из двух частей: малой и большой, которые объединяются во время работы органеллы. Процесс синтезирования полипептидной цепочки из аминокислот называется трансляцией.
Какие бывают аминокислоты?
Несмотря на то что разновидностей белков в организме несметное количество, аминокислот, из которых они могут быть сформированы, существует всего двадцать. Такое разнообразие белков достигается за счет различных комбинаций и последовательности этих аминокислот, а также разного размещения построенной цепочки в пространстве.
Аминокислоты содержат в своем химическом составе две противоположные по своим свойствам функциональные группы: карбоксильную и аминогруппу, а также радикал: ароматический, алифатический или гетероциклический. Кроме того, в состав радикалов могут входить дополнительные функциональные группы. Это могут быть карбоксильные группы, аминогруппы, амидные, гидроксильные, гуанидовые группы. Также радикал может содержать в своем составе серу.
Вот список кислот, из которых могут быть построены белки:
- аланин;
- глицин;
- лейцин;
- валин;
- изолейцин;
- треонин;
- серин;
- глутаминовая кислота;
- аспарагиновая кислота;
- глутамин;
- аспарагин;
- аргинин;
- лизин;
- метионин;
- цистеин;
- тирозин;
- фенилаланин;
- гистидин;
- триптофан;
- пролин.
Из них десять являются незаменимыми — такими, которые не могут быть синтезированы в организме человека. Это валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, гистидин, аргинин. Они обязательно должны поступать в организм человека с пищей. Много таких аминокислот содержится в рыбе, говядине, мясе, орехах, бобовых.
Первичная структура белка — что это такое?
Это последовательность аминокислот в цепочке. Зная первичную структуру белка, можно составить точную его химическую формулу.

Вторичная структура
Это способ скручивания полипептидной цепочки. Существует два варианта конфигурации белка: альфа-спираль и бета-структура. Вторичная структура белка обеспечивается водородными связями между СО- и NH- группами.
Третичная структура белка
Это пространственная ориентация спирали или способ ее укладки в определенном объеме. Ее обеспечивают дисульфидные и пептидные химические связи.
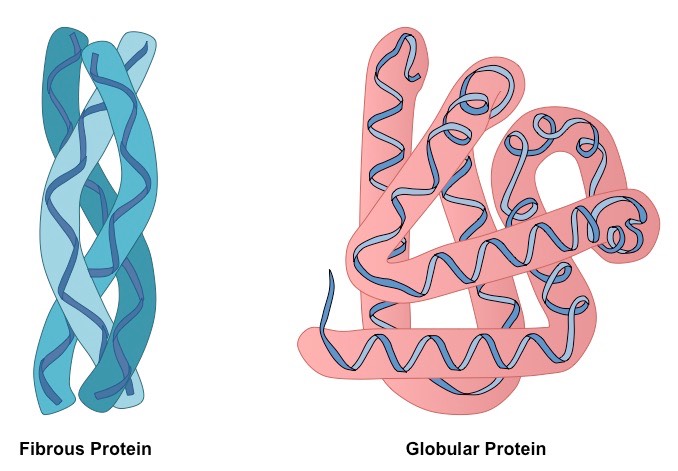
В зависимости от типа третичной структуры существуют фибриллярные и глобулярные белки. Последние имеют шаровидную форму. Структура фибриллярных белков напоминает нить, которая формируется путем многослойной укладки бета-структур или параллельного расположения нескольких альфа-структур.
Четвертичная структура
Она свойственна для белков, которые имеют в своем составе не одну, а несколько полипептидных цепочек. Такие белки называются олигомерными. Отдельные цепочки, входящие в их состав, называют протомерами. Протомеры, из которых построен олигомерный белок, могут обладать как одинаковой, так и разной первичной, вторичной или третичной структурой.
Что такое денатурация?
Это разрушение четвертичной, третичной, вторичной структур белка, вследствие чего он теряет свои химические, физические свойства и больше не может выполнять свою роль в организме. Этот процесс может происходить в результате действия на белок высоких температур (от 38 градусов Цельсия, но для каждого белка эта цифра индивидуальна) или агрессивных веществ, таких как кислоты и щелочи.
Некоторые белки способны к ренатурации — возобновлению своей первоначальной структуры.
Классификация белков
Учитывая химический состав, их разделяют на простые и сложные.
Простые белки (протеины) — это те, в состав которых входят только аминокислоты.
Сложные белки (протеиды) — те, которые имеют в своем составе простетическую группу.
В зависимости от вида простетической группы белки можно разделить на:
- липопротеиды (содержат липиды);
- нуклеопротеиды (в составе есть нуклеиновые кислоты);
- хромопротеиды (содержат пигменты);
- фосфопротеиды (имеют в составе фосфорную кислоту);
- металлопротеиды (содержат металлы);
- гликопротеиды (в составе есть углеводы).
Кроме того, в зависимости от типа третичной структуры существует глобулярный и фибриллярный белок. Оба могут быть как простыми, так и сложными.
Свойства фибриллярных белков и их роль в организме
Их можно разделить на три группы в зависимости от вторичной структуры:
- Альфа-структурные. К ним относится кератины, миозин, тропомиозин и другие.
- Бета-структурные. Например, фиброин.
- Коллаген. Это белок, который обладает особой вторичной структурой, которая не является ни альфа-спиралью, ни бета-структурой.
Особенности фибриллярных белков всех трех групп заключаются в том, что они обладают нитевидной третичной структурой, а также не растворимы в воде.
Поговорим об основных фибриллярных белках подробнее по порядку:
- Кератины. Это целая группа разнообразных белков, которые являются главной составляющей волос, ногтей, перьев, шерсти, рогов, копыт и т. д. Кроме того, фибриллярный белок этой группы цитокератин входит в состав клеток, формируя цитоскелет.
- Миозин. Это вещество, которое входит в состав мышечных волокон. Наряду с актином, этот фибриллярный белок является сократительным и обеспечивает функционирование мышцы.
- Тропомиозин. Это вещество состоит из двух переплетенных альфа-спиралей. Он также входит в состав мышц.
- Фиброин. Этот белок выделяется многими насекомыми и паукообразными. Он является основной составляющей паутины и шелка.
- Коллаген. Это наиболее распространенный фибриллярный белок в организме человека. Он входит в состав сухожилий, хрящей, мышц, сосудов, кожи и т. д. Это вещество обеспечивает эластичность тканей. Выработка коллагена в организме с возрастом снижается, в связи с чем возникают морщины на коже, ослабевают сухожилия и связки и т. д.
Далее рассмотрим вторую группу белков.
Глобулярные белки: разновидности, свойства и биологическая роль
Вещества данной группы имеют форму шара. Они могут быть растворимыми в воде, растворах щелочей, солей и кислот.
Наиболее распространенными глобулярными белками в организме являются:
- Альбумины: овальбумин, лактальбумин и др.
- Глобулины: белки крови (напр., гемоглобин, миоглобин) и др.
Подробнее о некоторых из них:
- Овальбумин. Из этого белка на 60 процентов состоит яичный белок.
- Лактальбумин. Основная составляющая молока.
- Гемоглобин. Это сложный глобулярный белок, в составе которого в качестве простетической группы присутствует гем — это пигментная группа, содержащая железо. Гемоглобин содержится в эритроцитах. Это белок, который способен связываться с кислородом и транспортировать его.
- Миоглобин. Это белок, похожий на гемоглобин. Он выполняет ту же функцию — перенос кислорода. Такой белок содержится в мышцах (поперечнополосатых и сердечной).
Теперь вы знаете основные различия между простыми и сложными, фибриллярными и глобулярными белками.
