Гемоглобин распад и синтез
Тема 3 (вопрос 4 и 5).
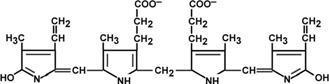
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом – гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент – порфобилиногенсинтаза – ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.
Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
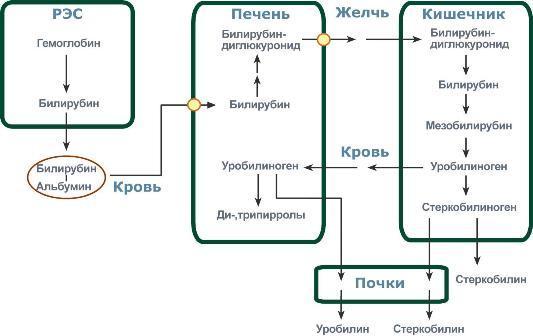
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 – 2×1011 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Гемоглобин синтезируется в клетках костного мозга. Все необходимые для синтеза гемоглобина составные части поступают с током крови.
Белковая часть молекулы синтезируется как и все простые белки из аминокислот матричным способом.
Синтез гема протекает в несколько стадий под влиянием различных ферментов:
1. Вначале происходит образование дельта-аминолевулиновой кислоты. Это реакция протекает в результате конденсации сукцинил-КоА и глицина в митохондриях под действием фермента аминолевулинатсинтетазы.
2.Следующая реакция протекает в цитоплазме. Происходит образование порфобилиногена в результате реакции конденсации двух молекул дельта-аминолевулиновых кислот.
3.Затем, в результате многоступенчатых реакций из четырех монопиррольных молекул порфобилиногена образуется протопорфирин 1Х, являющийся непосредственным предшественником гема.
4. Протопорфирин IX присоединяет молекулу железа (реакция осуществляется под влиянием фермента гемсинтетазы или феррохелатазы) и образуется гем, который затем используется для биосинтеза всех гемопротеидов. Оба фермента, участвующие в синтезе ПБГ, регулируемые, они ингибируются гемом и НЬ. Поэтому гем не образуется в избытке или недостатке. Также строго в определенном количестве образуется и белковая часть Нb, т. к. ее синтез может происходить только в присутствии тема, и образующиеся полипептидные цепи тут же соединяются с гемом. При низкой концентрации гема, когда нарушается его синтез, образование гемоглобина также замедляется.
Каждая из образовавшихся полипетидных цепей глобина присоединяются кодному гему, образуя моном ер гемоглобиан. 4 таких мномера, объединивщись, образуют гемоглобин.
Основной функцией гемоглобина является перенос кислорода из легких к тканям и перенос углекислого газа от тканей к легким, участие в поддержке рН крови. Свои функции гемоглобин выполняет только в составе эритроцита. Продолжительность жизни эритроцита 110-120 дней. Затем эритроцит подвергается гемолизу
3. Распад гемоглобина. Превращение билирубина в желудочно- кишечном тракте. Свободный и связанный билирубин. Свойства.
При гемолизе эритроцитов гемоглобин попадает в кровь и соединяется с белком гаптоглобином, в виде комплекса гемоглобин-гаптоглобин (Нр-Нb) транспортируется в клетки макрофагально-моноцитарной системы (ММС): это Купферовы клетки печени, клетки лимфоузлов, селезенки, пейеровых бляшек в кишечнике.
Процесс начинается с окислительного расщепления метинового мостикамежду первым и вторым пиррольными кольцами и образуется вердоглобин. Затем от вердоглобина отщепляется глобин, железо и образуется биливердин (зеленого цвета), вещество линейной структуры. Железо соединяется с b-глобулинами и в виде трансферина доставляется в печень и селезенку, где депонируется в виде ферритина. Глобин распадается так же как и все простые белки до аминокислот.
Биливердин восстанавливается за счет НАДФН2 в неконьюгированный,
свободный билирубин, который не растворим в воде и является токсичным соединением. Свободный билирубин выходит из клеток ММС, соединяется с
альбуминами и поступает в гепатоциты. В крови он называется непрямым потому, что дает реакцию с реактивом Эрлиха не сразу, а после добавления в сыворотку крови кофеинового реактива или спирта для осаждения белка.
В Купферовых клетках печени распад гемоглобина также начинается с
образования вердоглобина, затем биливердина. В печени непрямой билирубин обезвреживается в гепатоцитах путем реакции конъюгации, соединяясь с одной или двумя молекулами глюкуроновой кислоты, образуя моно- или диглюкуронид билирубина. Такой билирубин называется конъюгированным и
связанным и прямым. Этот билирубин хорошо растовряется в воде, не обладает токсическими свойствами. Биливердин и прямой билирубин собираются в желчном пузыре, придавая желчи оливковый цвет и потому их относят к пигментам желчи. Желчь поступает в тонкий кишечник, но в желчном протоке прямой билирубин, теряя глюкуроновые кислоты, снова превращается в непрямой. Биливердин проходит через весь кишечник не изменяя своей химической структуры и удаляется с калом, окрашивая его в зеленоватый цвет, т.е. он является пигментом кала. А непрямой билирубин в кишечнике восстанавливается до мезобилиногена (уробилиногена), часть которого всасывается в воротную вену и возвращается в печень, где распадается до бесцветных моно- и дипирролов. Последние выводятся через почки вместе с мочой.
Большая часть мезобилиногена поступает в толстый кишечник, где под
влиянием ферментов микроорганизмов восстанавливается в стеркобилиноген. Часть стеркобилиногена, всасываясь в кровь через геморроидальные вены, попадает в почки. В моче под действием света и воздуха происходит окисление стеркобилиногена до стеркобилина, который придает моче желтый цвет, т.е. является пигментом мочи. Остальная часть стеркобилиногена окисляется в толстом кишечнике на свету до стеркобилина и вместе с биливердином является пигментом кала, придавая ему коричнево-зеленый цвет.
У грудных детей в кишечнике нет гнилостных бактерий, поэтому
билирубин не превращается в стеркобилиноген и выводится как таковой. Соответственно цвет кала у детей обусловлен биливердином и билирубином (желто-зеленый).
У детей в первые три месяца эмбрионального периода образуется эмбриональный гемоглобин. Затем он преобразуется в фетальный (гемоглобин F), который доминирует вплоть до рождения ребенка. После рождения в течение первого месяца жизни фетальный гемоглобин постепенно заменяется на гемоглобин взрослого (гемоглобин А), отличающегося составом полипептидных цепей. Эмбриональный и фетальный гемоглобин обладают более высоким сродством к кислороду по сравнению с гемоглобином взрослого.
Пигменты желчи, кала и мочи.
При распаде гемоглобина образуются пигменты желчи, кала и мочи.
Пигменты желчи: биливердин (зеленого цвета), связанный билирубин (глюкурониды билирубина –желтого цвета). Цвет желчи зависит от соотношения этих пигментов.
Пигменты кала: биливердин (зеленого цвета), стеркобилин (коричневого цвета)
Пигмент мочи: стеркобилин
Цвет сыворотки крови тоже зависит в определенной степени от наличия в ней билирубина. В норме количество общего билирубина в крови равно 8—20 мкмоль/л, на долю непрямого билирубина приходится 75- 100%, а прямого от 0 до 25%. Количество прямого билирубина незначительно. Прямой билирубин проходит через пачечную ткань, и появляется в моче, непрямой билирубин в моче появиться не может, вследствие его нерастворимости в воде.
Гемоглобин
входит в состав группы белков гемопротеины,
которые сами являются подвидом
хромопротеинов и подразделяются на
неферментативные белки (гемоглобин,
миоглобин) и ферменты (цитохромы,
каталаза, пероксидаза). Небелковой
частью их является гем – структура,
включающая в себя порфириновое кольцо
(состоящее из 4 пиррольных колец) и иона
Fe2+. Железо связывается с порфириновым
кольцом двумя координационными и двумя
ковалентными связями.
Строение
гемоглобина.
Гемоглобин представляет собой белок,
включающий 4 гемсодержащие белковые
субъединицы. Между собой протомеры
соединяются гидрофобными, ионными,
водородными связями по принципу
комплементарности. При этом они
взаимодействуют не произвольно, а
определенным участком – контактной
поверхностью. Этот процесс высокоспецифичен,
контакт происходит одновременно в
десятках точек по принципу комплементарности.
Взаимодействие осуществляют разноименно
заряженные группы, гидрофобные участки,
неровности на поверхности белка. Белковые
субъединицы в нормальном гемоглобине
могут быть представлены различными
типами полипептидных цепей: α, β, γ, δ,
ε, ξ (соответственно, греч. – альфа, бета,
гамма, дельта, эпсилон, кси). В состав
молекулы гемоглобина входят по две цепи
двух разных типов. Гем состоит из иона
двухвалентного железа и порфирина. В
основе структуры порфиринов находится
порфин. Порфин представляет собой четыре
пиррольных кольца, связанных между
собой метеновыми мостикамиГем соединяется
с белковой субъединицей, во-первых,
через остаток гистидина координационной
связью железа, во-вторых, через гидрофобные
связи пиррольных колец и гидрофобных
аминокислот. Гем располагается как бы
“в кармане” своей цепи и формируется
гемсодержащий протомер.
Существует
несколько нормальных
вариантов гемоглобина:
HbР
– примитивный гемоглобин, содержит 2ξ-
и 2ε-цепи, встречается в эмбрионе между
7-12 неделями жизни,
HbF
– фетальный гемоглобин, содержит 2α- и
2γ-цепи, появляется через 12 недель
внутриутробного развития и является
основным после 3 месяцев,
HbA
– гемоглобин взрослых, доля составляет
98%, содержит 2α- и 2β-цепи, у плода появляется
через 3 месяца жизни и к рождению
составляет 80% всего гемоглобина,
HbA2
– гемоглобин взрослых, доля составляет
2%, содержит 2α- и 2δ-цепи,
HbO2
– оксигемоглобин, образуется при
связывании кислорода в легких, в легочных
венах его 94-98% от всего количества
гемоглобина,
HbCO2
– карбогемоглобин, образуется при
связывании углекислого газа в тканях,
в венозной крови составляет 15-20% от всего
количества гемоглобина.
Патологические
формы гемоглобина
HbS
– гемоглобин серповидно-клеточной
анемии.
MetHb
– метгемоглобин, форма гемоглобина,
включающая трехвалентный ион железа
вместо двухвалентного. Такая форма
обычно образуется спонтанно, в этом
случае ферментативных мощностей клетки
хватает на его восстановление. При
использовании сульфаниламидов,
употреблении нитрита натрия и нитратов
пищевых продуктов, при недостаточности
аскорбиновой кислоты ускоряется переход
Fe2+ в Fe3+. Образующийся metHb не способен
связывать кислород и возникает гипоксия
тканей. Для восстановления ионов железа
в клинике используют аскорбиновую
кислоту и метиленовую синь.
Hb-CO
– карбоксигемоглобин, образуется при
наличии СО (угарный газ) во вдыхаемом
воздухе. Он постоянно присутствует в
крови в малых концентрациях, но его доля
может колебаться от условий и образа
жизни. Угарный газ является активным
ингибитором гем-содержащих ферментов,
в частности, цитохромоксидазы 4-го
комплекса дыхательной цепи.
HbA1С
– гликозилированный гемоглобин.
Концентрация его нарастает при хронической
гипергликемии и является хорошим
скрининговым показателем уровня глюкозы
крови за длительный период времени.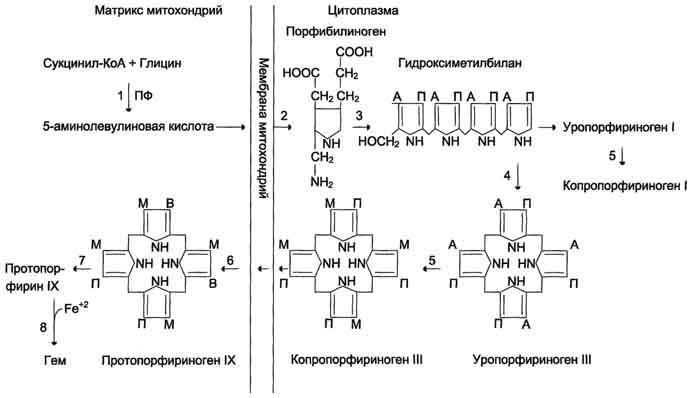
Биосинтез
гема.
Гем является небелковой частью многих
гемопротеинов:
гемоглобин
(до 85% общего количества гема организма),
локализованный в эритроцитах и клетках
костного мозга,
миоглобин
скелетных мышц и миокарда (17%),
цитохромы
дыхательной цепи и P450, цитохромоксидаза,
гомогентизатоксидаза, пероксидаза,
миелопероксидаза, каталаза, тиреопероксидаза
и т.д. – менее 1%. Синтез гема в основном
идет в предшественниках эритроцитов,
клетках печени, почек, слизистой
кишечника, и в остальных тканях. Первая
реакция синтеза с участием
δ-аминолевулинат-синтазы происходит в
митохондриях. Следующая реакция при
участии аминолевулинатдегидратазы
(порфобилиноген-синтазы) протекает в
цитозоле.Гем синтезируется во всех
тканях, но с наибольшей скоростью в
костном мозге и печени. В костном мозге
гем необходим для синтеза гемоглобина
в ретикулоцитах, в гепатоцитах – для
образования цитохрома Р450.
Первая
реакция синтеза гема – образование
5-аминолевулиновой кислоты из глицина
и сук-цинил-КоА идёт в матриксе митохондрий,
где в ЦТК образуется один из субстратов
этой реакции – сукцинил-КоА. Эту реакцию
катализирует пиридоксальзависимый
фермент аминолевулинатсинтаза. Из
митохондрий 5-аминолевулиновая кислота
поступает в цитоплазму. В цитоплазме
проходят промежуточные этапы синтеза
гема: соединение 2 молекул 5-аминолевулиновой
кислоты молекулу порфобилиногена,
дезаминирование порфобилиногена с
образованием гидроксиметилбилана,
ферментативное превращение
гидроксиметилбилана в молекулу
уропор-фобилиногена III, декарбоксилирование
последнего с образованием копропорфириногена
III. Гидроксиметилбилан может также
нефермента-тивно превращаться в
уропорфириноген I, который декарбоксилируется
в копропорфирино-ген I. Из цитоплазмы
копропорфириноген III опять поступает
в митохондрии, где проходят заключительные
реакции синтеза гема. В результате двух
последовательных окислительных реакций
копропорфириноген III превращается в
протопорфириноген IX, а протопорфириноген
IX – в Протопорфирин IX. Фермент феррохела-таза,
присоединяя к протопорфирину IX
двухвалентное лентное железо, превращает
его в гем. Источником железа для синтеза
гема служит депонирующий железо белок
ферритин. Синтезированный гем, соединяясь
с α и β-полипепептидными цепями глобина,
образует гемоглобин. Гем регулирует
синтез глобина: при снижении скорости
синтеза гема синтез глобина в ретикулоцитах
тормозится. 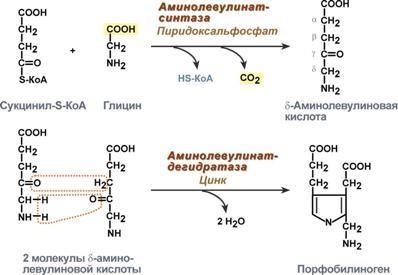
Регуляция
синтеза гема
1.
Скорость синтеза глобиновых цепей
зависит от наличия гема, он ускоряет
биосинтез “своих” белков.
2.
Основным регуляторным ферментом синтеза
гема является аминолевулинатсинтаза.
гем
после взаимодействия с молекулой
белка-репрессора формирует активный
репрессорный комплекс, связывается с
ДНК и подавляет транскрипцию, мРНК для
фермента не образуется и синтез фермента
прекращается. Также имеется отрицательный
аллостерический эффект гема на фермент.
с
другой стороны, достаточное количество
ионов железа оказывает положительный
эффект при синтезе молекулы
аминолевулинатсинтазы. В клетке имеется
особый железосвязывающий белок, который
в отсутствии ионов железа обладает
сродством к мРНК фермента и блокирует
ее трансляцию в рибосоме, т.е. синтез
белковой цепи. Ионы железа связываются
с этим железосвязывающим белком, образуя
с ним неактивный комплекс, что инициирует
синтез фермента.
3.
Положительным модулятором
аминолевулинатсинтазы служит гипоксия
тканей, которая в эритропоэтических
тканях индуцирует синтез фермента.
4.
В печени повышение активности
аминолевулинатсинтазы вызывают
соединения, усиливающие работу
микросомальной системы окисления
(жирорастворимые токсины, стероиды) –
при этом возрастает потребление гема
для образования цитохрома Р450, что
снижает внутриклеточную концентрацию
свободного гема. В результате происходит
дерепрессия синтеза фермента.
Распад.
За сутки у человека распадается около
9 г гемопротеинов, в основном это
гемоглобин эритроцитов. Эритроциты
живут 90-120 дней, после чего лизируются
в кровеносном русле или в селезенке.
При разрушении эритроцитов в кровяном
русле высвобождаемый гемоглобин образует
комплекс с белком-переносчиком
гаптоглобином (фракция α2-глобулинов
крови) и переносится в клетки
ретикуло-эндотелиальной системы (РЭС)
селезенки (гл образом), печени и костного
мозга.
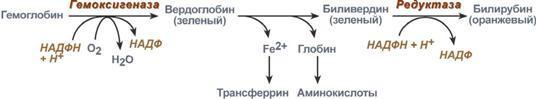
Первая
реакция катаболизма гема происходит
при участии NADPH-зависимого ферментативного
комплекса гемоксигеназы. Ферментная
сисгема локализована в мембране ЭР, в
области электронтранспортных цепей
микросомального окисления. Фермент
катализирует расщепление связи между
двумя пиррольными кольцами, содержащих
винильные остатки, – таким образом,
раскрывается структура кольца. В ходе
реакции образуются линейный тетрапир-рол
– биливердин (пигмент жёлтого цвета) и
монооксид углерода (СО), который получается
из углерода метениловой группы. Гем
индуцирует транскрипцию гена гемоксигеназы,
абсолютно специфичной по отношению к
тему.
Ионы
железа, освободившиеся при распаде
гема, могут быть использованы для синтеза
новых молекул гемоглобина или для
синтеза других железосодержащих белков.
Биливердин восстанавливается до
билирубина NADPH-зависимым ферментом
биливердинредуктазой. Билирубин
образуется не только при распаде
гемоглобина, не также при катаболизме
других гемсодержащю белков, таких как
цитохромы и миоглобин. При распаде 1 г
гемоглобина образуется 35 мг билирубина,
а в сутки у взрослого человека – примерно
250-350 мг билирубина. Дальнейший метаболизм
билирубина происходит в печени.
В
клетках РЭС гем в составе гемоглобина
окисляется молекулярным кислородом. В
реакциях последовательно происходит
разрыв метинового мостика между 1-м и
2-м пиррольными кольцами гема с их
восстановлением, отщеплением железа и
белковой части и образованием оранжевого
пигмента билирубина. Билирубин
– токсичное, жирорастворимое вещество,
способное нарушать окислительное
фосфорилирование в клетках. Особенно
чувствительны к нему клетки нервной
ткани. Из клеток ретикуло-эндотелиальной
системы билирубин попадает в кровь.
Здесь он находится в комплексе с
альбумином плазмы, в гораздо меньшем
количестве – в комплексах с металлами,
аминокислотами, пептидами и другими
малыми молекулами. Образование таких
комплексов не позволяет выделяться
билирубину с мочой. Билирубин в комплексе
с альбумином называется свободный
(неконъюгированный) или непрямой
билирубин. Из сосудистого русла в
гепатоциты билирубин попадает с помощью
белка-переносчика (лигандина). В клетке
протекает реакция связывания билирубина
с УДФ-глюкуроновой кислотой, при этом
образуются моно- и диглюкурониды. Кроме
глюкуроновой кислоты, в реакцию могут
вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название
связанный (конъюгированный) или прямой
билирубин. После образования
билирубин-глюкурониды АТФ-зависимым
переносчиком секретируются в желчные
протоки и далее в кишечник, где при
участии бактериальной β-глюкуронидазы
превращаются в свободный билирубин.
Одновременно некоторое количество
билирубин-глюкуронидов может попадать
(особенно у взрослых) из желчи в кровь
по межклеточным щелям. Таким образом,
в крови в норме одновременно существуют
две формы билирубина: свободный,
попадающий сюда из клеток РЭС (около
80% всего количества), и связанный,
попадающий из желчных протоков (до 20%).
Превращение
в кишечнике.
В кишечнике билирубин подвергается
восстановлению под действием микрофлоры
до мезобилирубина и мезобилиногена
(уробилиногена). Часть последних
всасывается и с током крови вновь
попадает в печень, где окисляется до
ди- и трипирролов. При этом в здоровом
организме в общий круг кровообращения
и в мочу мезобилирубин и уробилиноген
не попадают, а полностью задерживаются
гепатоцитами. Оставшаяся в кишечнике
часть пигментов ферментами бактериальной
флоры толстого кишечника восстанавливается
до стеркобилиногена и выделяется из
организма, окрашивая кал. Незначительное
количество стеркобилиногена через
геморроидальные вены попадает в большой
круг кровообращения, отсюда в почки и
выделяется с мочой. На воздухе
стеркобилиноген и уробилиноген
превращаются, соответственно, в
стеркобилин и уробилин.
Ситуации,
при которых в крови накапливается
билирубин, в зависимости от причины
делятся на три вида:![]()
1.Гемолитические
– в результате гемолиза при избыточном
превращении гемоглобина в билирубин,
2.Печеночно-клеточные
– когда печень не в состоянии обезвредить
билирубин,
3.Механические
– если билирубин не может попасть из
печени в кишечник из-за механического
перекрытия желчевыводящих путей.
Накопление
билирубина в крови свыше 43 мкмоль/л
ведет к связыванию его эластическими
волокнами кожи и конъюнктивы, что
проявляется в виде желтухи. Так как
свободный билирубин липофилен, то он
легко накапливается в подкожном жире
и нервной ткани. Последнее особенно
опасно для детей, особенно для
новорожденнных.
Гемолитическая
или надпеченочная желтуха
– ускоренное образование билирубина
в результате усиления внутрисосудистого
гемолиза. К данному типу желтух относятся
гемолитические анемии различного
происхождения: врожденный сфероцитоз,
серповидно-клеточная анемия, дефицит
глюкозо-6-фосфатдегидрогеназы, отравление
сульфаниламидами, талассемии, сепсис,
лучевая болезнь, несовместимость крови.
В данном случае гипербилирубинемия
развивается за счет фракции непрямого
билирубина. Гепатоциты усиленно переводят
непрямой билирубин в связанную форму,
секретируют его в желчь, в результате
в кале увеличивается содержание
стеркобилина, интенсивно его окрашивая.
В моче возрастает содержание уробилина,
билирубин отсутствует.У новорожденных
гемолитическая желтуха может развиться
как симптом гемолитической болезни
новорожденного.
Механическая
или подпеченочная желтуха
развивается вследствие снижения оттока
желчи при непроходимости желчного
протока – желчные камни, новообразования
поджелудочной железы, гельминтозы. В
результате застоя желчи происходит
растяжение желчных капилляров,
увеличивается проницаемость их стенок.
Не имеющий оттока в кишечник прямой
билирубин поступает в кровь, в результате
развивается гипербилирубинемия. В
тяжелых случаях, вследствие переполнения
гепатоцитов прямым билирубином, реакция
конъюгации с глюкуроновой кислотой
может нарушаться, присоединяется
печеночно-клеточная желтуха (см ниже).
В результате в крови увеличивается
концентрация непрямого билирубина. В
моче резко увеличен уровень билирубина
(цвет темного пива) и снижено количество
уробилина, практически отсутствует
стеркобилин кала (серовато-белое
окрашивание).
Паренхиматозная
(печеночно-клеточная) желтуха
– причиной может быть нарушение на всех
трех стадиях превращения билирубина в
печени: извлечение билирубина из крови
печеночными клетками, его конъюгирование
и секреция в желчь. Наблюдается при
вирусных и других формах гепатитов,
циррозе и опухолях печени, жировой
дистрофии печени, при отравлении
токсическими гепатотропными веществами,
при врожденных патологиях. Так как
нарушаются все процессы превращения
билирубина в печени, гипербилирубинемия
развивается за счет обеих фракций,
преимущественно прямого билирубина.
Концентрация его возрастает из-за
нарушения секреции в желчь и увеличения
проницаемости мембран клеток печени.
Количество непрямого билирубина
возрастает за счет функциональной
недостаточности гепатоцитов и/или
снижения их количества. В моче определяется
билирубин (цвет крепкого черного чая),
умеренно увеличена концентрация
уробилина, уровень стеркобилина кала
в норме или снижен.
Гемолитическая
болезнь новорожденного.Причины:
Несовместимость
крови матери и плода по группе или по
резус-фактору. Накопление гидрофобной
формы билирубина в подкожном жире
обуславливает желтушность кожи. Однако
реальную опасность представляет
накопление билирубина в сером веществе
нервной ткани и ядрах ствола с развитием
“ядерной желтухи” (билирубиновая
энцефалопатия).
Клиническая
диагностика: Проявляется сонливостью,
плохим сосанием, умственной отсталостью,
ригидностью затылочных мышц, тоническими
судорогами, тремором конечностей,
изменением рефлексов с возможным
развитием глухоты и параличей.
Физиологическая
(транзиторная) желтуха новорожденных.
Причины:относительное
снижение активности УДФ-глюкуронилтрансферазы
в первые дни жизни, связанное с повышенным
распадом фетального гемоглобина,абсолютное
снижение активности УДФ-глюкуронилтрансферазы
в первые дни жизни,дефицит
лигандина,слабая
активность желчевыводящих путей.Клиническая
диагностика:окрашивание
кожи на 3-4 день после рождения,гемолиза
и анемии нет.Симптомы
исчезают спустя 1-2 недели после рождения.
Желтуха
недоношенных.Причины:
относительное снижение активности
УДФ-глюкуронилтрансферазы в первые дни
жизни, связанное с повышенным распадом
фетального гемоглобина,абсолютное
снижение активности УДФ-глюкуронилтрансферазы
в первые дни жизни,дефицит
лигандина,слабая
активность желчевыводящих путей.Клиническая
диагностика:окрашивание кожи,гемолиза
и анемии нет. Исчезает спустя 3-4 недели
после рождения.
