Гемоглобин сложный белок хромопротеид
Получить выполненную работу или консультацию специалиста по вашему
учебному проекту
Узнать стоимость
Хромопротеины
Для них простетическая часть окрашена (chromos – краска). К хромопротеинам относятся гемоглобин, миоглобин, каталаза, пероксидаза, ряд флавинсодержащих ферментов (сукцинатдегидрогеназа, альдегидоксидаза, ксантиноксидаза), цитохромы (гемсодержащие белки) и т.д. Велика биологическая роль этих белков – участвуют в физиологических процессах: дыхание клетки, транспорте кислорода и углекислого газа, окислительно-восстановительных процессах.
Гемоглобин. Его белковая часть представлена глобином, небелковая – гемом. Это олигомерный белок, т.е. имеет четвертичную структуру, состоящую из 4 субъединиц.
a цепи построены из 141 АК-остатка.
b цепи из 146 АК-остатков [рис. 4-х субъединиц, в каждой нарисована точка – гем].
Каждая из субъединиц связана с гемом:
 [гем]
[гем]
Основная функция гемоглобина – транспортная (кислород, углекислый газ). Также он представляет собой основную буферную систему крови (75% от всей буферной емкости крови).
Различают:
– HbO2
– оксигемоглобин (связан с молекулой O2);
– HbCO – карбоксигемоглобин;
– HbCO2
– карбгемоглобин;
– HbOH – метгемоглобин (образуется при соединении с нитросоединениями, не способен связывать кислород).
Типы гемоглобина. Всего известно более 100 типов, но их все делят на 2 группы:
1) Физиологические гемоглобины;
2) Патологические (аномальные).
К физиологическим гемоглобинам относятся:
– Hb P – примитивный гемоглобин, имеет место быть у 1-2 недельного эмбриона;
– Hb F – фетальный или гемоглобин плода, к моменту рождения составляет около 70% всего гемоглобина в крови;
– Hb A, Hb A2, Hb A3 – это гемоглобины взрослого организма. На Hb A приходится около 90-96%.
Физиологические типы гемоглобинов отличаются глобулиновой частью (АК-составом). Например Hb A содержит 2a и 2b субъединицы, а Hb F – 2a и 2g субъединицы.
К аномальным (возникающих при наследственных заболеваниях) гемоглобинам относятся:
– HbS – гемоглобин, сопутствующий серповидно-клеточной анемии. Отличается от нормального тем, что с N-конца в 6 положении b–цепи глутамин заменен на валин.
Миоглобин по сравнению с гемоглобином имеет третичную структуру, одну полипептидную цепь, один гем и может связывать одну молекулу кислорода. Гемоглобин и миоглобин функционируют вместе. Гемоглобин доставляет кислород из легких к тканям, а миоглобин перераспределяет его внутри клетки (доставляет к митохондриям).
Гемоглобин – основной дыхательный белок крови, относящийся к хромопротеидам. Он состоит из белковой (глобин) и небелковой (гем) части, является белком четвертичной структуры и состоит из четырех субъединиц, каждая из которых включает в себя полипептидную цепь, соединенную с гемом, полипептидные цепи попарно одинаковы. Так, гемоглобин взрослого типа (НЬ А) имеет 2а- и 2y-полипептидные цепи. Фетальный гемоглобин, преобладающий в крови новорожденного (Hb F), имеет в своем составе 2а- и 2у-полипептидные цепи. У взрослого человека в крови 95-98% приходится на долю гемоглобина А, 1-1,5% составляет Hb F, 2-2,5% – на гемоглобин А2 (а2б2). Гемоглобин находится в эритроцитах в виде нескольких производных. Присоединение кислорода (к железу тема) приводит к образованию оксигемоглобина (НbО2). Отдав кислород тканям, оксигемоглобин превращается в восстановленную форму (НbО2 <-> ННb). Удаление диоксида углерода (углекислого газа) из тканей происходит путем его присоединения к свободным аминным группам глобина и при этом образуется карбаминогемоглобин (карбгемоглобин). Оксид углерода (СО) при соединении с железом гема образует стойкое соединение карбоксигемоглобин. Оксид углерода является продуктом обмена и образуется эндогенно при распаде гема (в норме – при старении эритроцитов). Содержание карбоксигемоглобина, в первую очередь, является показателем гемолиза эритроцитов. Железо гема находится в двухвалентной форме. При окислении его (Fe2+<-> Fe3+) образуется метгемоглобин. Окислителями железа гема могут быть различные продукты метаболизма-активные формы кислорода (АФК), ферменты, альдегиды и др. В норме за сутки образуется 2,5% метгемоглобина, а обнаруживается в крови 1,5%. Метгемоглобинредуктазная система восстанавливает метгемоглобин, переводя его в восстановленную форму, возвращая тем самым способность транспортировать кислород. К экзогенным метгемоглобинообразователям относятся нитриты, нитраты, присутствующие в избыточном количестве в воде, в пище, ряд лекарственных препаратов. Гемоглобин, образуя комплексные соединения с различными сульфопроизводными, образует сульфметгемоглобин. У здоровых людей это производное гемоглобина в крови не содержится. Обнаружение его свидетельствует о повышенном содержании сульфопроизводных в воде, пище, воздухе. В связи с этим сульфгемоглобин является своеобразным маркером экологической обстановки.
Диагностическое значение имеет определение содержания гликозилированных (гликированных) гемоглобинов, образующихся в результате комплексирования гемоглобина с различными углеводородами. 95% от общего количества гликозилированных гемоглобинов приходится на долю гемоглобина A1c, образующегося в результате комплексирования гемоглобина и глюкозы.
Повышение содержания гликозилированных гемоглобинов наблюдается при сахарном диабете.
Определение гликозилированных гемоглобинов производится как для диагностики при массовых обследованиях населения, так и для контроля за соблюдением диеты у больных с сахарным диабетом, при подборе дозы инсулина и контроле за эффективностью лечения.
Содержание гликозилированного гемоглобина (Hb A1c) у здоровых находится в пределах 3-6% от общего гемоглобина или (0,55±0,09) мг фруктозы на 1 мг гемоглобина.
Аномальные гемоглобины
Наличие в эритроцитах людей аномальных или патологических гемоглобинов определяет состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии. Это наследственные аномалии кроветворения, при которых молекулы патологических гемоглобинов имеют измененную структуру, поэтому подобные заболевания относятся к группе так называемых молекулярных болезней.
В настоящее время установлено более 200 аномальных гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О, Р, Q и других, а также возможные их комбинации (SC, SD и др.).
Гемоглобин S
Отличается от гемоглобина А строением четвертого пептида, в котором на шестом месте вместо глутаминовой кислоты находится электрически нейтральный валин. Гемоглобин S мало растворим, нейтрален по заряду, электрофоретически менее подвижен. В капиллярах при отдаче кислорода гемоглобин S выпадает в осадок в форме веретенообразных кристаллоидов (тактоидов), которые растягивают оболочку и ведут к распаду эритроцитов. У гетерозиготов содержание гемоглобина S равняется 20 – 45 %, у гомозиготов – 60 – 90 %. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии.
Гемоглобин F
Характерный для крови плода фетальный гемоглобин может быть обнаружен в повышенных количествах в эритроцитах крови недоношенных детей, при коклюше, серповидноклеточной анемии, талассемии, врожденной микроцитарной анемии, пернициозной анемии, острых и хронических лейкозах, миеломной болезни. Наибольшее содержание (до 97 %) наблюдается при большой талассемии.
Гемоглобин С
Отличается строением четвертого пептида молекулы гемоглобина, в котором на шестом месте вместо глутаминовой кислоты находится лизин. Центр распространения гена С – северная часть Ганы. Частота гетерозиготности по данным одних авторов, до 15 %, по данным других, – 16,5 – 28 %, среди негров США – 1,8 – 3% на Ямайке – 2,7 % (В. П. Эфроимсон). Наличие гена С в гомозиготном состоянии ведет к развитию выраженной спленомегалии, умеренной микроцитарной анемии с наличием эритроцитов мишеневидной формы. При наличии комбинации гемоглобинов С и S анемия оказывается более тяжелой.
Гемоглобин D
Обнаружен у 2 % берберов Марокко и у 0,4 % негров США. У гомозиготов наблюдается микроцитоз, слабый анизо- и пойкилоцитоз и мишеневидность эритроцитов. Описано несколько гемоглобинов D (в северо-западной Индии, среди сикхов в Индии, на острове Кипр, в Турции).
Гемоглобин Е
Обнаружен у жителей Юго-Восточной Азии: в Кампучии, Таиланде, Бирме, Бенгалии, у веддов Шри-Ланки, в северо-восточной Малайе, у населения Калимантана и Сулавеси. Частота распространения гена С в разных местностях колеблется от 1 – 3 до 13 (Таиланд) – 20 (Бирма) – 28 – 37 % (Кампучия). У гомозиготов ЕЕ наблюдается микроцитоз, компенсированный развитием эритроцитоза (до 7 – 8 x 1012 /л). Отмечены комбинации генов ES и ЕТ, дающие сублетальный эффект. Клинические проявления при других гемоглобинозах выражены слабо, а распространение более ограниченное (гены G, I, J, К, L, M, N, О, Р, Q).
Серповидно-клеточная анемия – это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение – так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа), за что эта форма гемоглобинопатии и получила название серповидно-клеточной анемии.
Серповидно-клеточная анемия весьма распространена в регионах мира, эндемичных по малярии, причем больные серповидно-клеточной анемией обладают повышенной (хотя и не абсолютной) врожденной устойчивостью к заражению различными штаммами малярийного плазмодия. Серповидные эритроциты этих больных также не поддаются заражению малярийным плазмодием в пробирке.
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к
профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные
корректировки и доработки. Узнайте стоимость своей работы.
6. Хромопротеиды. Гемоглобин.
Хромопротеины состоят из простого белка
и связанного с ним окрашенного небелкового
компонента, откуда и произошло их
название (от греч. chroma – краска). Среди
хромопротеинов различают гемопротеины,
(содержащие в качестве простетической
группы железо), магний-.порфирины и
флавопротеины (содержащие производные
изоаллоксазина). Хромопротеины наделены
рядом уникальных биологических функций
они участвуют в таких фундаментальных
процессах жизнедеятельности, так
фотосинтез, дыхание клеток и целостного
организма, транспорт кислорода и
углерода, окислительно-восстановительные
реакции, свето- и цветовосприятие и др.
Таким образом, хромопротеины играют
исключительно важную роль в процессах
жизнедеятельности Достаточно, например,
подавить дыхательную функцию гемоглобина
путем введения оксида углерода или
утилизацию (потребление) кислорода в
тканях путем введения синильной кислоты
или ее солей (цианидов) ингибирующих
ферментные системы клеточного дыхания,
как моментально наступает смерть
организма. Хромопротеины являются
непременными и активными участниками
аккумулирования солнечной энергии в
зеленых
Гемопротеины. К группе гемопротеинов
относятся гемоглобин и его производные,
миоглобин, хлорофиллсодержащие белки
и ферменты (вся цитохромная система,
каталаза и пероксидаза) Все они содержат
в качестве небелкового компонента
структурно сходные железо (или
магний)-порфирины, но различные по
составу и структуре белки обеспечивая
тем самым разнообразие их биологических
функций. Рассмотрим более подробно
химическое строение гемоглобина,
наиболее важного для жизнедеятельности
человека и животных соединения.
Гемоглобин это гемопротеид. Это
неферментный белок имеющий интересную
структуру. В его состав входит 4
полипептидные цепи. Есть несколько
видов гемоглобина: гемоглобин А, есть
и фетальный гемоглобин, в состав которого
входят несколько иные цепи. Миоглобин
похожий по структуре белок – мышечный
белок, который в отличие от гемоглобина
состоит из 1 полипептидной цепи и 1-го
гема. Имеет значимость в доставке
кислорода внутри клетки до митохондрий.
Гем: Это очень устойчивая структура,
практически это самая длинная замкнутая
сопряженная система, которая образует
порфириновое ядро, состоящее из 4
пиррольных колец соединенных метинильными
мостиками. Кроме того здесь имеются
боковые цепи
Железо связано с пиррольными ядрами,
и за счет координационных связей
оно связано еще и с азотом
имидозольных ядер гистидина
полипептидных цепей. Обеспечивается
связывание кислорода и образование
оксигемоглобина. Соединение в
котором железо 3 валентно –
метгемоглобин, образуется при
действии сильных окислителей
(лаки, анилиновые краски). В крови
всегда присутствует метгемоглобин
не выше 2%. Метгемоглобин –
производное гемоглобина не способен
транспортировать кислород. Восстановление
гемоглобина происходит за счет
фермента -метгебоглобинредуктазы. У
детей этот фермент крайне неактивен. В
боковой цепи содержится 4 метильные
группы , 2 винильных и 2 остатка пропионовой
кислоты.
Болезни гемоглобинов (их насчитывают
более 200) называют гемоглобинозами.
Принято делить их на гемоглобинопатии,
в основе развития которых лежит
наследственное изменение структуры
какой-либо цепи нормального гемоглобина
(часто их относят также к «молекулярным
болезням»), и талассемии, обусловленные
нарушением синтеза какой-либо нормальной
цепи гемоглобина. Различают, также
железодефицитные анемии.
Классическим примером наследственной
гемоглобинопатии является
ссрповидно-клеточная анемия. При этой
патологии эритроциты в условиях низкого
парциального давления кислорода
принимают форму серпа. Гемоглобин S.
Отличается по ряду свойств от нормального
гемоглобина, в частности, после отдачи
кислорода в тканях он превращается в
плохо растворимую форму и начинает
выпадать в осадок в виде веретенообразных
кристаллоидов, названных тактоидами.
Последние деформируют клетку и приводят
к массивному гемолиз Химический дефект
сводится к замене единственной
аминокислоты, а именно глутаминовой, в
6-м положении с N-конца на валин в β-цепях
молекулы гемоглобина HbS. Это результат
мутации в молекуле ДНК, кодирующей
синтез β-цепи гемоглобина Талассемии,
строго говоря, не являются гемоглобинопатиями.
Это генетически обусловленное нарушение
синтеза одной из нормальных цепей
гемоглобина. Если угнетается синтез
β-цепей, то развивается β-талассемия,
при генетическом дефекте синтеза α-цепей
развивается α-талассемия.
Гемоглобин.
Мужчины 135-180гр/л Женщины 120-16Огр/л
Изменение числа эритроцитов.
Повышение числа Э и их массы
(гематокрит) в целом указывает на
эритроцитоз, который может быть первичным
(поражение эритропоэза, заболевания
ситемы крови) или вторичным. Вторичный
эритроцитоз чаще наблюдается при
легочных заболеваниях, врожденных
пороках сердца, при гиповентиляции,
пребывании на высоте, накоплении
карбоксигемоглобина при курении,
молекулярных изменениях гемоглобина,
нарушении выработки эритропоэтина
вследствие образования опухоли или
кисты. Относительное повышение Э
определяется при гемоконцентрации,
например, при ожогах, диарее, приеме
диуретиков и т. д. Понижение НЬ и Э
является прямым непосредственным
указанием на анемию (малокровие). Острая
кровопотеря по одного литра принципиально
не влияет на морфологию Э. Если в
отсутствие кровопотери число Э снижается,
то, естественно, следует предположить
нарушение эффективности эритропоэза.
Эффективный (действительный) эритропоэз
может быть оценен с помощью следуюших
тестов: определения уровня утилизации
железа Э, определения количества
ретикулоцитов и скорости их созревания,
измерения продолжительности жизни
эритроцитов и других функциональных
характеристик, определяющих их
полноценность.
Соседние файлы в папке 1-30
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Сложные белки – протеиды
Как уже было отмечено, сложные белки состоят из белковой части и небелковой – простетической группы, которая может быть представлена различными соединениями. Название протеидов зависит от названия простетической группы. К сложным белкам относятся: нуклеопротеиды, небелковая часть которых представлена нуклеиновыми кислотами; хромопротеиды – сложные белки, простетическая группа которых является окрашенным соединением, фосфопротеиды, имеющие в своем составе остатки фосфорных кислот; липопротеиды и глюкопротеиды Простетическими группами последних являются соответственно жиры и углеводы.
Нуклеопротеиды
Значение этого класса протеидов трудно переоценить, потому что они входят во все клетки организма и выполняют основные жизненные функции – являются носителями генетической информации и участвуют в биосинтезе белка. Белковая часть нуклеопротеидов представлена в основном протаминами и гистонами. Небелковая часть – это рибо- и дезоксирибонуклеиновые кислоты. Строение нуклеопротеидов представлено на следующей схеме:
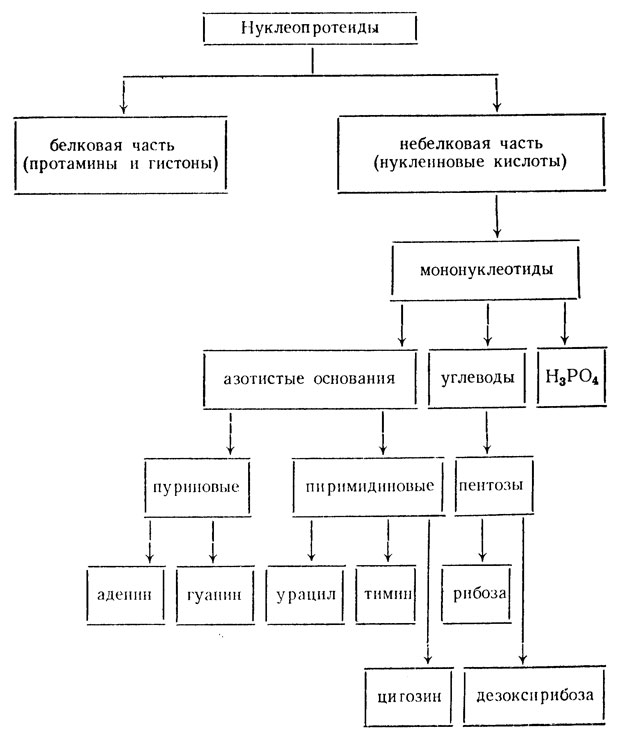
Схема 1
Нуклеопротеиды – это соединения с высоким молекулярным весом – от 25 000 до 1 000 000 и выше, состоящие из огромного числа мономеров – мононуклеотидов. Последние состоят из азотистых оснований, пентоз и остатка фосфорной кислоты.
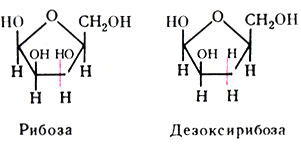
Из пентоз в мононуклеотидах представлены рибоза и дезоксирибоза:
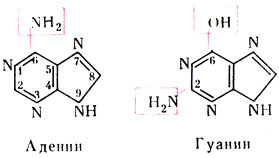
Азотистые основания являются производными пуринов или пиримидинов.
К пуриновым основаниям относятся аденин – 6-амино-пурин и гуанин – 2-амино-6-оксипурин.
Из пиримидиновых оснований в нуклеиновые кислоты входят урацил – 2,6-диоксипиримидин, тимин – 5-метилурацил и цитозин – 2-окси-6-аминопиримидин.
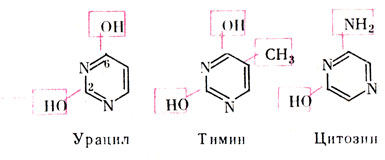
Эти соединения могут находиться как в кетонной, так и в энольной формах. В составе нуклеиновых кислот пиримидиновые основания представлены только кетонной формой.
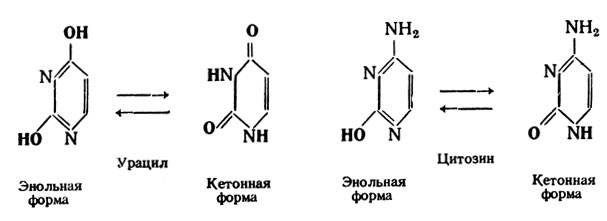
Таким образом, мононуклеотид имеет следующую структуру:
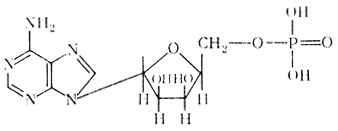
Адениловая кислота (аденозинмонофосфорная кислота)
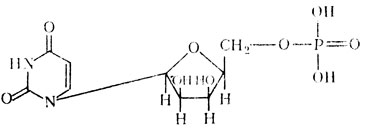
Уридиловая кислота (урицинмонофосфорная кислота)
Мононуклеотиды могут содержать в своем составе 1, 2 или 3 остатка фосфорной кислоты. Например, аденозинмоно-, ди- и трифосфорные кислоты, которые обозначаются как АМФ, АДФ, АТФ.
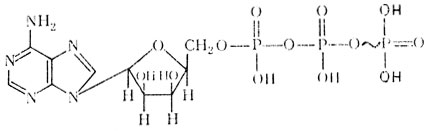
Аденозинтрифосфорная кислота (АТФ)
Трифосфорные кислоты этих азотистых оснований играют в организме очень большую роль, так как они являются гак называемыми макроэргическими соединениями – соединениями, богатыми энергией. Как установлено, в молекуле макроэргических соединений, например АТФ, энергия сосредоточена в химической связи между третьим остатком фосфорной кислоты и остальной частью молекулы АТФ. Эта связь называется макроэргической связью и обозначается значком ~. При распаде АТФ на АДФ и Н3РО4 выделяется энергия, которая была заключена в этой связи, примерно 8-10 ккал. Соответственно этому для синтеза АТФ, кроме АДФ и фосфорной кислоты, необходимо аналогичное количество энергии. Механизм действия других макроэргических соединений одинаков с рассмотренным
Мононуклеотиды, входящие в состав нуклеиновых кислот, соединяются между собой по типу “3-5 связи”. Это означает, что соединение происходит путем образования эфирных связей между остатком фосфорной кислоты и двумя гидроксилами: одним, находящимся у 3-го углеродного атома пентозы одного мононуклеотида, и другим, расположенным у 5-го углеродного атома пентозы последующего мононуклеотида. Соединенные таким путем мононуклеотиды характеризуют первичную структуру нуклеиновых кислот.
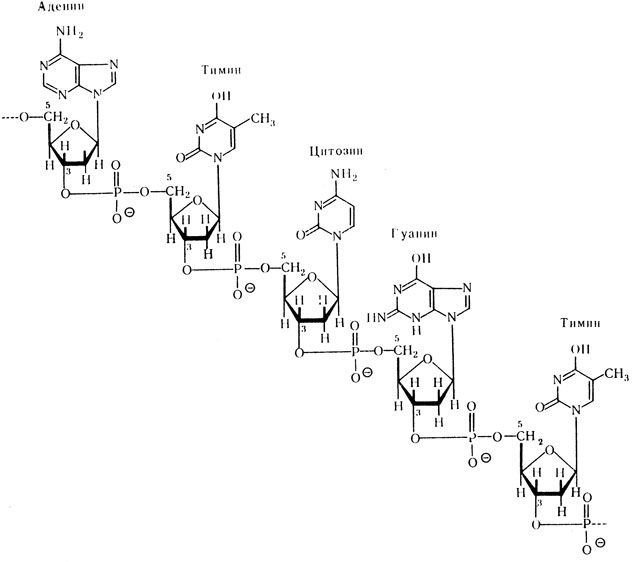
Первичная структура ДНК
В зависимости от входящего в их состав углевода – рибозы или дезоксирибозы нуклеиновые кислоты подразделяются на рибонуклеиновые и дезоксирибонуклеиновые кислоты, или, сокращенно, РНК и ДНК. Они различаются по структуре, месту нахождения и функциям.
ДНК в основном сосредоточена в ядре (и ядрышке) клетки. Ее главная функция заключается в том, что она является носителем наследственности. Генетические особенности каждого индивидуума заключены в определенной последовательности азотистых оснований, входящих в состав первичной структуры ДНК (см. Биосинтез белка).
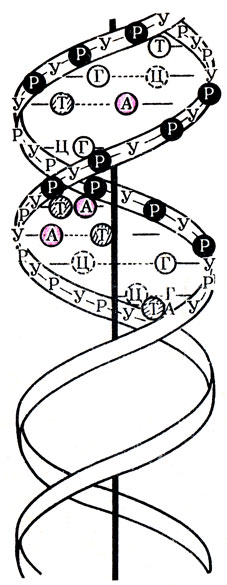
Рис. 17. Вторичная структура ДНК (двойная спираль). У – углевод (дезоксирибоза); Р – остаток фосфорной кислоты; А, Т, Г, Ц – азотистые основания
Структура ДНК имеет свои особенности. Это относится в первую очередь к азотистым основаниям. Установлено, что в молекуле ДНК встречаются следующие основания: аденин, гуанин, тимин и цитозин, которые часто обозначаются первыми буквами – А, Г, Т и Ц. При дальнейшем изучении структуры ДНК оказалось, что ее вторичная структура представляет собой двутяжную антипараллельную спираль. Схематично это напоминает винтовую лестницу (рис. 17), перила которой образованы пентозами, соединенными фосфоэфирными связями по типу “3-5 связи”, а ступени – парами азотистых оснований, которые соединены между собой водородными связями. Между аденином и тимином образуются две связи, а при соединении гуанина и цитозинатри. Работами С. Очоа, Э. Чаргаффа и других были установлены определенные взаимоотношения между азотистыми основаниями, входящими в состав ДНК Они заключаются в том, что во вторичной структуре ДНК определенное пуриновое основание всегда соединяется только с вполне определенным пиримидиновым основанием. Так, аденин соединяется только с тимином, а гуанин с цитозином (или А Т и Г Ц). В основе такого соединения лежит принцип комплементарнобти дополнения (рис. 18). На рис. 17 представлен участок вторичной структуры ДНК, на котором обо значены типы связей: “3-5 связь” между отдельными мононуклеотидами и водородные связи между азотистыми основаниями.
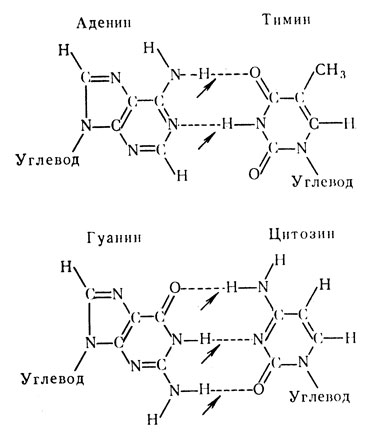
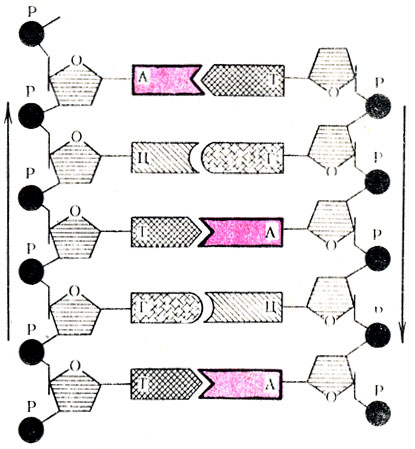
Рис. 18. Двойная нить ДНК
Еще одной особенностью вторичной структуры ДНК является противоположное расположение двух цепей мононуклеотидов. На рис. 19 стрелками указано антипараллельное направление этих цепей. Рассмотренная модель вторичной структуры ДНК была впервые предложена Дж. Уотсоном и Ф. Криком.
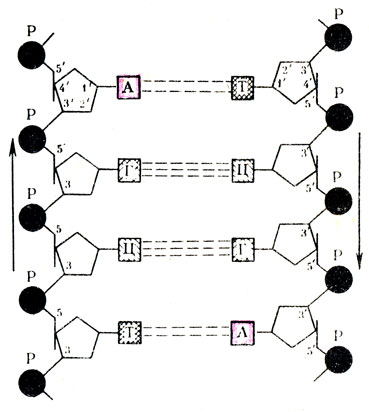
Рис. 19. Схема водородной и фосфоэфирных связей на участке вторичной структуры молекулы ДНК
Третичная структура ДНК – это расположенная в пространстве двутяжная антипараллельная спираль.
РНК обнаружена почти во всех субклеточных фракциях. Наибольшее ее количество (60-80%) сосредоточено в рибосомах, а оставшаяся часть распределена в цитоплазме и ядрышке. РНК представлена 3 видами: информационная (и-РНК), транспортная (т-РНК) и рибосомная (р-РНК), каждая из которых характеризуется специфическими свойствами и функциями. и-РНК, или матричная, является основой (матрицей) для биосинтеза белка. На и-РНК закодированы генетические особенности данного вида белка определенного органа или ткани. и-РНК строится на ДНК и, следовательно, комплементарно повторяет особенности ее структуры. т-РНК переносит активированные аминокислоты к местам биосинтеза белка – рибосомам, которые в основном построены из рибосомальной РНК (р-РНК).
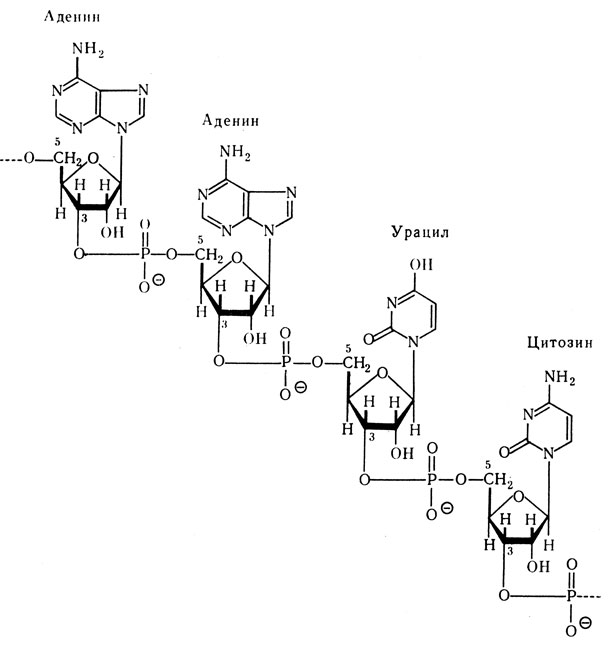
Первичная структура РНК
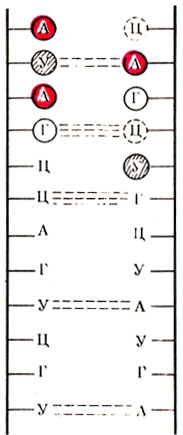
Рис. 20. Схема водородных связей на участке вторичной структуры молекулы РНК
В составе РНК обнаружены фосфорная кислота, из углеводов – рибоза вместо дезоксирибозы в ДНК и азотистые основания – аденин, гуанин, цитозин и урацил (в ДНК – тимин) – А, Г, Ц и У. Первичная структура РНК одинакова с первичной структурой ДНК и представляет собой последовательное соединение мононуклеотидов при помощи фосфоэфирных связей. Вторичная структура РНК представляет собой участки первичной структуры, перекрученные между собой в виде спирали, которые удерживаются за счет водородных связей, образованных между азотистыми основаниями по принципу комплементарное, т. е. А – У и Г – Ц. Таким образом, существует различие с ДНК, где вместо тимина к аденину присоединяется урацил (рис. 20), Третичная структура РНК – это пространственное расположение всей молекулы РНК (рис. 21).
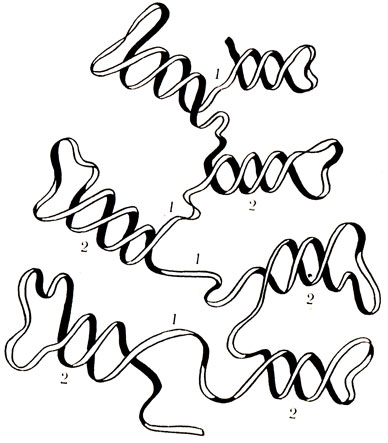
Рис. 21. Участок третичной структуры молекулы РНК. 1 – участки первичной структуры, 2 – участки вторичной структуры
Хромопротеиды
Небелковая часть этих сложных белков представлена окрашенными соединениями Представителями хромопротеидов в животном организме являются гемоглобин и миоглобин, а в растительных клетках – хлорофилл. К группе хромопротеидов относятся некоторые ферменты, например каталаза и пероксидаза крови. Приоритет в изучении химической природы красящего вещества гемоглобина принадлежит М. В. Ненцкому. Гемоглобин состоит из белка основного характера – глобина и небелковой части – гема, в составе которого имеется атом двухвалентного железа. В молекуле гемоглобина обнаружено 4 гема.
Гемоглобин (Нb) в организме может находиться в разных формах. Оксигемоглобин – НbO2 – характеризует важнейшую биологическую функцию гемоглобина – снабжение клеток организма кислородом. Присоединение кислорода к гемоглобину происходит за счет специфических (координационных) связей с железом. При этом окисления железа не происходит и оно остается двухвалентным. Такая связь является весьма непрочной и легко разрывается при изменении парциального давления. Присоединение кислорода к гемоглобину происходит в легких, откуда кровью НbO2 разносится ко всем органам и тканям, где кислород освобождается и используется клетками. Гемоглобин же присоединяет к себе один из конечных продуктов обмена веществ, в клетках – углекислый газ – и транспортирует его к легким. Здесь СO2 отщепляется и выводится из организма при дыхании. Освободившийся гемоглобин вновь присоединяет кислород и процесс транспорта газа повторяется.
Соединение гемоглобина с угарным газом – СО называется карбоксигемоглобином – НbСО. НbСО образуется при отравлении организма угарным газом и намного прочнее связывается с гемоглобином, чем кислород, и выключает таким образом гемоглобин из транспорта кислорода. Соответственно к органам и тканям поступает меньше кислорода, в результате чего возникает кислородное голодание, а снижение поступления кислорода к мозгу приводит к потере сознания.
При окислении гемоглобина окислителями валентность железа изменяется и оно становится трехвалентным, а гемоглобин превращается в метгемоглобин – HbOH.
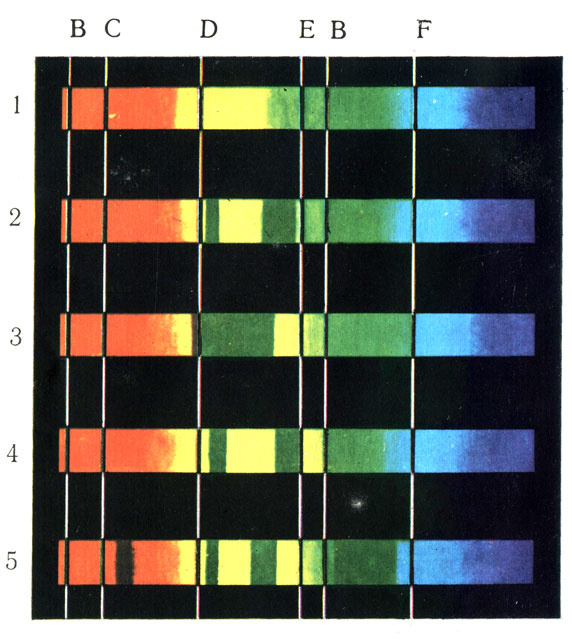
Рис. 22. Спектры поглощения. 1 – солнечный спектр; 2 – оксигемоглобин; 3 – гемоглобин; 4 – карбоксигемоглобин; 5 – метгемоглобин
Одним из методов распознавания производных гемоглобина является исследование их спектров поглощения. Как установлено, при прохождении луча белого света через призму он разлагается на ряд цветных лучей, видимых на экране, от красного до фиолетового, что дает известную картину спектра, как, например, радуга. Если на пути луча между источником света и призмой поместить раствор с веществом, способным к поглощению луча с определенной длиной волны, то в определенных местах должны появиться темные, неосвещенные участки. Такой спектр называется спектром поглощения (рис. 22). Сам гемоглобин (рис. 22, 3) дает одну широкую темную полосу между линиями D и Е. НbО2 (рис. 22, 2) в этих же границах дает две темные линии, и НbCO (4) и НbОН (5) показывают свои специфические спектры поглощения.
Миоглобин – хромопротеид мышц – дыхательный пигмент мышц. Особенностью миоглобина является его более легкая способность присоединять кислород и значительно труднее по сравнению с гемоглобином его отдавать. Миоглобин создает запасы кислорода в мышцах, количество которого может достигать 14% всего кислорода организма. Это имеет важное значение, особенно для деятельности мышцы сердца. В мышцах морских животных (тюлень, морж, кашалот) высокое содержание миоглобина позволяет им длительное время находиться под водой, несмотря на отсутствие жабер.
Глюкопротеиды
Это сложные белки, простетическая группа которых представлена производными углеводов, среди которых встречаются аминосахара, гексуроновые кислоты и др. В составе отдельных глюкопротеидов обнаружены остатки серной и уксусной кислот Глюкопротеиды составляют основу муцинов – слизистых веществ, которые встречаются в большом количестве в секретах желудочно-кишечного тракта, подчелюстной слюнной железы.
Фосфопротеиды
Соединения этого класса сложных белков характеризуются наличием фосфорной кислоты. Представителями являются казеиноген молока, вителлин – белок, выделенный из желтков яиц, ихтулин – белок рыбьей икры и др. Фосфопротеиды являются питательным материалом для растущих организмов.
Липопротеиды
Липопротеиды представляют собой комплексные соединения белка и различных жиров (холестерина, нейтрального жира, фосфолипидов и др.). У растворимых липопротеидов белковая часть расположена на поверхности молекулы. В организме различные их фракции, например α- и β-липопротеиды, обнаружены в составе плазмы крови, нервной ткани, а также в яичном желтке, молоке.
Одной из основных функций липопротеидов является транспорт жира.
Концентрация липопротеидов в сыворотке крови меняется при отдельных заболеваниях, поэтому их определение имеет диагностическое значение, как, например; при атеросклерозе, когда увеличено содержание β-липопротеидов.
