Гемотрансфузионная терапия при анемиях
- Первая помощь и интенсивная терапия, реанимация
- Анестезиология
- Клиническая трансфузиология
Накопленный нами опыт применения трансфузионно-инфузионной терапии при заболеваниях внутренних органов позволяет обобщить его в виде основных рекомендаций.
Показаниями к трансфузиям эритроцитной массы являются тяжелые анемические состояния при заболеваниях печени, почек, легких, сердца, желудочно-кишечного тракта, при неэффективности или непереносимости препаратов железа у больных железодефицитными анемиями. В отдельных случаях при наличии таких дополнительных факторов, как кровопотеря, острая инфекция или побочное действие лекарственных средств, анемия может прогрессировать.
Преимуществами эритроцитной массы является то, что она содержит большое количество жизнеспособных эритроцитов в минимальном объеме плазмы, отличается низким содержанием количества натрия, калия, аммиака и цитрата, продуктов распада, белковых антигенов и антител. При переливании эритроцитной массы уменьшается опасность посттрансфузионных реакций, связанных с сенсибилизацией к плазменным белкам. Эритроцитная масса отличается более «мягким» по сравнению с цельной кровью влиянием на функциональное состояние печени. Она оказывает благоприятное влияние на систему свертывания крови. Трансфузии эритроцитной массы при анемиях обеспечивают быстрое восстановление содержания эритроцитов и гемоглобина в периферической крови, что приводит к улучшению окислительных процессов, купированию гипоксии. При каждом переливании эритроцитной массы в том же объеме трансфузионной среды вводится вдвое большее количество эритроцитов, чем при трансфузии цельной крови.
Назначение переливания эритроцитной массы больным с хронической анемией должно осуществляться по строгим клиническим показаниям с учетом уровня гемоглобина, числа эритроцитов и гематокрита. Трансфузии, как правило, следует проводить при содержании гемоглобина ниже 70 г/л и показателе гематокрита ниже 0,3 л/л.
Величины гемоглобина и гематокрита важны, но их часто переоценивают как критерии для трансфузии, в отличие от клинических проявлений анемии. Большое значение имеет общее состояние больных анемией, проявление симптомов гипоксии, степень гемодинамических расстройств.
Трансфузии эритроцитов показаны при наличии выраженного дефицита эритроцитов, острого или хронического, что приводит к ухудшению снабжения тканей кислородом. Толерантность больных к анемии значительно варьирует. Например, больные с сердечно-сосудистой, легочной недостаточностью, цереброваскулярными заболеваниями тяжело переносят анемию. Анемия, длительно текущая, легче переносится больными, чем быстро развившаяся. Активные пациенты с выраженной анемией нуждаются в более высоком уровне емоглобина, чем лица, ведущие спокойный образ жизни. Поэтому решение эпроса о трансфузионной терапии должно индивидуализироваться в зависи- ости от специфических особенностей больных. Трансфузионная терапия мо- • ет являться вспомогательным методом, главным является лечение основного заболевания. Показания к компонентной гемотерапии, дозы трансфузионных средств, количество трансфузий, интервалы между ними определяются в каждом конкретном случае индивидуально.
Изучение механизма действия трансфузий эритроцитной массы дало возможность разработать дифференцированные показания к ее рациональному использованию. Лечебный эффект могут дать только эритроциты, сохранившие функциональную полноценность. Перелитые эритроциты восполняют их недостаток у больного и усиливают основную их функцию — перенос и отдачу гемоглобином кислорода тканям и органам, устраняют гипоксию на клеточном, тканевом и органном уровнях и восстанавливают нарушенные в результате анемизации функции органов и тканей. Таким образом, при введении эритроцитов лечебный эффект не ограничивается только увеличением кислородной емкости крови. Трансфузии эритроцитов оказывают также влияние на :lt;ислотно-щелочное состояние крови, белковый обмен, транспорт аминокис- ют, гемокоагуляцию. Все это и определило целесообразность применения эритроцитной массы при анемиях.
Источник: А.Г.Румянцев, В.А.Аграненко, «Клиническая трансфузиология» 1997
А так же в разделе «ГЕМОТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ ЗАБОЛЕВАНИЯХ ВНУТРЕННИХ ОРГАНОВ »
- ОБЩИЕ ПРИНЦИПЫ
- ТАКТИКА ГЕМОТРАНСФУЗИОННОЙ ТЕРАПИИ В ПРЕДТРАНСПЛАНТАЦИОННОМ ПЕРИОДЕ
- Тактика при апластической анемии
- Тактика при гемобластозах
- ТАКТИКА ГЕМОТРАНСФУЗИОННОЙ ТЕРАПИИ В ПОСТГРАНСПЛАНТАЦИОННОМ ПЕРИОДЕ
- Глава IX ГЕМОТРАНСФУЗИОННАЯ ТЕРАПИЯ ПРИ ЗАБОЛЕВАНИЯХ ВНУТРЕННИХ ОРГАНОВ И СИСТЕМЫ КРОВИ
- I Железодефицитные анемии
- Заболевания легких
- Заболевания сердечно-сосудистой системы
- Заболевания желудочно-кишечного тракта
- Заболевания печени
- Заболевания почек
- Ревматические болезни
- Злокачественные опухоли
- Инфекционные заболевания
Осложнения серповидно-клеточной анемии. Гемотрансфузионная терапия при серповидно-клеточной анемии
Острый грудной синдром характеризуется болью в груди, одышкой, гипоксемией, лихорадкой и обусловлен появлением в микрососудах легких серповидных эритроцитов. В этих случаях часто неверно диагностируется пневмония. Такое состояние угрожает жизни больных и является показанием для проведения заменных трансфузий и постоянного мониторинга.
Увеличенная селезенка обычно к 5 годам уменьшается вследствие фиброза из-за частых инфарктов (так называемая «аутоспленэктомия»). У пациентов с аутоспленэктомией в эритроцитах обнаруживаются тельца Жолли, выявляются мишеневидные клетки и акантоциты.
Увеличена печень: хроническая гепатомегалия с дальнейшим развитием фиброзной ткани в зонах некроза и переходом гепатопатии в цирроз.
У мужчин (у 50 % больных с СКА) наблюдается приапизм, продолжающийся несколько часов из-за застоя крови в пещеристых телах. Предрасполагающими факторами являются инфекции, половой акт, мастурбация, местная травма.
У женщин отмечается более позднее наступление менструаций, часто встречаются самопроизвольные аборты и преждевременные роды, беременность сопровождается нарушением мозгового кровообращения, сердечной недостаточностью. При исследовании глазного дна характерно выявление жировых эмболии в сосудах сетчатки.
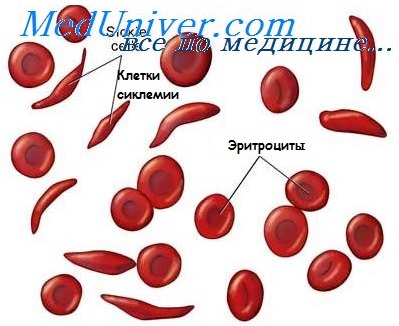
Нередко на фоне инфекций (пневмония, корь и др.) возникают тяжело протекающие гемолитические кризы. Отмечается озноб, повышение температуры, гемоглобинурия, прогрессирующая анемия. Появляется иктеричность склер, видимых слизистых и кожных покровов, повышается непрямой билирубин в крови, уробилин в моче и стеркобилин в кале.
Вследствие укорочения жизни эритроцитов больные очень чувствительны к транзиторной супрессии костного мозга, вызванной инфекцией (парвовирус В19, пневмококк, сальмонелла, вирус Эпштейн—Бара и др.). Описаны случаи возникновения так называемых апластических кризов, когда во время инфекции или сразу после нее происходит разрушение эритро-кариоцитов в костном мозге, исчезают ретикулоциты, уменьшается количество нейтрофилов и тромбоцитов. Возможно появление признаков сердечной недостаточности. Заканчивается апластический криз спонтанно через 10—14 дней с повышением количества ретикулоцитов и уровня гемоглобина. Такая картина была описана при инфицировании парвовирусом.
Таким образом, в клинике серповидно-клеточной анемии доминируют гемолитические и сосудисто-тромботические (вазоокклюзивные) кризы. Реже встречаются апластические и секвестрационные кризы (у детей в возрасте от 5 месяцев до 2 лет), которые связаны с внезапным удалением (без разрушения) и депонированием значительного количества эритроцитов в печени и селезенке, что вызывает резкую слабость, снижение количества эритроцитов и гемоглобина без признаков гемолиза. Может развиться коллапс.
Повторяющиеся моменты сосудистой окклюзии и хронический гемолиз ведут к прогрессирующей дисфункции практически всех органов. Одним из первых нарушений функции почек является гипостенурия — неспособность концентрировать мочу, поэтому больные с СКА очень чувствительны к дегидратации.
Гемотрансфузионная терапия при серповидно-клеточной анемии
В трансфузионной терапии при СКА необходимо выделить несколько режимов ее проведения: неотложные переливания крови, заменные и постоянные переливания.
Неотложные трансфузии осуществляются при секвестрационном и апластическом кризах, тяжелой анемии и кровопотерях и имеют целью увеличение транспортной функции крови без выраженного снижения уровня HbS. Постоянные трансфузии могут быть как простыми, так и заменными (обменными). В первом случае достигается уменьшение количества HbS ниже 35 %, во втором — нормализация уровней гемоглобина S и гематокрита.
– Также рекомендуем “Обменные трансфузии при серповидно-клеточной анемии. Особенности обменных трансфузий”
Оглавление темы “Трансфузионная терапия гемолитической болезни”:
1. Гемолитические анемии. Клиника гемолитических анемий
2. Гемолитический криз. Наследственный дефицит фермента Г-6-ФД
3. Гемолитический криз при фавизме. Лечение гемолитического криза при дефиците Г-6-ФД
4. Серповидно-клеточная анемия. Диагностика серповидно-клеточной анемии
5. Осложнения серповидно-клеточной анемии. Гемотрансфузионная терапия при серповидно-клеточной анемии
6. Обменные трансфузии при серповидно-клеточной анемии. Особенности обменных трансфузий
7. Метод ручного обменного переливания. Хирургические осложнения серповидно-клеточных анемий
8. Гемолитическая болезнь новорожденных. Причины гемолитической болезни новорожденных
9. Диагностика гемолитической болезни новорожденных. Лечение гемолитической болезни новорожденных
10. Плазмаферез при гемолитической болезни новорожденных. Гемотрансфузионные реакции и осложнения
Медицина / Патология / Патология (статья)
Анемия при гемобластозах
Статья |
10-11-2018, 15:10
|
 АнемияАнемия – частое осложнение у больных гемобластозами. В основе развития анемического синдрома (см статью «Анемия. Общие положения. Классификация») у пациентов с гемобластозом лежат несколько механизмов. При поражении костного мозга возможно вытеснение эритроидного пула злокачественными клетками. Образование красных клеток крови также угнетает длительная и интенсивная полихимиотерапия. Часто в развитии анемии играют роль механизмы, свойственные анемии при хронических заболеваниях (см статью «Анемия хронических заболеваний»): нарушение усвоения железа в кишечнике и его высвобождение макрофагами, уменьшение синтеза эритропоэтина, повышение количества провоспалительных и противовоспалительных цитокинов.
АнемияАнемия – частое осложнение у больных гемобластозами. В основе развития анемического синдрома (см статью «Анемия. Общие положения. Классификация») у пациентов с гемобластозом лежат несколько механизмов. При поражении костного мозга возможно вытеснение эритроидного пула злокачественными клетками. Образование красных клеток крови также угнетает длительная и интенсивная полихимиотерапия. Часто в развитии анемии играют роль механизмы, свойственные анемии при хронических заболеваниях (см статью «Анемия хронических заболеваний»): нарушение усвоения железа в кишечнике и его высвобождение макрофагами, уменьшение синтеза эритропоэтина, повышение количества провоспалительных и противовоспалительных цитокинов.
Врач-гематолог должен понимать, что у больных с гемобластозом патогенез анемии многокомпонентный и сложный. Нельзя исключать вовлечение патогенетических механизмов всех трех групп анемий: дефицитной анемии, анемии хронических заболеваний и гематологической анемии (см статью «Анемия. Общие положения. Классификация»). Кроме этого, частые и длительные госпитализации больных с гематологической патологией, необходимость мониторинга лечения и необходимый в этих случаях частый забор небольшого количество крови с целью диагностики и прогноза вызывают ятрогенный дефицит железа. Следует учитывать, что прием лекарственных препаратов может вызывать дефицит витаминов B9 и B12.
Коррекция анемии в гематологическом отделении
Традиционный способ коррекции анемии в отделениях гематологии – гемотрансфузия (отмытые эритроциты, эритроцитарная масса). В некоторых группах пациентов с гематологической патологией применение эритропоэз-стимулирующих агентов (ЭСА) может быть под вопросом. То есть, перед назначением ЭСА-терапии необходимо определить группы больных, которым это лечение противопоказано. В первую очередь, это больные с хроническим лейкозом миелоидной направленности: эссенциальная полицитемия и тромбоцитопения, хронический миелолейкоз). В данном случае противопоказания к ЭСА-терапии связаны с тем, что клетки эритроидного ряда и предшественники миелопоэза довольно близки и обладают похожим рецепторным аппаратом. Теоретически эритропоэз-стимулирующие агенты способны стимулировать патологический клон указанных заболеваний. Но эта гипотеза не подтверждена ни экспериментально, ни клинически.
В какой-то мере теория о схожести рецепторного аппарата клеток-предшественников эритроидного ростка со злокачественным клоном может применяться к острым лейкемиям. Кроме этого, больные с острой лейкемией, как правило, получают массивную полихимиотерапию с резко выраженным ингибирующим действием на все ростки гемопоэза (см статью «Эритропоэз: Гемоглобин и Эритроциты»), поэтому возможна ситуация, когда для эритропоэз-стимулирующих агентов отсутствуют клетки-мишени. Некоторые специалисты установили относительную эффективность ЭСА-терапии даже у больных, подверженных аутологичной трансплантации периферических стволовых клеток (с злокачественной лимфомой и множественной миеломой).
Довольно противоречивой остается ситуация использования ЭСА у пациентов с миелодиспластическим синдромом. Конечно, в этом случае применима приведенная выше теория о схожести рецепторного аппарата клеток предшественников эритропоэза и клеток опухолевого клона. Но, как и при острой лейкемии, ни экспериментально, ни клинически влияние эритропоэз-стимулирующих агентов на злокачественный клон клеток не подтверждено, а те данные которые имеются на данный момент – неполные и спорные. Также надо отметить, что анемия (дефицит эритроцитов и гемоглобина) – основной фактор, вызывающий страдания этой группы пациентов. Поэтому регулярно осуществляются попытки использования ЭСА-терапии у пациентов с миелодиспластическим синдромом, несмотря на то, что успех наблюдается не всегда. Известные нам данные показывают, что успешное применение ЭСА у таких больных отмечается примерно у 20-40%.
Самые лучшие результаты применения ЭСА-терапии получены у больных с рефрактерной анемией и с рефрактерной анемией с избытком кольцевидных сидеробластов (ответ на терапию наблюдался у 44% больных). Самые плохие результаты ответа на ЭСА-терапию получены у пациентов с формами миелодиспластического синдрома, сопровождающегося бластозом. Таким больным не рекомендуется назначать ЭСА-терапию, как и больным с цитогенетическими аномалиями. При этом попытка назначения эритропоэз-стимулирующих агентов больным с рефракторной анемией при избытке кольцевидных сидеробластов, несомненно, оправдана, поскольку в случае ответа на терапию решаются основные проблемы пациента (такие больные, как правило, ничем не страдают, кроме анемического синдрома). Если же ответ на ЭСА-терапию получить не удается, больному назначают гемотрансфузию.
Миелодиспластический синдром – единственная патологическая группа, где перед назначением эритропоэз-стимулирующих агентов нужно определять уровень эндогенного эритропоэтина. Если уровень эндогенного эритропоэтина превышает значение 500 МЕ/мл, ЭСА не назначают.
Целевая группа больных с гематологической патологией для назначения эритропоэз-стимулирующих агентов – пациенты с множественной миеломой и лимфомами (как Ходжкина, так и неходжкинскими лимфомами). Если причиной развития анемии в этих случаях не являются гемолиз, дефицит железа, фолиевой кислоты или цианокобаламина, ЭСА-терапия успешна более чем у 50% больных. Если же анемия возникла по причине указанных дефицитных состояний, это состояние легко устраняется. С дозировками и режимами введения эритропоэз-стимулирующих агентов можно ознакомиться в статьях «Анемия хронических заболеваний», «Анемия при раке», «Анемия при хронической болезни почек» (эти рекомендации успешно применяются в гематологической практике). Среди ЭСА-препаратов наиболее популярным является Альфа-эпоэтин (Эральфон, Бинокрит, Гемакс, Эмавейл). Оптимальный режим назначения этого препарата сегодня является 12 000 МЕ 3 раза в неделю или 20 000 – 40 000 МЕ 1-2 раза в неделю, что позволяет эффективно контролировать лечение и достигать быстрого эффекта от терапии.
Гемозаместительная терапия назначается всем больным, которым нельзя назначать ЭСА-терапию или если она оказалась неэффективной. В этом случае нельзя забывать о гемотрансмиссивных инфекциях (вирус гепатита, ВИЧ и др), а также учитывать вероятность возникновения трансфузионных реакций. Отметим, что длительные гемотрансфузии вызывают переизбыток железа в организме, что может представлять серьезную опасность для разных органов и систем. Так, из 420 мл донорской крови получают примерно 250 мл эритроцитарной массы, в которой содержится около 200 мг железа. После трансфузии железо высвобождается из донорских эритроцитов макрофагами ретикулоэндотелиальной системы и продолжает рециркулировать в организме реципиента. В итоге, после, например, 20 гемотрансфузий уровень железа в организме реципиента повышается как минимум в 2 раза. Лишнее железо, не участвующее в процессе эритропоэза, доставляется трансферрином в клетки печени, где хранится длительное время. Регулярные гемотрансфузии в конечном итоге переполняют емкости трансферрина и гепатоцитов, в результате в крови появляется несвязанное с трансферрином железо, которое откладывается в тканях органов, не предназначенных для депонирования железа (поджелудочная железа, сердце и др). Отметим, что накопление железа в поджелудочной железе может вызвать панкреатит и сахарный диабет, в сердце – токсическую кардиомиопатию, которая характеризуется нарушениями сократительной способности сердца, аритмиями и др). К другим клиническим последствиям посттрансфузионной перегрузки железом относят цирроз или фиброз печени и эндокринопатии.
Для диагностики посттрансфузионной перегрузки железом применяют следующие критерии:
1. Лабораторные показатели:
- Устойчивое повышение содержания ферритина в крови (более 1000 мкг/л) при отсутствии явного деструктивного, воспалительного или злокачественного процесса
- Низкое содержание трансферрина в крови и снижение общей железосвязывающей способности крови
- Высокий коэффициент насыщения трансферрина железом (> 60%)
- Усиленная экскреция железа через почки с мочой («десфераловый тест», индуцированный Дефероксамином (Десферал), или спонтанная экскреция)
2. Биохимические и морфологические показатели:
- Увеличение количества сидеробластов в костном мозге
- Повышенное отложение гемосидерина в тканях
- Увеличение концентрации железа в печени (> 3-7 мг/г сухого веса; норма – 0,17-1,8 мг/г сухого веса)
3. Радиологические критерии:
- МРТ печени и сердца при использовании специальной программы позволяет обнаружить накопления железа на доклинической стадии
Больным, которым регулярно проводят гемотрансфузию, назначается хелаторная терапия (Деферазирокс или Эксиджад) для связывания и элиминации железа.
Хелаторная терапия гемотрансфузионно-зависимым пациентам проводится до момента прекращения трансфузий и/или пока остается клиническая значимость перегрузкой железа. Отметим, что хелаторная терапия в большинстве случаев переносится хорошо. Из возможных побочных эффектов можно выделить расстройства желудочно-кишечного тракта, высыпания на коже, незначительное повышение уровня креатинина в крови. Иногда при назначении высоких доз Дефарозирокса наблюдается устойчивое повышение уровня креатинина в крови. В этом случае пациент нуждается в коррекции дозировки хелатора.
Пациенты, которые ожидают аллогенную трансплантацию гемопоэтических клеток, получают хелаторную терапию до момента трансплантации.
