Гены гемоглобина и их экспрессия
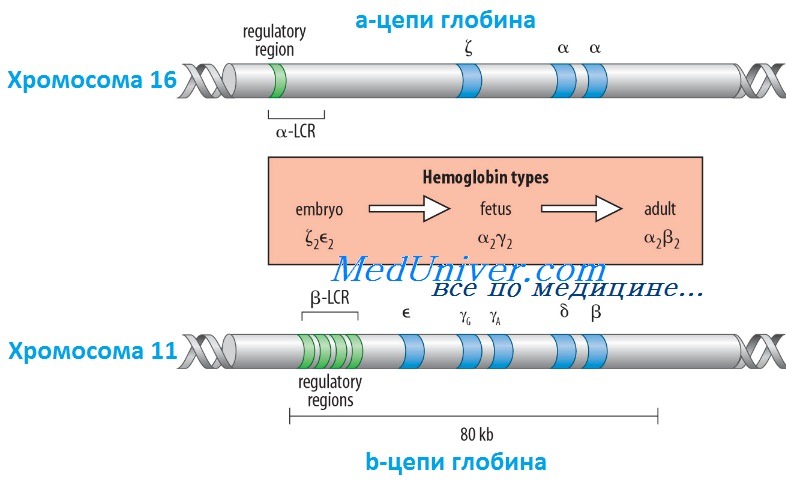
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
- Авторы
- Файлы
Кривенцев Ю.А.
Никулина Д.М.
Бисалиева Р.А.
Борисова Н.В.
Бисалиев Р.В.
Гемоглобины человека изучаются уже на протяжении почти века, но, тем не менее, эмбриональный гемоглобин (HbP, синоним – HbE) является одним из самых малоизученных белков человеческого организма. Сведения о HbP в научной литературе до сих пор крайне скудны. Такой парадоксально низкий интерес ученых к этому белку можно объяснить следующими причинами: а) методологический фактор: получение препарата HbP крайне затруднительно из-за сложностей получения биоматериала (HbP синтезируется только в раннем эмбриогенезе, с 5 по 18 гестации), экстрагирования и очистки белка; б) практический фактор: по мнению большинства клиницистов, данный белок не представляет прикладной (диагностическо-прогностической) ценности, т.к. активность его гена полностью репрессирована как у детей, так и у взрослых [1, 2, 3, 6].
В данной работе авторы исходили из предположения, что активация ε-гена HbP в постнатальном периоде жизни человека возможна при патологии, связанной с понижением степени дифференцировки, т.н. «омоложением» клеток эритроцитарного ростка [4]. К таким состояниям можно отнести некоторые онкологические заболевания тканей красного костного мозга, в первую очередь, эритремии, сублейкемические миелозы, а также, возможно, некоторые миелолейкозы.
Цель исследования – иммунохимический качественный анализ наличия эмбрионального гемоглобина в эритроцитах больных эритромами, сублейкемическими миелозами и лейкозами различных типов.
В процессе научно-экспериментального исследования физико-химических свойств эмбрионального гемоглобина авторами разработан оптимальный алгоритм выделения этого белка [4].
Исходным биоматериалом для выделения и очистки HbP служил абортивный материал сроком 7-9 недель (отделение неонатологии больницы №5 г. Астрахани). После промывки и сортировки эмбриональные ткани подвергались механически-термической гомогенизации. После экстрагирования цитозольных белков проводили, взвесь центрифугировали при 8000 g в течение 30 мин, после чего осадок отбрасывали. Поскольку устойчивость эмбрионального гемоглобина несколько ниже, чем у фетального [6], для очистки HbP нами была модифицирована стандартная методика щелочной денатурации для выделения фетального гемоглобина [3, 6], состоящая в 40-секундной обработке смеси 1,2 М раствором NaOH, с последовательным осаждением белков раствором сульфата аммония (до 50%-й насыщенности). После центрифугирования при 8000 об/мин в течение 30 мин осадок отделяли. В надосадочной жидкости оставался эмбриональный гемоглобин с незначительным количеством белковых примесей. Полученный белковый препарат подвергали обессоливанию путем гель-проникающей хроматографии на колонке с сефадексом G-25, рабочий буфер – 0,05 М фосфатный буферный раствор рН 7,4. Окончательную очистку HbP от оставшихся щелочеустойчивых компонентов в полученном на предыдущем этапе препарате проводили путем ионообменной хроматографии на ДЕАЕ-сефадексе G-50 на 0,01 М трис-хлоридном буфере рН 8,1 в градиенте ионной силы.
Анализ чистоты полученных препаратов осуществляли методом вертикального электрофореза в полиакриламидном геле.
Полученные очищенные препараты HbP использовали, в частности, для получения специфических антисывороток на данный белок методом иммунизации кроликов. Иммунизация проводилась с полным адьювантом Фрейнда по стандартной методике [5]. Для контроля качества антисывороток проводили их иммунохимическое сопоставление с другими антигенными композитами, а также специфическую окраску полученных преципитатов бензидиновым методом [6]. При наличии дополнительных линий преципитации проводили дробное истощение антисыворотки соответствующей белковой фракцией. В результате проведенной работы разработаны специфические иммунохимические тест-системы на эмбриональный гемоглобин, в которой тест-антигеном является очищенный препарат HbР (полученный вышеописанным способом) в рабочем разведении: 1/2 или экстракт тканей эмбриона (срок – 6-9 недель) в рабочем разведении 1/8-1/16. Тест-системы на использовали для иммунохимической индикации HbP в исследуемом материале.
Объектом нашего исследования являлась гепаринизированная кровь больных некоторыми гематологическими онкозаболеваниями. Всего было обследовано 107 образцов крови. Из них: 12 больных эритромами, 11 больных сублейкемическими миелозами, 31 больных острыми и хроническими миелолейкозами, 17 больных острыми и хроническими лимфолейкозами, а также 36 образцов крови здоровых людей (группа контроля) (табл.1).
Сбор биоматериала проводили в гематологическом отделении 1-й областной больницы г. Астрахань.
Подготовка проб к анализу состояла в их предварительном гемолизе путем двухкратного замораживания (при -180С) и оттаивания.
Таблица 1 Перечень использованного в работе материала
Исследуемый материал (кровь) | Количество проб |
Здоровые | 36 |
Больные эритремиями | 12 |
Больные сублейкемическими миелозами | 11 |
Больные хроническими миелолейкозами | 22 |
Больные острыми миелолейкозами | 9 |
Больные острыми и хроническими лимфолейкозами | 17 |
ВСЕГО | 107 |
Индикация HbP в образцах осуществлялась путем иммунодиффузии по Оучтерлони [5]. В ходе работы использовались моновалентные иммунохимические тест-системы на HbP (см. выше).
После иммунопроявления агаровые стекла высушивали и подвергали специфическому окрашиванию на гемоглобины гваяколовым методом, модифицированным авторами: 0,2 г гваякола в 50 мл ледяной уксусной кислоты, затем добавляли этот раствор в 0,1М ацетатный буфер рН 4,6 с 0,2% хлоридом марганца (II) до 0,3% концентрации. Туда же добавляли перекись водорода до концентрации 1%. Экспозиция 45 мин. В результате окраски гемоглобиновые преципитаты приобретали голубой цвет.
Стекла фотографировали в отраженно-рассеянном свете. Считывание результатов проводили только по отчетливым окрашенным линиям преципитации.
Статистическая обработка результатов проводилась с использованием статистических компьютерных программ.
В результате проведенного иммунохимического анализа исследуемого материала на эмбриональный гемоглобин методом радиальной иммунодиффузии по Оухтерлони получены следующие результаты (табл. 2).
Как видно из приведенных данных, эмбриональный гемоглобин впервые выявлен в крови больных эритремиями, хроническими эритромиелозами, сублейкемическими миелозами и острыми миелолейкозами. Эти данные свидетельствуют о возможности дерепрессии гена ε-протомера (гена эмбрионального гемоглобина) при снижении дифференцировки клеток эритроцитарного ростка, сопровождающей онкологические заболевания данной ткани. Нулевая выявляемость HbP в крови гематологических больных с онкопатологией неэритроидного генеза (острые и хронические лимфолейкозы) согласуется с приведенной версией.
Таблица 2 Результаты иммунохимической индикации HbP в крови онко-гематологических больных
Исследуемый материал | Количество проб | Количество положительных результатов на HbP | Процент положительных результатов на HbP |
Здоровые | 36 | 0,0 | |
Больные эритремиями | 12 | 8 | 66,67 |
Больные сублейкеми-ческими миелозами | 11 | 4 | 36,36 |
Больные хроническими миелолейкозами | 22 | 1 | 4,55 |
Больные острыми миелолейкозами | 9 | 2 | 22,22 |
Больные острыми и хроническими лимфолейкозами | 17 | 0,0 |
Таким образом, полученные результаты свидетельствуют о том, что иммунохимическая индикация эмбрионального гемоглобина в крови гематологических больных способствует повышению качества дифференциальной диагностики ряда онко-гематологических заболеваний.
СПИСОК ЛИТЕРАТУРЫ:
- Гипоксия. Адаптация, патогенез, клиника. – СПб, ООО “ЭЛБИ-СПб”, 2000. – 384 с.
- Зайчик А.Ш., Чурилов Л.П. Основы патохимии – СПб. «Элби-СПб». – 2000. – 182 с.
- Карпищенко А.И. – Медицинские лабораторные технологии и диагностика / А.И. Карпищенко. – Справочник, т 1, С. Петербург, 1998. – 144 с.
- Кривенцев Ю.А., Бисалиева Р.А., Никулина Д.М., Краморенко П.В., Семенова Т.Б. – Иммунохимический анализ продукции эмбрионального гемоглобина в раннем эмбриогенезе человека / Материалы научно-практической конференции с международным участием «Достижения фундаментальных наук в решении актуальных проблем медицины». – Астрахань-Волгоград-Москва. – 2006. – С.58-62.
- Никулина Д.М. – Практическое освоение иммунохимических методов / Метод. рекомендации. – Астрахань, – 1996. – 36 с.
- Стародуб Н.Ф., Назаренко В.И. – Гетерогенная система гемоглобина: структура, свойства, синтез, биологическая роль / АН УССР, Институт молекулярной биологии и генетики. Киев: Наукова думка, 1987. – 198 с.
Библиографическая ссылка
Кривенцев Ю.А., Никулина Д.М., Бисалиева Р.А., Борисова Н.В., Бисалиев Р.В. ЭКСПРЕССИЯ ε-ГЕНА ЭМБРИОНАЛЬНОГО ГЕМОГЛОБИНА ПРИ ГЕМАТОЛОГИЧЕСКОЙ ПАТОЛОГИИ // Успехи современного естествознания. – 2007. – № 1. – С. 72-74;
URL: https://natural-sciences.ru/ru/article/view?id=10865 (дата обращения: 22.08.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Молекулы гемоглобина- тетрамеры , содержащие по 2 пары гемоглобиновых цепей различного типа.
В ходе развития организма наблюдают образование различных вариантов Нв в зависимости от экспрессии разных глобиновых типов.
Различают:
1. Эмбриональный Нb – состоит из 2ζ(дзета) цепей и 2 ε(эпсилон)
2. Фетальный Нb – состоит из 2α(альфа) и 2γ (гамма)
3. Нb взрослых – состоит из 2α(альфа) и 2 β(бетта)
В течении 2 месяца беременности снижается синтез ζ и ε цепей, а усиливается синтез α и γ.- образуется фетальный гемоглобин.
На 3 месяце беременности активируются гены β и δ (дельта) цепей глобина, тогда как концентрация γ падает, это переключение ускоряется и фетальный гемоглобин заменяется на взрослый.
Преобладающим типом гемоглобина является гемоглобинА (α2β2), α и β цепи различаются по многим аминокислотным остаткам.
У всех взрослых помимо Нв-А, еще и Нв-А2 (α2δ2), характерная для А2 δ цепь отличается от β цепи только по 10 аминокислотным остаткам.
Около 1% фетального Нв может присутствовать и во взрослом организме.
γ цепь значительно отличается от α и β и обладает бОльшим сродством к кислороду, так как плод получает кислород через плаценту(но там содержание не высокое), поэтому фетальный Нв содержит γ цепь.
Известно 2 типа γ цепей:
1) С аланином
2) С глицерином в 136 положении.
Ζ цепи похожи по аминокислотному составу на α , а ε цепей на β.
Синтез γ цепей у эмбриона происходит в печени, селезенке и костном мозге.
Синтез β цепей происходит в костном мозге.
Все глобиновые цепи имеют общее эволюционное развитие, возникают в последствии дупликации генов и их дальнейшей модификации. Синтез небелковых гемогрупп также кодируется генами(т к они кодируют структуру ферментов обеспечивающих биосинтез гемма).
Глобиновые гены распологаются в 11 и 16 хромосомах. И образуют α и β подобные кластеры.
Α подобные кластеры располагаются в коротком плече 16 хромосомы, а β подобные кластеры в коротком плече 11 хромосомы
Структурные гены расположены в порядке от 5’ к 3’ концу.
Все глобиновые гены имеют по 3 экзона(информативные участки) и 2 интрона (неинформативные участки),интроны транскрибируются вместе с экзонами, поэтому они есть в первичном транскрипте.
Процессинг- созревание первичного транскрипта( интрены вырезаются, экзона сшиваются).
Гемоглобинопатии – это группа патологических состояний, обусловленные нарушениями структуры цепей глобина (заменой одной или нескольких аминокислот в цепи глобина, отсутствие участка цепи или ее удлинением.)
Существуют четыре основных типа болезней гемоглобина:
1. Гемолитические анемии, вызванные нестабильностью гемоглобина.
2. Метгемоглобинемии, обусловленные ускоренным окислением гемоглобина.
3. Эритроцитоз, вызванный нарушением сродства гемоглобина к кислороду.
4. Серповидно-клеточные нарушения как следствие повреждений клеточных мембран эритроцитов.
Гемолитические анемии. Они вызываются нестабильными формами гемоглобина. В большинстве случаев мутация затрагивает β-цепь. У многих нестабильных гемоглобинов в полипептидной цепи обнаруживаются аминокислотные замены или делеции в участках связывания гема. Нестабильность может быть едва заметной, что не имеет никаких клинических последствий, до выраженной нестабильности, при которой происходит интенсивное разрушение эритроцитов. Нестабильность часто обусловлена преждевременной диссоциацией гема и глобиновых цепей. Точный диагноз может быть затруднен, особенно если не наблюдается изменений электрофоретической подвижности. В таком случае необходимо выделение глобиновых цепей для дальнейшего анализа в специализированных лабораториях.
Метгемоглобинемия, обусловлена ускоренным окислением двухвалентного железа до трехвалентного. Больные с мутацией в α–цепи, вызывающими образование HbМ, страдают цианозом от рождения. При мутации в β-цепи цианоз развивается только через 6 месяцев после рождения, когда происходи замена γ–цепи на β-цепь.
Эритроцитоз, вызванный образованием гемоглобинов с нарушенным сродством к кислороду. Существует около 30 гемоглобинов с повышенным сродством к кислороду.
Повышенное сродство к кислороду приводит к уменьшению количества кислорода, освобождающегося из комплекса с гемом в тканях организма, и вызывает гипоксию. Гипоксия ведет к выделению гормона эритропоэтина, стимулирующего образование эритроцитов и собственно эритроцитоз.
Было обнаружено всего три гемоглобина с уменьшенным сродством к кислороду. При таком дефекте количество кислорода, поступающее в ткани, увеличивается, поэтому следует ожидать уменьшение синтеза эритропоэтина. В двух случаях, как и следовало ожидать, наблюдалась слабовыраженная анемия.
Серповидно-клеточная анемия — это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение — так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа).
Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных с серповидноклеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Больные серповидноклеточной анемией обладают повышенной (хотя и не абсолютной) врождённой устойчивостью к заражению различными штаммами малярийного плазмодия.
Симптомы серповидноклеточной анемии делятся на две основные категории. Из-за хрупкости красных клеток крови всегда наблюдается анемия, которая может привести к потере сознания, делает больного физически менее выносливым и может вызвать желтуху (связанную с чрезмерным распадом гемоглобина).
