Химиотерапия при апластической анемии
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри – физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом – выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О2 и СО2), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, – резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов – причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда – аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Низкая работоспособность;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Бледность кожи;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Дефицит тромбоцитов;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
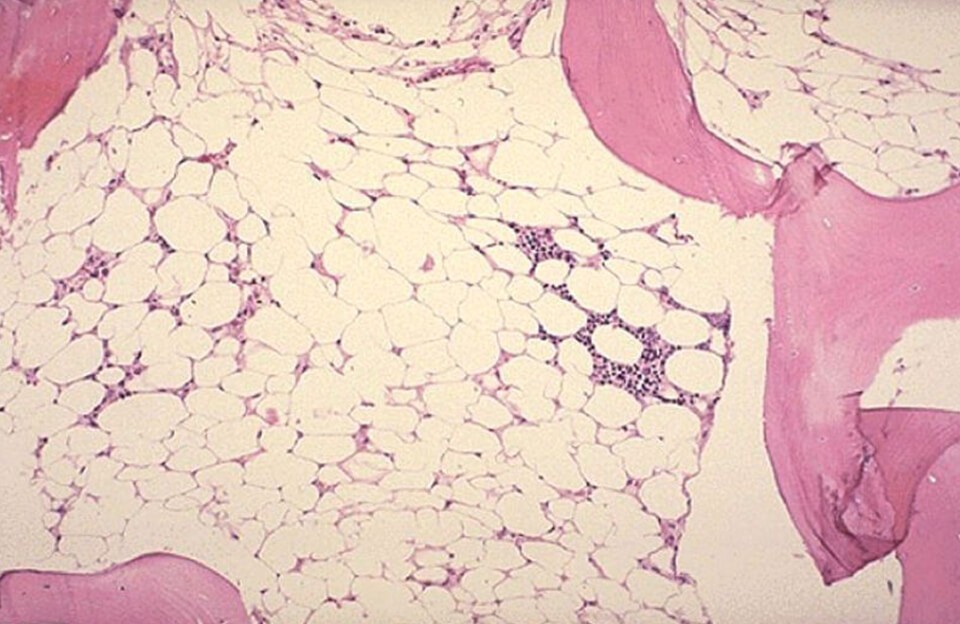
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – < 0,5х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – < 0,2х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение – это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности – избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет – 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
Апластическая анемия – это состояние, при котором организм перестает вырабатывать достаточное количество новых кровяных телец.
Апластическая анемия вызывает у больных слабость и утомляемость, а также делает их очень подверженными инфекциям и кровотечениям.
Апластическая анемия, редкое и серьезное состояние, может возникнуть в любом возрасте.
Апластическая анемия может развиться внезапно, но может прогрессировать медленно, месяцами ухудшая состояние больного. Современное лечение апластической анемии включает переливания крови, лекарственные препараты и трансплантацию костного мозга.
Причины апластической анемии
Апластическая анемия возникает при повреждении костного мозга, которое приводит к замедлению или полному прекращению выработки клеток крови. Костный мозг представляет собой красное губчатое вещество внутри костей, которое постоянно вырабатывает новые клетки крови – эритроциты, лейкоциты, тромбоциты. При апластической анемии больной костный мозг описывают терминами «апластический» или «гипопластический», что означает либо полное отсутствие в нем молодых кровяных телец, либо очень малое их количество.
Факторы, которые временно или необратимо нарушают кроветворную функцию костного мозга, включают:
• Радиоактивное облучение. Человек может стать жертвой радиации как в результате аварий на атомных объектах, так и в результате медицинского облучения – например, при лечении рака.
• Химиотерапия при раке. Воздействие многих химиотерапевтических препаратов плохо сказывается не только на раковых клетках, но и на других интенсивно делящихся клетках организма.
• Токсичные вещества. Воздействие токсинов из окружающей среды, таких как инсектициды, пестициды, лабораторные реактивы, может пагубно повлиять на костный мозг. При этом больному иногда становится лучше, если воздействие химикатов прекратится.
• Некоторые лекарства. Препараты для лечения ревматоидного артрита, некоторые антибиотики могут вызывать апластическую анемию. Данный побочный эффект обязательно должен быть указан в инструкции к препарату.
• Аутоиммунные заболевания. Это большая группа заболеваний, при которых иммунная система организма ошибочно атакует клетки хозяина. Жертвами иммунитета могут стать и клетки костного мозга.
• Вирусная инфекция. Некоторые вирусы играют роль в развитии апластической анемии. Последние исследования позволяют причислить к таким опасным организмам вирус Эпштейна-Барр, цитомегаловирус (ЦМВ), парвовирус В19 и вирус иммунодефицита человека (ВИЧ).
• Беременность. Апластическая анемия, которая возникает при беременности, может быть связана с аутоиммунной проблемой – иммунная система беременной иногда ошибочно атакует костный мозг.
• Неизвестные факторы. Во многих случаях врачи не могут установить точную причину апластической анемии. Тогда говорят о так называемой идиопатической апластической анемии.
Апластическую анемию не стоит путать с миелодиспластическим синдромом.
Это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При миелодиспластическом синдроме костный мозг иногда характеризуют как «гиперпластический» – это означает, что в нем содержится много кровяных телец. Но у некоторых больных с этим синдромом костный мозг почти пуст, поэтому болезнь иногда путают с апластической анемией.
Апластическая анемия связана с некоторыми другими заболеваниями. У части больных с апластической анемией имеется другая редкая болезнь – пароксизмальная ночная гемоглобинурия. Эта болезнь характеризуется слишком быстрым разрушением эритроцитов.
Анемия Фанкони – это редкая, наследственная болезнь, которая приводит к апластической анемии. Дети с болезнью Фанкони могут иметь различные врожденные дефекты, такие как недоразвитие конечностей. Болезнь диагностируется при помощи генетического анализа.
Факторы риска апластической анемии
Апластическая анемия встречается редко.
Факторы риска включают:
• Лучевая или химиотерапия рака в прошлом.
• Воздействие токсичных веществ на производстве и в быту.
• Использование рецептурных препаратов, таких как хлорамфеникол (Левомицетин) и некоторые средства против ревматоидного артрита.
• Некоторые заболевания кроветворной системы.
• Тяжелые инфекционные заболевания.
• Аутоиммунные процессы.
• Беременность (редко).
Симптомы апластической анемии
Признаки болезни появляются в результате снижения количества тех или иных кровяных телец.
Признаки апластической анемии могут быть следующими:
• Слабость.
• Одышка при напряжении.
• Быстрое или нерегулярное сердцебиение.
• Бледность кожных покровов.
• Частые и тяжелые инфекции.
• Склонность к появлению синяков.
• Кровотечения из десен и носа.
• Длительные кровотечения после порезов.
• Кожная сыпь.
• Головокружение.
• Головные боли.
Апластическая анемия может прогрессировать медленно, неделями и месяцами. Болезнь может быть короткой и проходящей, а может стать хронической. Апластическая анемия требует серьезного отношения, потому что в тяжелых случаях она заканчивается фатально.
Диагностика апластической анемии
Для диагностики этого заболевания врач может назначить следующее:
• Анализы крови. В крови здорового человека уровень эритроцитов, лейкоцитов и тромбоцитов находится в определенных пределах. Эти пределы могут варьировать в зависимости от возраста, пола, расы и других особенностей организма. Но если в анализах обнаружится очень низкий уровень всех трех классов клеток крови, то врач заподозрит апластическую анемию.
• Биопсия костного мозга. Для подтверждения диагноза больному придется пройти болезненную, но необходимую процедуру биопсии. Во время биопсии врач введет специальную иглу в одну из костей и возьмет образец костного мозга. Клетки костного мозга изучат под микроскопом, чтобы увидеть признаки апластической анемии или других заболеваний. При апластической анемии костный мозг будет содержать мало кровяных клеток.
После того, как подтвердится апластическая анемия, врачи назначат дополнительные обследования, чтобы выяснить причину болезни. Это может быть длительный и сложный процесс.
Лечение апластической анемии
Лечение апластической анемии в легких случаях может состоять в простом наблюдении за пациентом. При более тяжелой форме болезни могут применяться переливания крови, трансплантация костного мозга и специальные препараты, которые стимулируют кроветворение. Тяжелая апластическая анемия угрожает жизни человека и требует обязательной госпитализации.
1. Переливание крови.
При низком уровне тромбоцитов или эритроцитов больным переливают донорскую кровь. Это не вылечит апластическую анемию, но поможет контролировать ее симптомы, восполняя кровяные клетки, которые не вырабатывает больной костный мозг. Для переливания могут использовать отдельную массу, состоящую из эритроцитов или тромбоцитов – в зависимости от потребностей больного.
Обычно нет ограничения количества переливаний для одного больного. Но у такой процедуры могут быть осложнения. Переливаемые кровяные тельца содержат железо, которое высвобождается при их разрушении и накапливается в теле. При многократном переливании в организме откладываются большие запасы железа, которые повреждают жизненно важные органы, если не назначить специальные препараты для его выведения.
Другое осложнение заключается в том, что организм может вырабатывать антитела к переливаемым клетках. А это сделает лечение менее эффективным.
2. Пересадка костного мозга.
Пересадка стволовых клеток, чтобы «перезапустить» костный мозг больного – это иногда единственный способ успешного лечения апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является методом выбора для больных молодого возраста, имеющих подходящего донора. Чаще всего подходящим донором выступает брат или сестра.
Если донор найден, то костный мозг больного сначала истощают высокими дозами радиации или химиотерапией. Далее здоровые стволовые клетки донора фильтруют из его крови, после чего вводят их в кровоток больного. Клетки сами мигрируют в полости костей и начинают там вырабатывать кровяные тельца, как это предусмотрено природой. Но вся процедура очень сложная, дорогостоящая и требует длительного пребывания в больнице. После трансплантации больной должен получать лекарства для профилактики отторжения донорских клеток.
Трансплантация влечет за собой риски. Есть вероятность, что организм начнет отторгать трансплантат. Эта реакция может быть фатальной для реципиента. Кроме того, не каждому больному удается найти донора, который совместим по всем параметрам.
3. Лечение иммуносупрессорами.
Больные с аутоиммунными заболеваниями, которые повредили костный мозг, нуждаются в лечении иммуносупрессорами – препаратами, подавляющими иммунитет.
Препарат циклоспорин (Генграф, Неорал) и антитимоцитарный глобулин (Тимоглобулин) могут использоваться в качестве примера. Эти лекарства подавляют активность иммунных клеток, которые атакуют костный мозг. Лечение помогает восстановить костный мозг и повысить уровень клеток крови. Два названных выше препарата нередко используют в комбинации.
Кортикостероидные гормоны, такие как метилпреднизолон (Солу-Медрол, Медрол, Метипред), также назначают для подавления иммунитета, иногда наряду с другими лекарствами.
Иммуносупрессоры могут быть очень эффективными при апластической анемии. Обратной стороной медали является то, что подавление иммунитета приводит к риску инфекций. Кроме того, есть возможность, что после отмены лекарств апластическая анемия вернется.
4. Стимуляторы костного мозга.
Некоторые препараты помогают усилить кроветворение в костном мозге. Среди них колониестимулирующие факторы, такие как сарграмостин (Лейкин), филграстим (Нейпоген), пегфилграстим (Нейласта) и эпоэтин-альфа (Прокрит, Эпоген). Эти препараты разработаны относительно недавно, их получение является очень дорогим и трудоемким процессом, поэтому стоимость препаратов для среднестатистического больного просто фантастическая. Колониестимулирующие факторы нередко назначают наряду с иммуносупрессорами.
5. Антибиотики и противовирусные средства.
Апластическая анемия сопровождается понижением уровня лейкоцитов и ослаблением иммунной защиты организма. Это делает организм больного очень восприимчивым к различным бактериальным, вирусным и грибковым инфекциям.
При первых признаках инфекций, таких как жар, следует сразу же обращаться к врачу. У человека с ослабленным иммунитетом мало шансов на то, что банальная простуда пройдет «просто так». Безобидная для других людей инфекция может стать опасной для жизни, поэтому врач будет использовать антибиотики, противовирусные и другие препараты для лечения и профилактики.
6. Другие варианты лечения.
Апластическая анемия, вызванная радиацией или химиотерапией рака, обычно улучшается после отмены лечения. То же самое касается многих лекарств и токсинов, которые поражают костный мозг.
Беременные женщины с апластической анемией получают переливания крови, потому что другие способы лечения нанесут непоправимый вред ребенку. У многих беременных апластическая анемия проходит сама по себе вскоре после родов. Если этого не произошло, требуется дальнейшее лечение.
Советы для больных апластической анемией:
• Отдыхайте, когда вам это нужно. Анемия может вызвать утомляемость и одышку, даже при незначительной нагрузке. Делайте перерывы в работе, если вы устали, берегите свои силы.
• Избегайте контактных видов спорта. Из-за высокого риска кровотечений, связанных с тромбоцитопенией, контактный спорт может вызвать проблемы. Незначительный порез, синяк, падение – и кровь будет трудно остановить.
• Защитите себя от микробов. Вы можете уменьшить риск инфекций, если будете чаще мыть руки, избегать больных людей и соблюдать правила гигиены. При первых незначительных признаках инфекции немедленно обращайтесь к врачу.
Профилактика болезни
Как ни прискорбно, но до сих пор не существует эффективных способов профилактики апластической анемии. Тем не менее, вы можете избегать инсектицидов, органических растворителей и других токсинов для уменьшения риска.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
