Как вылечить рефрактерные анемию

Заболевания крови составляют многочисленную и разнообразную группу синдромов, формирующихся при нарушениях качественного и количественного состава крови. Все они систематизируются, исходя из поражения какого-либо компонента крови. Гематологические заболевания делят на три основные группы:
- патологии, характеризующиеся снижением уровня гемоглобина;
- гемобластозы;
- гемостазиопатии.
Рефрактерная анемия – одна из разновидностей малокровия, отличающаяся нарушением созревания клеток красного ростка.
Миелодиспластический синдром – это что?
Группу заболеваний и состояний с нарушением процесса образования эритроцитов, моноцитов, тромбоцитов, гранулоцитов в миелоидной ткани (миелоидное кроветворение) с высокой вероятностью развития опухолевого поражения кроветворной системы в медицине именуют миелодиспластическим синдромом (МДС).
Клинические признаки в этом случае такие же как при анемии, состоянии, отличающимся снижением уровня нейтрофильных гранулоцитов в крови и тромбоцитопении. Заболевание чаще встречается у людей после 60 лет, причем мужчины подвержены ему больше, чем женщины. Однако в последнее время наблюдается «омоложение» болезни. Гематологи считают, что причина кроется в ухудшении экологической обстановки.
Одно из заболеваний группы миелодиспластического синдрома – рефракторная анемия. Данная патология, как и все остальные, объединенные МДС, относится к гематологическим заболеваниям, характеризующимися цитопенией (снижением уровня определенного вида клеток в крови) и патологическими изменениями костного мозга.
Классификация миелодиспластического синдрома
В международную классификацию болезней были внесены некоторые изменения, которые коснулись и гематологических заболеваний. Систематизация схожа с предложенной ранее ВОЗ, но отличается от FAB количеством вариантов определения заболеваний:
- D46.0 – рефрактерная анемия без сидеробластов.
- D46.1 – РА с кольцевыми сидеробластами. Незрелые кровяные клетки в крови не обнаруживаются.
- D46.2 – рефракторная анемия с избытком бластов 1. В анализе крови цитопения, превышение уровня моноцитов, тельца Ауэра отсутствуют.
- D46.3 – рефракторная анемия (РА) со множеством бластов с трансформацией.
- D46.4 – РА неуточненная.
- D46.5 – рефракторная цитопения со многолинейной дисплазией.
- D46.6 – миелодиспластический синдром, ассоциированный с делецией 5q.
- D46.7 – другие миелодиспластические синдромы.
- D46.9 – миелодиспластический синдром неуточненный.
Особенности рефрактерной анемии
Refractorius в переводе с латыни означает “невосприимчивый”, “трудноизлечимый”. Заболевание относится к гематологическим и характеризуется нарушением развития эритроцитного ростка в крови, продуцируемого костным мозгом. При синдроме рефрактерной анемии сначала снижается содержание эритроцитов в крови, а потом и остальных клеток, поражается орган кроветворной системы, отвечающий за гемопоэз.
Основная опасность патологии заключается в том, что она не поддается лечению, основанному на применении железосодержащих препаратов. Данный вид анемии часто протекает практически бессимптомно и выявляется при диагностике других патологий. Болезнь быстро прогрессирует и ведет к развитию острого лейкоза.
Рефракторная анемия с избытком бластов
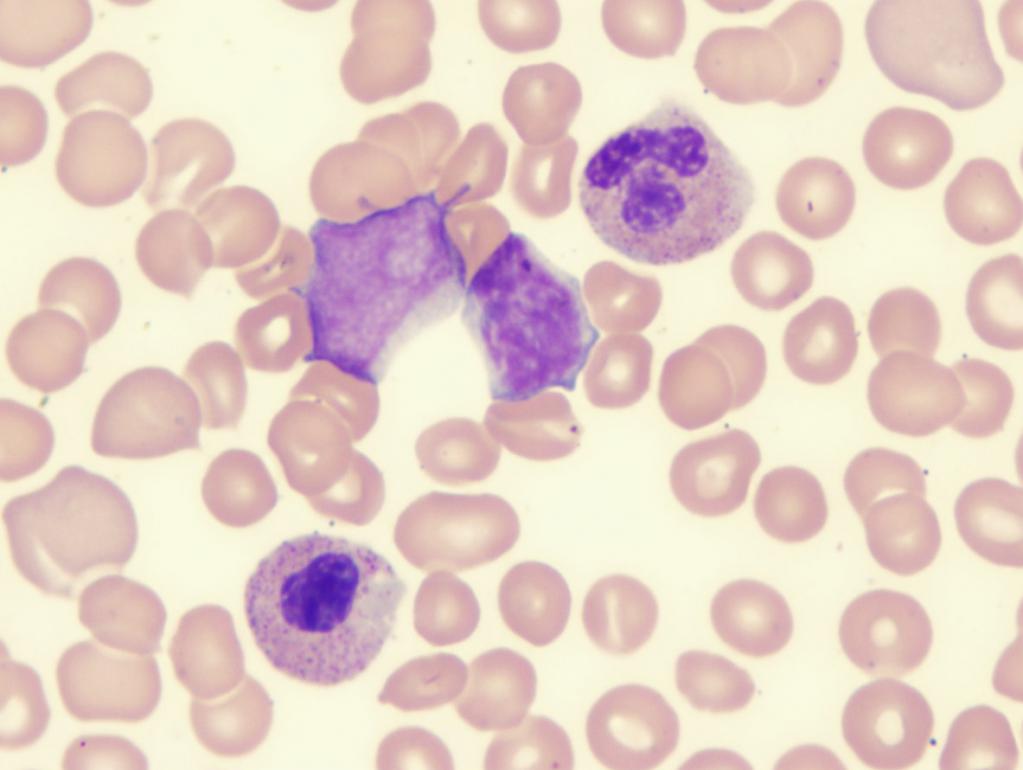
Исходя из статистических данных, людей с подобным диагнозом около 1 015 000. Заболевание чаще всего встречается у мужчин 75-80 лет, а у женщин в возрасте 73-79 лет. Патологию делят на два типа:
- РАИБ-1 – характеризуется цитопенией, увеличением числа моноцитов в крови. Палочковидные красные белковые включения в цитоплазме моноцитов (тельца Ауэра) не обнаруживаются. В костном мозге наблюдается дисплазия одной клеточной линии, бластов (незрелые кровяные клетки) около 5-19 %.
- РАИБ с трансформацией – анализ крови показывает повышенное содержание моноцитов, выявляются тельца Ауэра. Содержание бластов около 30 %. В костном мозге обнаруживаются дисплазии сразу нескольких клеточных линий. Подобная картина способствует развитию острого миелолейкоза.
Смертность от данной патологии составляет около 11 %.
Причины возникновения патологии
Точные причины развития заболевания до сих пор не выявлены. Разделяют два типа синдрома, и по каждому из них установлены факторы риска.
Первичный (идеопатический) выявляется в почти 90 % случаев. Факторы риска:
- Курение.
- Превышенный уровень радиации.
- Проживание в неблагоприятной экологической зоне.
- Регулярное вдыхание паров бензина, органических растворителей, пестицидов.
- Врожденный нейрофиброматоз Реклингхаузена (развитие опухолей из нервной ткани).
- Наследственная анемия Фанкони.
- Синдром Дауна.
Вторичный тип рефрактерной анемии (МДС) наблюдается в 20 % случаев, может развиваться в любом возрасте. Основные причины развития:
- Химиотерапия или радиотерапия.
- Долговременное применение некоторых групп лекарственных средств: циклофосфаты, антрациклины, ингибиторы топоизомеразы, подофиллотоксины.
Вторичный вариант отличается высокой резистентностью к терапии и большой вероятностью формирования острого лейкоза и, как следствие, неблагоприятным прогнозом.
По каким признакам определить заболевание?

Часто патология развивается без каких-либо симптомов, что мешает начать лечение на ранних этапах и в мягких формах. Как правило, диагностируется рефрактерная анемия в тяжелой степени при плановом обследовании пациента.
Но выявить заболевание на ранних этапах все же можно. Первые его признаки имеют много общего с проявлениями, возникающими при патологиях печени, аутоиммунных заболеваниях и любой другой анемии. К ним относятся:
- Бледность, прозрачность кожи, в особенности на лице.
- Чрезмерное утолщение рогового слоя эпидермиса на локтях и коленях.
- Образование гематом, которые долго проходят.
- Постоянные трещины на слизистой рта.
- Ломкость ногтей.
- Изменение обоняния и вкуса: пристрастие к резким запахам, желание есть землю, мел.
- Быстрая утомляемость.
- Частые ОРВИ с тяжелым течением.
При обнаружении подобных симптомов следует обратиться к врачу.
Клинические проявления тяжелой степени патологии

Клиническая картина анемии состоит из двух фаз: хроническая гемодепрессия и тяжелая (финальная) стадия.
При гемодепрессии наблюдаются следующие проявления:
- Значительное повышение температуры, лихорадка.
- Резкий упадок сил.
- Общее плохое самочувствие.
- Снижение веса.
- Увеличение внутренних органов: селезенки, печени.
- Увеличение и болезненность лимфатических узлов.
Подобные состояния затяжные, с периодами ремиссии.
Симптомы тяжелой степени рефрактерной анемии (миелодиспластический синдром) такие же, как при остром лейкозе. Болезнь развивается стремительно. Одной из ее особенностей является обнаружение бластов в анализе крови. Заболевание сопровождается следующими симптомами:
- Гематомы, даже при незначительных ушибах.
- Кровоточивость десен.
- Гингивит.
- Бинокулярное смещение глазного яблока.
- Упорные повторные воспалительные процессы в носоглотке.
- Нагноение царапин, небольших ран.
- Боли в области позвоночника.
У пациентов пожилого возраста возникают вторичные заболевания, чаще поражается сердечно-сосудистая система. Пациенты испытывают боли при ходьбе в нижних конечностях.
Диагностические мероприятия
При первых подозрительных симптомах необходимо обратиться к доктору. Диагноз “миелодиспластический синдром” или “рефрактерная анемия с избытком бластов” ставится только после прохождения ряда лабораторных исследований. Они включают:
- Клинический анализ периферической крови.
- Цитологические исследования аспирата костного мозга.
- Трепанобиопсия заключается во взятии биоматериала из костного мозга путем прокола большеберцовой кости.
- Цитогенетический тест. Анализ выявляет хромосомные нарушения, является обязательным.
В зависимости от клинической картины заболевания могут быть назначены дополнительные диагностические мероприятия:
- УЗИ брюшной полости.
- Эзофагогастродуоденоскопия желудочно-кишечного тракта.
- Анализ на специфические онкомаркеры.
Методы терапии
Выбор способа лечения рефрактерной анемии обусловлен выраженностью клинических проявлений и результатами лабораторных исследований. Схемы терапии довольно сложны и определяются врачом. Пациенты с небольшим количеством бластов находятся в группе низкого риска. Они получают заместительное и поддерживающее лечение и могут вести практически обычный образ жизни. Приблизительная схема лечения такова:
- В стационарных условиях осуществляется наблюдение. Основная задача: поддержка нормального уровня гемоглобина и недопущение развития анемического синдрома. Пациенту делают переливание эритроцитарной донорской массы.
- При тяжелой анемии назначают лекарственные препараты, способствующие восстановлению железосодержащего белка: «Эксиджад», «Десферол».
- Для предотвращения иммунной агрессии против костного мозга применяют «Леналидомид» с антимоноцитарным глобулином и «Циклоспорином».
- При выявлении инфекционных заболеваний назначают антибактериальные препараты в зависимости от возбудителя и его резистентности.
- При необходимости, проводят пересадку костного мозга.
Прогнозирование
Прогноз рефрактерной анемии (миелодиспластический синдром) зависит от клинической картины, ответной реакции организма на терапию, своевременности обращения за медицинской помощью. Исход заболевания обусловлен выраженностью дефицита определенных клеток, наличие и профиль хромосомных отклонений, количество бластов и их тенденцию к развитию в крови и костном мозге.
Профилактика

Ввиду того что сущность, обстоятельства и механизмы развития патологии до конца еще не исследованы, то и действенные профилактические методы назвать практически невозможно. Врачи советуют придерживаться следующих рекомендаций по сохранению здоровья:
- Правильно сбалансировано питаться.
- Включать в рацион продукты с высоким содержанием железа.
- Чаще совершать прогулки на свежем воздухе.
- Отказаться от вредных привычек, в частности курения.
- При работе с пестицидами или органическими растворителями применять средства защиты.
Рефракторная анемия – опасное гематологическое заболевание, переходящее в онкологию. Чтобы избежать тяжелых стадий заболевания и серьезных последствий, необходимо регулярно проводить плановый осмотр. При обнаружении патологии необходимо полностью пройти курс терапии, многим пациентам это помогло не только улучшить, но и продлить жизнь.

Рефрактерная анемия относится к одному из самых опасных видов заболеваний крови. В большинстве случаев на фоне патологии развивается острый лейкоз, спасти от которого человека не всегда возможно. Элементы крови при заболевании из костного мозга в кровоток поступают в незрелой форме, из-за чего их нормальное функционирование оказывается невозможным.
Что такое рефракторная анемия

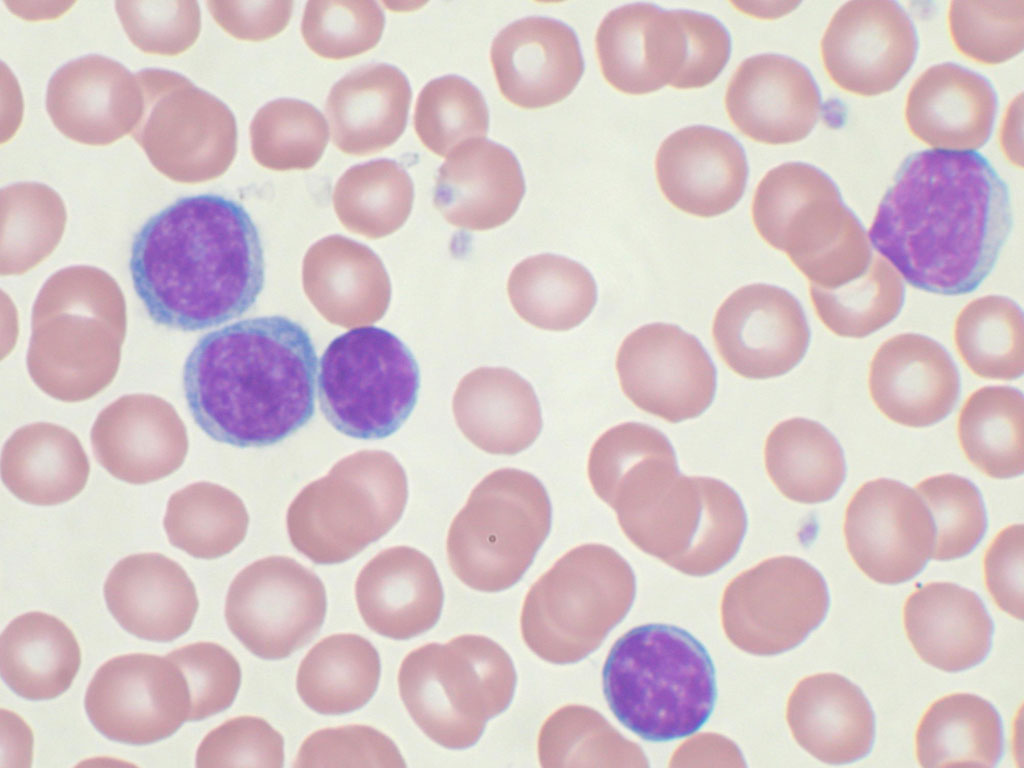
Анемия в мазке крови
Заболевание относится к приобретённым патологиям костного мозга из группы гетерогенных. Кроветворная функция в организме нарушается не только в количественных показателях, но и в качественных. Патология отличается стойкостью к терапевтическому воздействию, которое эффективно против иных видов патологии. Заболевание диагностируется с равной частотой у женщин и мужчин.
При рефрактерной анемии происходит нарушение в выработке ферментных элементов в костном мозге, из-за чего концентрация эритроцитов значительно снижается. При заболевании отмечается резкое падение гемоглобина и понижение количества не только эритроцитов, а также и тромбоцитов и лейкоцитов. Изменения, которые происходят в костном мозге, необратимые. Особая опасность патологии заключается в том, что в течение длительного времени заметной для больного симптоматики не возникает, и о наличии болезни становится известно только в момент острого лейкоза.
Симптомы

Могут иметь место частые беспричинные обмороки
Симптоматика возникает, когда заболевание уже достаточно сильно развито. Первичные симптомы, такие как единичные точечные кровоизлияния под кожей, появление синяков от незначительных ударов и бледность, редко замечаются больным. Когда состояние становится тяжёлым, развиваются следующие признаки болезни:
- слабость, приводящая к непереносимости физических нагрузок,
- частые обмороки, которые происходят без видимых на то причин,
- сильные головокружения,
- регулярные обильные кровотечения из дёсен и носа,
- сильная бледность,
- подверженность инфекционным заболеванием и грибковым поражениям,
- образование синяков даже от простого нажима,
- одышка,
- быстрое исхудание,
- сильные боли в области тазобедренного сустава,
- выраженная дрожь в теле,
- нарушения дыхания,
- боли неопределённого характера,
- нервозность,
- сильная потливость,
- высыпания на коже.
При развитии симптоматики состояние больного ухудшается стремительно, и обойтись без обращения за врачебной помощью в такой ситуации нельзя.
Причины возникновения

Причиной анемии может стать длительный контакт с пестицидами
По причине появления заболевание разделяется на две группы — первичную и вторичную. Первичное нарушение диагностируется у пожилых людей, и причина его развития остаётся пока неизвестной. Вторичная форма нарушения развивается в любом возрасте на фоне длительного проведения радиотерапии или химиотерапии при раке; а также на фоне следующих факторов, вызывающих нарушения в работе костного мозга:
- нахождение в регионе с повышенным радиационным фоном;
- длительное воздействие неблагоприятной экологии;
- длительный и частый контакт с пестицидами, бензином и химическими растворителями;
- наследственные болезни крови;
- длительный приём ряда лекарственных препаратов.
Заболевание в некоторых случаях развивается на фоне приёма противоопухолевых средств, которые могут разрушать не только патологические клетки, но и здоровые. В результате этого нарушается состояние системы кроветворения, из-за чего картина крови резко ухудшается, в значительной степени усугубляя состояние больного.
Диагностика

Жалобы и анамнез дополняются лабораторными тестами
Предположительный диагноз обычно ставится на основании анамнеза и жалоб пациента. Далее для его подтверждения проводится лабораторная диагностика, при которой осуществляются общий анализ крови и исследование тканей костного мозга, полученных при пункции. Также требуется физикальное исследование для оценки тяжести состояния больного.
При изучении тканей костного мозга оценивается их клеточность, соотношение ростков кроветворения, наличие атипичных клеток. Именно данное исследование является основной мерой для диагностики патологии.
Лечение рефрактерной анемии

При выявлении признаков анемии пациенты подлежат лечению
Терапия при заболевании направлена на снижение интенсивности его проявлений, так как вылечить болезнь невозможно. Также при лечении ставится задача не допустить развитие осложнения, которым является острый лейкоз. При выборе терапии учитывается причина появления нарушения, возраст больного и наличие прочих патологий. Основное поддерживающее лечение сводится к следующему:
- внутривенное вливание дефицитных компонентов из состава крови;
- гормональные препараты, стимулирующие образование ростков кроветворения;
- корректировка прочих патологий;
- использование иммуносупрессорных препаратов.
У молодых пациентов при высоком риске появления острого лейкоза проводится курс химиотерапии. Полное выздоровление больного возможно только после операции по пересадке костного мозга, но эффективность метода не 100%.
Осложнения и прогноз

Своевременное лечение помогает достигнуть благоприятных прогнозов
Основное осложнение заболевания — развитие острого лейкоза. Прогноз для больных зависит от стадии патологии и эффективности поддерживающей терапии. При хорошем прогнозе продолжительность жизни составляет до 11 лет, в то время как при плохом больной редко проживает более 6 месяцев. Заболевание относится к категории злокачественных болезней крови.
Профилактика
Эффективные методы профилактики заболевания не разработаны. Единственное, что рекомендуют врачи для снижения риска появления проблем с системой кроветворения, это поддержка иммунитета, полноценное питание и отказ от вредных привычек. Также важно не допускать присутствия факторов, способствующих развитию патологии, и при первых же признаках нарушения обращаться за врачебной помощью.
Железорефрактерная анемия (железо + нем. refraktar невосприимчивый; анемия; син.: сидероахрестическая анемия, сидеробластная анемия, рефрактерная анемия с сидеробластным костным мозгом, рефрактерная анемия с сидеробластозом, железонасыщенная анемия) — обширная группа анемических состояний, для которых характерны высокое содержание сывороточного железа, костномозговой сидеробластоз и рефрактерность к лечению железом.
Классификация
Различают наследственные Железорефрактерные анемии (тип «Бьеркманн») и приобретенные. Приобретенные делятся на первичные (тип «Гейльмейер») и вторичные. К вторичным Железорефрактерным анемиям относятся: а) симптоматические анемии — при системных заболеваниях крови, гемоглобинопатиях, злокачественных новообразованиях, ревматизме, коллагенозах, гипотиреозе, хрон, алкоголизме, свинцовой интоксикации, поздней кожной порфирии; б) пиридоксин(B6)-респонсивные анемии (пиридоксинзависимые), включая пиридоксин(B6)-дефицитные; в) медикаментозно-индуцированные анемии.
Этиология и патогенез
Этиология и патогенез связаны с нарушением активности ферментных систем, участвующих в биосинтезе гема. При наследственной форме, передаваемой по рецессивному, сцепленному с полом типу, установлено нарушение синтеза гема на этапе образования протопорфирина из копропорфирина, что доказывается повышенной аккумуляцией копропорфирина и пониженным содержанием протопорфирина в эритроцитах больных. Не исключена возможность нарушений и на других этапах синтеза гема, в частности на этапе образования дельта-аминолевулиновой к-ты (дельта-АLA) из альфа-амино-бето-кетоадипиновой к-ты, что может быть связано со снижением активности дельта-АLA-синтетазы.
Причина приобретенных первичных Ж. а. неизвестна. Отмечено нарушение синтеза гема на предпоследнем этапе — образования его из протопорфирина и железа, подтверждаемое обнаружением повышенного содержания свободных протопорфиринов в эритроцитах больных (до 300 мкг% вместо 16—50 мкг% в норме), что может быть обусловлено снижением активности гем-синтетазы. При приобретенных вторичных формах (симптоматических и пиридоксинреспонсивных анемиях) считают, что чаще происходит нарушение синтеза гема на последнем этапе— извлечения железа из митохондрий эритробластов (и ранних стадий ретикулоцитов); это связывают со сниженной активностью пиридоксальфосфата — активной формы пиридоксина (витамина B6). В таких случаях, как правило, отмечается положительный терапевтический эффект от введения пиридоксина (или пиридоксаль-фосфата), что позволяет рассматривать эти формы как пиридоксинреспонсивные. В части случаев (примерно 20% всех пиридоксинреспонсивных анемий) патогенез может быть связан с алиментарной недостаточностью пиридоксина (витамина B6); при сочетании с другими признаками B6-гиповитаминоза (дерматит, глоссит, нейропатии, конвульсии) они могут быть отнесены к истинным пиридоксин(В6)-дефицитным анемиям. Нарушение синтеза гема на том или ином этапе и, следовательно, нарушенная утилизация железа (собственно сидероахрезия) являются причиной как неэффективного эритропоэза (дизэритропоэза), ведущего к развитию анемии (см. Дизэритропоэтическая анемия), так и избыточного отложения в тканях и органах неиспользуемого железа, что ведет к развитию вторичного гемосидероза (см.).
Роль некоторых медикаментов — туберкулостатических препаратов (ИНГА-17, изониазид, пиразинамид, циклосерин), химиопрепаратов (азатиоприн) и антибиотиков, напр. левомицетина, (хлорамфеникол), — в развитии тяжелой сидеробластной анемии гипохромного типа обусловлена антагонистическим действием по отношению к пиридоксину. Избирательность поражения, носящая семейный характер (известны случаи заболевания братьев, принимавших одни и те же лекарства), объясняется латентным генетическим нарушением метаболизма витамина B6 (возможно, в стадии превращения пиридоксина в пиридоксаль-фосфат), усиливающимся под влиянием терапевтических доз лекарств — антагонистов пиридоксина.
Патологическая анатомия
Патологоанатомическая картина сидероахрестических анемий характеризуется гемосидерозом органов. Особенно большие отложения железа обнаруживаются в печени (как в гепатоцитах, так и в ретикулярных клетках), поджелудочной железе, миокарде, костном мозге, почках, надпочечниках, щитовидной железе, яичках, в меньшей степени — в селезенке. Гемосидероз связан с нарушением метаболизма железа. Степень его может усиливаться от повторных гемотрансфузий. Следствием длительного гемосидероза являются вторичные склеротические изменения органов — микронодулярный цирроз печени (см. Циррозы печени), гломерулосклероз (см. Гломерулонефрит]), диффузный миокардиосклероз (см. Кардиосклероз) и др.
Клиническая картина
Наследственные Железорефрактерные анемии встречаются почти исключительно у мальчиков и молодых мужчин; приобретенные первичные формы чаще у пожилых лиц (старше 50 лет) обоего пола, вторичные — в любом возрасте. У больных Ж. а. отмечается бледность видимых слизистых оболочек и кожных покровов, иногда субиктеричность, пигментация отдельных участков кожи (за счет гемосидероза), в редких случаях фотодерматоз (за счет порфирии). Примерно у половины больных увеличены печень и (или) селезенка. Лимфатические узлы, как правило, не увеличены. В связи со вторичным гемосидерозом органов (чаще у больных, получающих систематические гемотрансфузии) развиваются симптомы цирроза печени, поражения поджелудочной железы (сахарный диабет), сердечная недостаточность. Проявления симптоматических форм определяются также особенностями основного заболевания. Течение Ж. а. хроническое, длительность приобретенных анемий — от 1 года до 5—10 лет.
Наследственные Железорефрактерные анемии проявляются выраженной гипохромной эритроцитов (при нормальном или близком к норме числе эритроцитов содержание гемоглобина не превышает 7—8 г%, а цветной показатель равен 0,4—0,5), гиперсидеремией, присутствием кольцевидных сидеробластов в костном мозге, повышенным содержанием копропорфирина при снижении протопорфирина.

Рис. 2. Микропрепарат крови при железорефрактерной анемии: видны эритроциты с базофильной зернистостью.
Для картины крови приобретенных Ж. а. характерна выраженная анемия (возможно снижение гемоглобина до 3 г%, числа эритроцитов до 1 млн. в 1 мкл), чаще гипохромномикроцитарного, реже нормохромно-макроцитарного характера. Процент ретикулоцитов в пределах нормы или снижен, редко слегка повышен. Средний объем эритроцитов нормален или немного увеличен (за счет макроцитов). Нередко отмечается клеточный диморфизм с наличием двух популяций эритроцитов: гипохромно-микроцитарной и нормохромно-макроцитарной. Встречаются эритроциты с базофильной пунктацией (рис. 2), особенно при свинцовой анемии, сидероциты, овалоциты, мишеневидные эритроциты. У некоторых больных повышено содержание малых фракций гемоглобина (HbF, HbА2). Определяемое с помощью радиоактивного хрома (51Cr) время полураспада (T1/2) меченых эритроцитов укорочено или нормально. Укороченное время полураспада указывает на наличие компонента периферического гипергемолиза.
Нарушение использования железа на нужды эритропоэза (собственно сидероахрезия) проявляется высоким уровнем сывороточного железа (до 225—260 мкг%), почти полным (на 95%) насыщением сидерофиллина железом (независимо от гемо-трансфузий), ускорением клиренса плазмы (через 25—50 мин. вместо 90—100 мин. в норме) при внутривенном введении радиоактивного железа (59Fe), усилением кругооборота железа плазмы (1,5—5,9 мг на 100 мл цельной крови вместо 0,4—0,8 мг на 100 мл в норме) при сниженной инкорпорации железа в гем (в эритроидных клетках костного мозга и вышедших в циркуляцию эритроцитах определяется 15— 30% введенного 59Fe вместо 80—90% в норме), при сниженной фиксации 59Fe костным мозгом (пониженная радиоактивность над тазовой областью) и повышенной фиксации радиоактивного железа в печени. Десфераловая проба (см. Гемосидероз) резко положительна (увеличение железа в моче после однократного введения 500 мг десферала).
Содержание порфиринов в эритроцитах отражает характер нарушения порфиринового обмена. В то время как при наследственной форме в эритроцитах отмечается повышенное содержание копропорфирина при снижении протопорфирина, приобретенные формы характеризуются высоким содержанием в эритроцитах протопорфирина, что соответствует нарушению гемообразования на предпоследнем этапе.

Рис. 3. Микропрепарат костного мозга при железорефрактерной анемии: 1 — грубозернистый кольцевидный сидеробласт; 2 — грубозернистые сидероциты.
Костный мозг (по данным пункции грудины) характеризуется абсолютным преобладанием эритроидных клеток. Соотношение лейко/эритро извращено, составляя 1:1 — 0,3 : 1. Среди эритробластов преобладают базофильные и полихроматофильные формы при почти полном отсутствии оксифильных форм. Встречаются PAS-положительные (содержащие гликоген) мегалобластоиды. Подавляющее большинство (до 95%) эритроидных клеток представляют собой сидеробласты, среди которых преобладают кольцевидные формы с грубой, располагающейся перинуклеарно зернистостью, содержащей ионизированное (негемовое) железо (рис. 3). По данным электронной микроскопии, железосодержащий пигмент обнаруживается в цитоплазме и митохондриях сидеробластов в виде мелкодисперсного ферритина, а также в виде более крупных агрегатов («железоносный мицелий»).
При трепанобиопсии (см.) подвздошной кости обнаруживается гиперплазия кроветворной ткани за счет эритроидных форм, а также гемосидероз.
Количественная диспропорция между эритроидной гиперплазией костного мозга и снижением абсолютного числа поступающих в циркулирующую кровь эритроцитов (ретикулоцитов) является морфол, выражением дизэритропоэза, свойственного Ж. а.
Диагноз
Диагноз ставится на основе характерных клинико-лабораторных симптомов и данных семейно-генетического исследования (при наследственной форме). Дифференциальный диагноз при гипохромном типе анемии проводится в основном с железо дефицитной анемией (табл.). Известные трудности представляет дифференциальный диагноз наследственной Ж. а. с малой формой бета-талассемии, для к-рой характерны более высокое содержание HbF и (или) HbA2 и наличие мишеневидных эритроцитов в крови при меньшем числе кольцевидных сидеробластов в костном мозге, а также (при семейно-генетическом исследовании) гетерозиготное носительство гена талассемии у родителей пробанда (см. Талассемия). Необходимо проводить дифференциальный диагноз с прелейкозными состояниями, когда начальная фаза лейкозного процесса, протекающая с пониженной активностью внутриклеточных ферментов, участвующих в биосинтезе гемоглобина, проявляется в виде сидеробластной анемии с появлением в костном мозге атипических, мегалобластоидных форм эритробластов, имитирующих картину эритромиелоза. Лишь появление в костном мозге, а затем и в крови лейкозных бластов (чаще миелобластов) позволяет диагностировать ту или иную форму лейкоза (см.). При развитии вторичного гемосидероза сидероахрестическую анемию необходимо дифференцировать с первичным гемохроматозом (см.), который может быть отвергнут как в результате отсутствия характерных для него признаков (интенсивной диффузной пигментации покровов, полицирроза органов), так и по наличию не свойственных ему признаков (анемии, высокого костномозгового сидеробластоза, нарушения порфиринового обмена).
Таблица. Дифференциально-диагностическая характеристика железодефицитных и железорефрактерных анемий
Виды анемий | Показатели | |||||||||
морфологические | биохимические | радиометрические | клинические | реакция на введение железа | ||||||
в крови | в костном мозге | в крови | в моче | |||||||
Патология эритроцитов | Патология эритрокариоцитов | сывороточное железо | железосвязывающая способность сыворотки | Насыщенность трансферрина | негемовое железо в эритроцитах | суточное выведение железа (десфераловая проба) | поступление 59Fe в костный мозг | |||
Железодефицитные | Наличие микроцитов, аннулоцитов | Микронормобластов, сидеробластов меньше 20% или | Понижено | Высокая | Низкая | Понижено или отсутствует | Низкое или отсутствует | Ускорено | Трофическое изменение ногтей (койлонихия), извращение | Введение железа эффективно (и показано) |
Железорефрактерные | Наличие нормомакроцитов, сидероцитов, овалоцитов, | Макронормобластов, сидеробластов больше 80%, преобладают | Повышено | Низкая или отсутствует | Высокая, почти полная | Повышено | Высокое (гемосидероз тканей и органов) | Замедлено | Симптомы цирроза печени и поражения поджелудочной железы, | Введение железа неэффективно (и противопоказано) |
Лечение
Лечение зависит от формы Железорефрактерной анемии. При вторичных симптоматических анемиях показано лечение основного заболевания. При токсических формах, возникающих в связи с воздействием лекарственных препаратов, а также свинца, отмена лекарства или отстранение больного от влияния токсического агента (свинца) может привести к выздоровлению и без лечения. При наследственной (у 50% больных) и приобретенной пиридоксин-респонсивной форме исчезновение или уменьшение признаков анемии и гиперсидеремии достигается парентеральным введением витамина B6 в больших дозах (100—1000 мг в день) в виде 5% р-ра. В отдельных случаях, относящихся к истинным пиридоксин-дефицитным анемиям, полный гематол, эффект получают при введении минимальных доз пиридоксина (1—5 мг в день внутрь). У некоторых больных благоприятный эффект отмечается лишь при введении пиридоксаль-5-фосфата. Положительный эффект лечения выражается в быстром (через 5—7 дней) повышении количества ретикулоцитов, повышении гемоглобина, уменьшении сывороточного железа. С целью предотвращения рецидива болезни прием пиридоксина следует повторять через каждые 8—10 нед. У некоторых больных наследственной сидероахрестической анемией положительный эффект достигается назначением аденила в виде внутримышечных инъекций по 200—250 мг в день. При мегалобластном сдвиге эритропоэза показано дополнительное введение фолиевой к-ты, печеночного экстракта. Гормональная терапия (глюкокортикоиды, стероидные андрогены), спленэктомия неэффективны. С целью выведения излишков железа применяют железосвязывающие средства. Наиболее эффективно применение десферала (десферриоксамин, дефероксамин В). Систематическое введение этого препарата в дозах 500—1000 мг в день внутримышечно или внутрь (в капсулах во время приема пищи) ежемесячно в течение 10 дней способствует выведению железа из органов с мочой, а также через кишечник, оказывая одновременно ингибирующее влияние на энтеральную абсорбцию железа. В среднем ежедневная потеря железа с мочой при введении десферала составляет от 30 до 80 мг в день. В период лечения десфералом содержание аккумулированных в эритроцитах порфиринов снижается до нормальных цифр, что объясняется выведением из организма ионов железа, которые блокируют активные SH-группы ферментов, участвующих в синтезе гема. При тяжелых анемиях введение десферала сочетают с переливаниями эритроцитной массы.
Прогноз
Прогноз зависит от форм?
