Кислород связь с гемоглобином
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
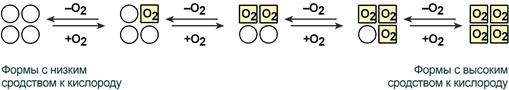
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
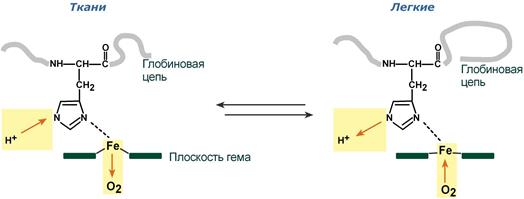
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
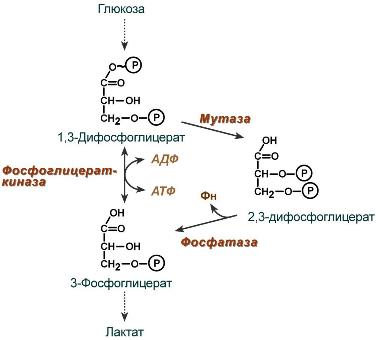
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
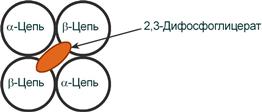
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Основная функция гемоглобина – транспорт кислорода, которую онвыполняет очень эффективно. Гемоглобин артериальной крови насыщен кислородом приблизительно на 96%, гемоглобин венозной крови – на 64% (White А. et al, 1981).
Уменьшение степени насыщения на 32 % соответствует количеству О2, потребляемому тканями. Принимая, что 100 мл крови содержат 15,0 г гемоглобина и что каждый грамм гемоглобина может связать 1,34 мл О2 (число Хюфнера) находим, что:
0,96 х 1,34 х 15 = 19,2 мл О2 –
транспортируется 100 мл артериальной крови (19,2 объемных %);
0,64 х 1,34 х 15 = 12,8 мл О2 –
транспортируется 100 мл венозной крови (12,8 объемных %);
19,2 – 12,8 = 6,4 мл О2 (6,4% объемных %)
или
0,32 х 1,34 х 15 = 6,4 мл О2 (6,4 % объемных %)
отдается тканям каждыми 100 мл артериальной крови, протекающими через капилляры.
Поскольку минутный объем крови (МОК) равен 5 литрам, в сутках 1440 минут, определяем, что в течение суток общий объем перекачиваемой сердцем крови составит:
5 х 1440 = 7200 литров
А так как один литр артериальной крови способен транспортировать 19,2 объемных % кислорода, из которых 6,4 объемных процента потребляются тканями, находим:
7200 х 19,2
———————– = 1382 литра – количество кислорода, транспортируемое
100 за сутки артериальной кровью
7200 х 6,4
———————– = 461 литр – количество кислорода, потребляемое тканями
100 за сутки из артериальной крови
В целом, за сутки кровь переносит от легких к тканям около 1400 л кислорода, из которых 450-600 л потребляются тканями. Причем, практически весь перенос кислорода обеспечивается гемоглобином, т.к. кислород плохо растворим в водных растворах. Ограниченная растворимость кислорода позволяет транспортировать его в растворенном состоянии в количестве, составляющем всего 0,3 мл О2 / 100 мл крови (White А. еt al, 1981) при РаО2 равном 12,7 кПа (95 мм рт ст). Это соотношение вытекает из закона Генри-Дальтона, в соответствии с которым «количество растворенного в жидкости газа пропорционально его напряжению». Важно отметить, что несмотря на малое количество растворенного кислорода, именно эта его фракция обусловливает РаО2.
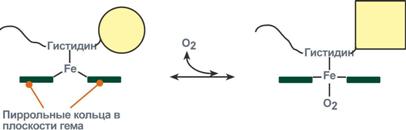
Гемоглобин растворен в водном цитозоле эритроцитов в очень высокой концентрации, порядка 34%. Его синтез осуществляется в процессе созревания ретикулоцитов и перехода их в эритроциты. Гемоглобин состоит из белка – глобина и простетической группы – гема. Гем представляет собой соединение, в молекулу которого входят атом двухвалентного железа и 4 замещенных пиррольных кольца, связанных между собой метиновыми группами ( – СН = ). Скелетом молекулы гема служит порфирин. Fe2+ имеет в геме координационное число, равное 6, т.е. 6 пар электронов. Четыре из этих пар связаны с атомами азота, одна пара с белком (глобином) через гистидин. Оставшаяся пара электронов используется для образования донорско-акцепторной координационной связи (ковалентной химической связи) с кислородом (рис. 12).
Функциональные свойства гемоглобина, обусловленные его уникальной структурой, специфически соответствуют задачам обеспечения дыхательной функции. Каждая из четырех полипептидных цепей глобина содержит по одной молекуле гема. А поскольку атом железа в геме может обратимо связывать одну молекулу О2 понятно, что одна молекула полностью оксигенированного гемоглобина (НbО2) содержит четыре молекулы кислорода.Гемоглобин, отдавший кислород тканям, называется свободным (неоксигенированным) гемоглобином.
Рис. 12.Координационные связи железа в молекуле гема
(по A. Ленинджеру, 1985)
В процессе присоединения и отдачи кислорода железо в молекуле гемоглобина свою валентность не меняет, т.е. при присоединении кислорода или при его отдаче железо не окисляется и не восстанавливается. Следовательно, в этих случаях речь идет об оксигенированном (оксигемоглобин) и неоксигенированном (свободном) гемоглобине, но не об окисленном и восстановленном гемоглобине.
Окисленный гемоглобин – это метгемоглобин (MetHb), содержащий Fe3+. Он не способен присоединять кислород, однако Fe3+ в MetHb может взаимодействовать со многими анионами, например, при щелочном рН с ОН- и при кислом рН – с Cl-. В небольшом количестве, составляющем 0, 5% от всего гемоглобина, метгемоглобин образуется ежесуточно в условиях in vivo (White A. et al, 1981).
Кроме кислорода к атому железа в молекуле гемоглобина могут присоединяться и другие вещества (лиганды) : Н2О; СО; СN. Их сродство, проявляемое к атому железа, неодинаково. Оно наиболее выражено у цианидов, затем у окиси углерода, затем у кислорода и наименее выражено у воды.
Степень насыщения гемоглобина кислородом зависит от парциального давления кислорода (РО2). Это давление в легких ( 100 мм рт.столба) достаточно, чтобы практически полностью оксигенировать весь гемоглобин в эритроцитах. Уникальной особенностью связывания гемоглобином О2 является кооперативное взаимодействие между гемсвязывающими участками, получившее название гем-гем – взаимодействие. И хотя прямых физических контактов между четырьмя группами гема нет, кооперативность связывания О2 проявляется в том, что по мере протекания оксигенирования гемоглобина облегчается связывание последующих молекул кислорода. При физиологических условиях сродство к О2 у гемоглобина и у полностью оксигенированного гемоглобина отличается в 500 раз (A. White et al, 1981); это показывает, что после присоединения первых молекул О2 сродство частично насыщенного гемоглобина к кислороду увеличивается.Данное положение характеризуетсясигмовидной формой кривой диссоциации HbO2 (рис. 5).Такая формауказывает на то, что связывание О2 одной из гемовых групп гемоглобина влияет на константы диссоциации других гемовых групп этой же молекулы. Сигмовидный характер кривой диссоциации НbО2 имеет большое физиологическое значение. Как видно из рис. 5 парциальное давление О2 существенно влияет на насыщение гемоглобина в пределах от 20 до 60 мм рт. ст., когда показатель насыщения кислородом характеризуется наиболее крутым подъемом отрезка кривой. При больших значениях РО2 кривая насыщения приобретает пологий характер, увеличиваясь в диапазоне 60-90 мм рт. ст. всего на 7%.
Связывание гемоглобином кислорода зависит не только от РО2. Этот процесс тонко регулируется рядом соединений, подобно тому как это имеет место при действии на аллостерический фермент.Таким регуляторным действием обладают 2,3 – дифосфоглицерат, диоксид углерода (СО2) и ионы Н+.
Главной фракцией фосфатов в эритроцитах является 2,3 – дифосфоглицерат (ДФГ); его внутриклеточная концентрация составляет приблизительно 4-5 – ммоль, т.е. сопоставима с концентрацией гемоглобина. Дифосфоглицерат (ДФГ) связывается с тетрамерным гемоглобином при нейтральном рН, образуя комплекс с соотношением компонентов 1 : 1. Связывание с гемоглобином ДФГ обусловлено наличием в молекуле последнего отрицательно заряженных групп (рис. 13):
-О О
С
Н С О Р О-
Н С Н
О
О Р О
О-
Рис. 13. Структура молекулы ДФГ(по А. Ленинджеру, 1985).
Жирным выделены группы, взаимодействующие с β-цепями
Местом связывания служит центральная полость или канал в молекуле гемоглобина, выстланный многочисленными положительно заряженными R-группами β-цепей. В итоге образуется поперечная связь между двумя β-субъединицами. При связывании гемоглобина кислородом ДФГ вытесняется из этого канала.
Главным результатом образования комплекса ДФГ-гемоглобин является снижение сродства гемоглобина к кислороду:
НbO2 + ДФГ Нb • ДФГ + О2
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. Чем ниже это давление (при подъеме на высоту), тем выше концентрация ДФГ в эритроцитах, тем легче будет освобождаться кислород от связи с гемоглобином в тканях.
Таким образом, при фиксированной концентрации оксигенированного гемоглобина, увеличение концентрации ДФГ повышает диссоциацию НbO2. При увеличении же РО2 и росте концентрации НbО2 будет усиливаться диссоциация комплекса Нb ДФГ.
Повышенное сродство крови плода к кислороду не является следствием различий сродства фетального (НbF) и постнатального (НbA) гемоглобинов к О2, поскольку кривые диссоциации изолированных НbАО2 и НbFO2 существенно не отличаются. Этот феномен повышенного сродства к кислороду крови плода является результатом менее эффективного связывания ДФГ фетальным гемоглобином, поскольку на ДФГ – связывающем участке НbF незаряженный Sery γ 143 заменяет His β 143.
В крови, консервированной в некоторых средах (цитрат-декстрозной) концентрация ДФГ снижается (в течение 10 дней с 4,5 до 0,5 мМ). Гемоглобин такой крови приобретает очень высокое сродство к кислороду, в связи с чем увеличивается риск развития гипоксии, обусловленной снижением отдачи им кислорода. Тем более, что восстановление содержания ДФГ самими эритроцитами происходит медленно (за 24 часа – до половины нормальной концентрации). Исправление ситуации путем добавления экзогенного ДФГ не эффективно, поскольку высокий отрицательный заряд его молекулы не позволяет ей проникать через мембрану эритроцитов. В связи с этим используются вещества, добавление которых к консервированной крови обеспечивает поддержание нормальной концентрации ДФГ (Волкова Н.П., 2005).
Способность гемоглобина взаимодействовать с СО2 и ионами Н+ определяется не наличием атома Fe2+ в гемах, а другими участками его молекулы, с которыми происходит связывание этих соединений. В частности, ионы водорода присоединяются к R – группам остатков гистидина в α и β – цепях глобина :
R CH COOH (общая формула аминокислоты)
NH2
R – группа, с которой связывается
ион водорода.
Что касается диоксида углерода, то он присоединяется к концевой α-аминогруппе каждой из четырех полипептидных цепей с образованием карбаминогемоглобина:
O O
R CH C + CO2 R CH C
OH OH
NH2 NHCOO- + H+
карбаминоконцевой остаток
( карбаминогемоглобин )
Важно подчеркнуть, что процессы связывания с гемоглобином О2, Н+ – ионов и СО2 (как и ДФГ) взаимозависимы. Эту взаимозависимость иногда называют кооперативным эффектом гемоглобина, который заключается в том, что изменение концентрации одного из этих веществ влияет на связывание гемоглобина с другими. В частности,связывание с гемоглобином СО2 и ионов водорода снижает его способность связывать кислороди наоборот:связывание с гемоглобином кислорода снижает его способность связывать СО2 и ионы Н+.Поэтому в периферических тканях с относительно низким значением рН и высокой концентрацией СО2 сродство Нb к кислороду падает по мере связывания СО2 и ионов водорода. И наоборот, в легочных капиллярах выделение СО2 и сопутствующее ему повышение рН крови приводят к увеличению сродства гемоглобина к кислороду. Это влияние величины рН и концентрации СО2 на связывание и освобождение кислорода гемоглобином называется эффектом Бора(в честь датского физиолога Христиана Бора, впервые открывшего его).
В основе данного эффекта лежит изменение четвертичной структуры (т.е. упаковки субьединиц молекулы белка) гемоглобина при его оксигенации. В результате молекула оксигенированного гемоглобина приобретает несколько более компактную структуру по сравнению с неоксигенированным. Вследствие этого аминокислотные остатки в α и β – цепях, связывающие ионы водорода, перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщепление ионов водорода от протонированных групп. Иначе говоря, протонированные группы при оксигенации гемоглобина приобретают свойства более сильных кислот (как донаторов ионов водорода). Т.е. НbО2 более сильная кислота (в 70 раз – Войнов В.А., 1992), чем ННb. Можно сказать и так, что оксигенированный гемоглобин (НbO2) плохо присоединяет протоны, но зато легко их отдает. А неоксигенированный гемоглобин наоборот – плохо отдает протоны, но зато легко их присоединяет (ННb).
В легочной ткани вследствие уменьшения РСО2 и превращения гемоглобина в НbО2 освобождается также СО2, находящийся в виде карбаминогемоглобина..
Повышение или снижение сродства Hb к кислороду проявляется изменением кривой диссоциации оксигемоглобина (рис. 14).
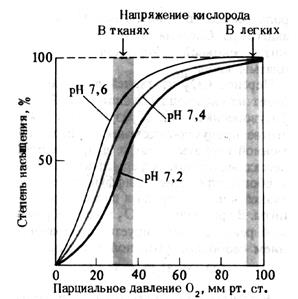
Рис. 14.Кривая диссоциации оксигемоглобина. Влияние рН(по A. Ленинджеру, 1985)
Эти изменения обозначаются понятием «сдвиг вправо» и «сдвиг влево». При сдвиге вправо, как это следует из рисунка, при снижении рН (рН = 7,2), 50% насыщение Hb кислородом, которое в норме происходит при значениях РаО2 ≈ 26,6 мм рт. ст, будет осуществляться уже при больших значениях РаО2, приближающихся к 40 мм рт. ст. Это означает, что сродство Hb к кислороду понизилось. Соответственно, при сдвиге влево (рН = 7,6) 50% насыщение Hb кислородом происходит при меньших, чем при нормальном рН значениях РаО2. Это означает, что сродство Hb к кислороду оказалось повышенным. Помимо кислотно-основного состояния на характер кривой диссоциации оксигемоглобина влияют и другие факторы (табл. 3).
Таблица 3.
