Кислородная емкость гемоглобина и крови
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
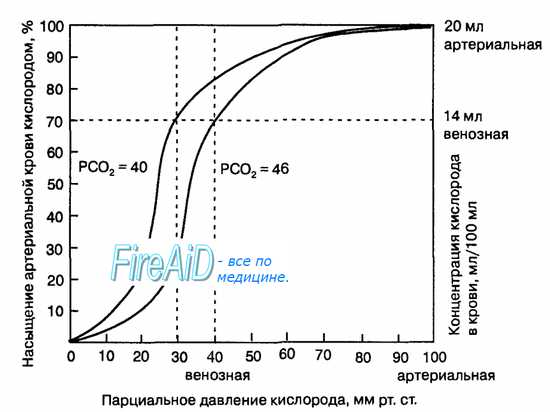
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.

Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
– Также рекомендуем “Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.”
Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах. Гемоглобин способен захватывать кислород из альвеолярного воздуха (оксигемоглобин) и освобождать необходимое кол-во кислорода в тканях. Кол-во связанного О2 ограничено кол-ом молекул гемоглобина в эритроцитах. Молекула гемоглобина имеет 4 места связывания с О2, которые взаимодействуют таким образом, что зависимость между парциальным давлением О2 и кол-ом переносимого О2 с кровью имеет S-образную форму, которая называется Кривая диссоциации оксигемоглобина. При парциальном давлении О2 10 мм.рт.ст. Насыщение гемоглобина О2 составляет 10%. При дальнейшем повышении 40-60 происходит уменьшение крутизны кривой диссоциации оксигемоглобина (КДО) и % его насыщения О2 возрастает 75-90% Далее КДО занимает горизонтальное положение, т. к. увеличение Парц.Р с 60 до 80 вызывает прирост насыщения гемоглобина О2 на 6%. Насыщение гемоглобином О2 под влиянием РО2 характеризует молекулярный аппетит этого соединения к О2. Крутизна кривой насыщения гемоглобина О2 в диапазоне Парц.Р 20-40 способствует тому, что в ткани организма значительное кол-во О2 может диффундировать из крови в условиях градиента его Парц.Р между кровью и клетками тканей. Незначительный % насыщения гемоглобина О2 в диапазоне его Парц.Р 80-100 мм.рт.ст. Способствует тому, что человек без риска снижения насыщения артериальной крови О2 может перемещаться в диапазоне высот над уровнем моря до 2000м. Общие запасы О2 в организме обусловлены его кол-вом, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобинов мышечных клеток.
Кислородная емкость гемоглобина — кол-во О2, которое может связаться с гемоглобином
эритроцитов крови пр насыщении 100% его кол-ва. Еще показатель дыхательной функции крови является содержание О2 в крови — Кислородная емкость крови.Она отражает его истинное кол-во, как связанного с гемоглобином, так и физически растворенного в плазме.
Молекула гемоглобина находится в двух формах:
–Расслабленной — насыщается в 70 раз быстрее, чем Напряженная форма.
Изменение фракций этих двух форм в общем кол-ве гемоглобина в крови обуславливают S-образный вид КДО, а следовательно Сродство гемоглобина к О2.
1)Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастаетсродство гемоглобина к О2.
2)Образование указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием связывание О2 с геминовой группой молекулы гемоглобина. При этом чем больше геминовых групп связывают О2 в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше сродство к О2.
3)При низком РО2 сродство гемоглобина к О2 ниже и наоборот.
4)Как только гемоглобин захватывает О2, повышается сродство к О2
5)В мышечных клетках содержится белок миоглобин, имеющий высокое сродство к О2. Он интенсивно насыщается О2 и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обуславливает процессы биологического окисления. Эти ткани способны эстрагировать до 70% О2 из крови, проходящей через них, что обусловлено снижениемсродства гемоглобина к О2 под влияниемтемпературы тканей и рН.
Эффект Бора —при насыщении гемоглобина менее 100% низкое рН понижает связывание О2 с гемоглобином — КДО смещаетсяВправо по оси х. Метаболически активные ткани продуцируют кислоты: молочная, СО2. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мышц, то концентрация О2 в ней будет возрастать вследствие эффекта Бора. Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение КДО Вправо вдоль оси х. В результате большое кол-во О2 будет освобождаться из гемоглобина эритроцитов и поступать в ткани
140.Транспорт углекислого газа . Углекислый газ является конечным продуктом клеточного метаболизма.
C02 образуется в тканях, диффундирует в кровь и переносится кровью к легким в трех формах: растворенной в плазме, в составе бикарбоната и в виде карбаминовых соединений эритроцитов.
Количество СО2, растворимого в плазме, как и для О2, определяется законом Генри, однако его растворимость в 20 раз выше, поэтому количество растворенного СО2 довольно значительно и составляет до 5—10 % от общего количества СО2 крови.
Реакция образования бикарбоната описывается следующей формулой:
СО2 + Н2О <-> Н2СО3 <->Н+ + НСО3-.
Первая реакция протекает медленно в плазме и быстро — в эритроцитах, что связано с содержанием в клетках фермента карбоангидразы. Вторая реакция- диссоциация угольной кислоты – протекает быстро, без участия ферментов. При повышении в эритроците ионов НСО3- происходит их даффузия в кровь через клеточную мембрану, в то время как для ионов Н+ мембрана эритроцита относительно непроницаема и они остаются внутри клетки. Поэтому для обеспечения электронейьральности клетки в нее из плазмы входят ионы Сl-(так называемый хлоридный сдвиг).
Высвобождающиеся ионы Н+ связываются с гемоглобином:
H+ + Нb02 <->Н+ • Hb + O2.
Восстановленный гемоглобин является более слабой кислотой, чем оксигемоглобин. Таким образом, наличие восстановленного Нb в венозной крови способствует связыванию СО2, тогда как окисление Нb в сосудах легких облегчает его высвобождение. Такое повышение сродства С02 к гемоглобину называется эффектом Холдейна. На долю бикарбоната приходится до 90 % всего СОз, транспортируемого кровью.
Карбаминовые соединения образуются в результате связывания СОз с концевыми группами аминокислот белков крови, важнейшим из которых является гемоглобин (его глобиновая часть):
Hb •NN2 + CO2 <->Hb•NH•COOH.
В ходе этой реакции образуется карбаминогемоглобин. Реакция протекает быстро и не требует участия ферментов. Как и в случае с ионами Н+, восстановленный Нb обладает большим сродством к СО2, чем оксигемоглобин.
Поэтому деоксигенированный гемоглобин облегчает связывание СО2 в тканях, а соединение НЬ с O2 способствует высвобождению СО2. В виде карбаминовых соединений содержится до 5 % общего количества СО2 крови.
Кривая диссоциации СО2 — гемоглобин значительно отличается от
кривой диссоциации оксигемоглобина — она более линейна.
Концентрация СО2 при любой величине РСО2 зависит от степени насыщения гемоглобина кислородом: чем выше насыщение, тем меньше концентрация СО2 (эффект Холдена).
Определений парциального напряжения О2 и СО2 крови проводится
при помощи автоматических газоанализаторов, использующих для каждого из измеряемых газов специальный электрод.
Гемоглобин – хромопротеид, окрашенный в красный цвет после присоединения к Fe++ кислорода. Состоит из белка глобина и простетической группы гема. В молекуле гемоглобина содержится одна молекула глобина и четыре молекулы гема. Гем имеет в своем составе атом двухвалентного железа, способный присоединить и отдать молекулу кислорода. Одна молекула гемоглобина присоединяет четыре молекулы кислорода. 1 гр гемоглобина присоединяет 1,34 мл кислорода. Содержание гемоглобина у мужчин 16,6 г в 100 мл крови (166 г/л), у женщин – 130 г/л.
Значение гемоглобина:1) Выполняет роль переносчика О2 от лёгких к тканям.2) Участвует в транспорте СО2 от клеток к лёгким.3) Составляет гемоглобинную буферную систему и регулирует кислотно-основное состояние крови.
Виды гемоглобина
В период внутриутробного развития зародыша (7-12 недель) эритроциты содержат примитивный гемоглобин (HbP), на 9-й неделе появляется гемоглобин фетальный HbF, а перед рождением – гемоглобин взрослых (HbА). Фетальный гемоглобин в течение первого года жизни ребенка полностью заменяется на HbА. Примитивный и фетальный гемоглобины обладают более высоким сродством к кислороду, что обеспечивает его насыщение кислородом при более низком парциальном давлении.
В норме гемоглобин содержится в виде нескольких соединений:
1) Восстановленный, или дезоксигемоглобин (Hb). Имеет 4 свободных связи, к которым могут присоединяться лиганды – кислород, угарный газ.
2) Оксигемоглобин (HbО2). Образуется из восстановленного гемоглобина присоединением кислорода.
3) Карбгемоглобин (HbСО2). Образуется в тканях после присоединения к гемоглобину углекислого газа.
при выполнении мышечной деят-тиВ системе крови набдюдается увели-чение кол-ва форменных элементов. Наблюдается миогенный эритроцитоз и миогенный тромбоцитоз. В зависимос-ти от тяжести работы проявляются различные стадии миогенного лейко-цитоза. При работе увеличивается отдача кислорода из крови в ткани. 35. Лейкоциты, их количество и функции. Лейкоцитарная формула. Миогенный (рабочий) и пищеварительный лейкоцитоз.
Лейкоциты содержатся в периферической крови в концентрации 4-9 ґ 109 /л. Увеличение количества лейкоцитов называется лейкоцитозом, снижение – лейкопенией. Причиной лейкопении являются токсические и радиационные воздействия на организм. Лейкоцитоз может развиваться у здорового человека при мышечной работе, во время сильных эмоций, после приёма пищи, у женщин при беременности. Патологический лейкоцитоз характерен для инфекционных и воспалительных заболеваний и обеспечивает повышение реактивности организма. Определение числа лейкоцитов имеет большое диагностическое заболевание.
Группы лейкоцитов:
1. Зернистые (гранулоциты). Содержат специфическую зернистость в цитоплазме.
2. Незернистые (агранулоциты). Не содержат зернистости в цитоплазме.
Гранулоциты – клетки диаметром 7-10 мкм подразделяются на:
а) Эозинофилы. Зернистость окрашивается кислыми красителями. Обезвреживают и разрушают токсины белкового происхождения, комплексы антиген-антитело, фагоцитируют гранулы базофилов и тучных клеток, продуцируют гистаминазу, разрушающую гистамин. Количество увеличивается при аллергических реакциях, глистных инвазиях, интоксикациях;
б) Базофилы. Зернистость окрашивается основными красителями, крупная, в цитоплазме – гранулы, содержащие гистамин и гепарин. Благодаря секреции гистамина и гепарина базофилы способствуют миграции нейтрофилов. Базофилы способствуют так же рассасыванию погибших тканей и заживлению. Мембрана базофилов имеет рецепторы к иммуноглобулину Е, который комплементарен к иммунному комплексу, в составе которого есть этот глобулин. После гидролиза лизосомальными ферментами в цитоплазме базофила иммунного комплекса, рецептор вновь синтезируется и через 12 – 24 часа транслоцируется на поверхность мембраны. Благодаря таким циклам, базофил способен элиминировать из плазмы большое количество антигенов, блокированных иммуноглобулином Е.
в) Нейтрофилы имеют мелкую зернистость, которая окрашивается нейтральными красителями. По форме ядра и зрелости делятся на:
– юные (метамиелоциты) – ядро рыхлое, бобовидное,
– палочкоядерные – ядро в виде изогнутой палочки, подковки или буквы S,
– сегментоядерные – ядро состоит из 2-3 долек, связанных между собой тонкими перемычками. Это зрелые нейтрофилы.
Нейтрофилы – микрофаги – фагоцитируют, переваривают и уничтожают микробов, обладают противовирусным действием (продуцируют интерферон). Метаболической особенностью нейтрофилов является анаэробный гликолиз, поэтому нейтрофилы способны осуществлять фагоцитоз в разрушенных и размозженных тканях с ограниченной оксигенацией.
Агранулоциты не содержат зернистости.
а) Лимфоциты – клетки размером 4,5 – 10 мкм ( подразделяются на малые, средние, большие). Содержат очень плотное, темное ядро, цитоплазма окружает ядро в виде узкой каймы, окрашивается в голубой или синий цвет основными красителями.
По функции и месту созревания лимфоцитов различают:
– Т-лимфоциты – дифференцируются в тимусе. Участвуют в клеточном иммунитете.
– В-лимфоциты – дифференцируются в костном мозге. Синтезируют антитела и участвуют в гуморальном иммунитете.
б) Моноциты имеют размеры 10-12 мкм, ядро – бобовидное, подковообразное, дольчатое, цитоплазма окружает ядро более широкой полосой, светло-голубая. Являются тканевыми макрофагами. Завершают процесс фагоцитоза в очагах воспаления, фагоцитируют и собственные поврежденные ткани. Способствуют восстановлению, регенерации.
Лейкоцитарная формула – это процентное соотношение всех видов лейкоцитов. Лейкоцитарная формула, наряду с изучением изменений числа лейкоцитов имеет диагностическое значение. В нормальных условиях лейкоцитарная формула для человека довольно постоянна и представлена следующими соотношениями (%): базофилы — 0-1, эозино-филы — 0,5-5, палочкоядерные нейтрофилы — 1-6, сегментоядерные нейтрофилы — 47-72, лимфоциты — 19-37; моноциты — 3-11. В абсолютных цифрах в1 мкл крови содержится: базофилов — 0-65, эозинофилов — 20-300, палочко-ядерных — 40-300, сегментоядерных — 200-5500, лимфоцитов — 1200-3000, моноцитов — 90-600.
Различают следующие виды физиологических лейкоцитозов:
Пищевой. Возникает после приема пищи. При этом число лейкоцитов увеличивается незначительно (в среднем на 1—3 тыс. в мкл) и редко выходит за границу верхней физиологической нормы. При пищевом лейкоцитозе большое количество лейкоцитов скапливается в подслизистой основе тонкой кишки. Здесь они осуществляют защитную функцию — препятствуют попаданию чужеродных агентов в кровь и лимфу. Пищевой лейкоцитоз носит перераспределительный характер и обеспечивается поступлением лейкоцитов в кровоток из депо крови.
Миогенный. Наблюдается после выполнения тяжелой мышечной работы. Число лейкоцитов при этом может возрастать в 3—5 раз. Огромное количество лейкоцитов при физической нагрузке скапливается в мышцах. Миогенный лейкоцитоз носит как перераспределительный, так и истинный характер, так как при нем наблюдается усиление костномозгового кроветворения.36. Тромбоциты, их количество и функции. Механизм свертывания крови. Противосвертывающая система крови. Изменение свертываемости крови при мышечной работе.
Тромбоциты – безъядерные клетки крови, диаметром 1,5–3,5 мкм. Они имеют уплощенную форму, и их количество у мужчин и женщин одинаково и составляет 180–320 ч 109/л.
Тромбоцит содержит две зоны: гранулу (центр, в котором находятся гликоген, факторы свертывания крови и т. д.) и гиаломер (периферическую часть, состоящую из эндоплазматического ретикулума и ионов Ca).
Тромбоциты, или кровяные пластинки, представляют собой образования овальной или округлой формы диаметром 2—5 мкм. Количество в крови тромбоцитов составляет 180—320 х 109/л (180 000—320 000 в 1 мм3). Увеличение содержания тромбоцитов в периферической крови называетсятромбоцитозом, уменьшение — тромбоцитопенией.
Свойства тромбоцитов. Тромбоциты способны к фагоцитозу и передвижению за счет образования ложноножек (псевдоподий). К физиологическим свойствам тромбоцитов также относятся их способность прилипать к чужеродной поверхности и склеиваться между собойпод влиянием разнообразных причин. Тромбоциты очень легко разрушаются. Они способны выделять и поглощать некоторые биологически активные вещества: серотонин, адреналин, норадреналин. Все рассмотренные особенности кровяных пластинок обусловливают их участие в остановке кровотечения.
Функции тромбоцитов. Тромбоциты принимают активное участие в процессе свертывания крови и фибринолиза(растворение кровяного сгустка).
В пластинках обнаружены биологически активные соединения, за счет которых они участвуют востановке кровотечения (гемостазе).
Кроме того, тромбоциты выполняютзащитную функциюза счет склеивания (агглютинации) бактерий и фагоцитоза, они способны вырабатывать некоторые ферменты(амилолитические, протеолитические и др.), необходимые не только для нормальной жизнедеятельности пластинок, но и для процесса остановки кровотечения. Тромбоциты оказывают влияние на состояние гистогематических барьеров, изменяя проницаемость стенки капилляров (выделение в кровоток серотонина и особого белка — протеина S).
