Классификация анемий по регенерации
Анемия
— группа клинико-гематологических
синдромов, общим моментом для которых
является снижение концентрации
гемоглобина в крови, чаще при одновременном
уменьшении числа эритроцитов (или общего
объёма эритроцитов).
Определение
анемии:
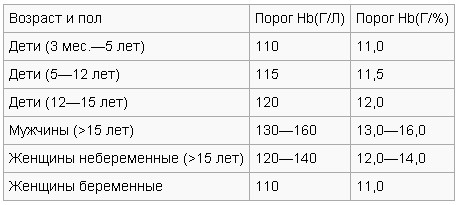
В
зависимости от пола и возраста норма
показателя содержания гемоглобина в
литре крови может отличаться.

Повышение
гемоглобина отмечается при:
первичной
и вторичной эритремии;обезвоживании
(ложный эффект за счёт гемоконцентрации);чрезмерном
курении (образование функционально
неактивного HbСО).
Снижение
гемоглобина выявляется при:
анемии;
гипергидратации
(ложный эффект за счёт гемодилюции —
«разбавления» крови, увеличения объёма
плазмы относительно объёма совокупности
форменных элементов).
Классификация
анемий:
Анемии
подразделяют на группы по различным
признакам. Классификация анемий в
основном основывается на удобстве,
возможности эффективного её применения
в клинической практике.
По
цветовому показателю
Цветовой
показатель (ЦП) показывает степень
насыщения эритроцита гемоглобином. В
норме он равен 0,85—1,05. В зависимости от
него различают такие анемии:
Гипохромные
— ЦП < 0,85 (по некоторым источникам
ниже 0,8):
железодефицитная
анемияталассемия
(заболевание, наследуемое по рецессивному
типу, в основе которого лежит снижение
синтеза полипептидных цепей, входящих
в структуру нормального гемоглобина)
Нормохромные
— ЦП 0,85—1,05:
гемолитические
анемии (когда скорость разрушения
эритроцитов превышает скорость их
продукции)постгеморрагическая
(как результат потери крови вследствие
кровотечения или кровоизлияния)неопластические
заболевания костного мозгаапластические
анемиивнекостномозговые
опухолианемии
вследствие снижения выработки
эритропоэтина
Гиперхромные
— ЦП > 1,1:
витамин
B12-дефицитная анемияфолиеводефицитная
анемиямиелодиспластический
синдром
По
степени тяжести
В
зависимости от выраженности снижения
уровня гемоглобина выделяют три степени
тяжести анемии:
Лёгкая
— уровень гемоглобина ниже нормы, но
выше 90 г/л;Средняя
— гемоглобин в пределах 90—70 г/л;Тяжёлая
— уровень гемоглобина менее 70 г/л.
По
способности костного мозга к регенерации
Основным
признаком такой регенерации является
увеличение количества ретикулоцитов
(молодых эритроцитов) в периферической
крови. Норма — 0,5—2 %.
Арегенераторная
(к примеру, апластическая анемия) —
характерно отсутствие ретикулоцитов.Гипорегенераторная
(витамин B12-дефицитная анемия,
железодефицитная анемия) — характерно
количество ретикулоцитов ниже 0,5 %.Норморегенераторная
или регенераторная (постгеморрагическая)
— количество ретикулоцитов в норме
(0,5—2 %).Гиперрегенераторная
(гемолитические анемии) — количество
ретикулоцитов более 2 %.
Патогенетическая
классификация
Основана
на механизмах развития анемий как
патологического процесса
Железодефицитные
анемии — связаны с дефицитом железаДисгемопоэтические
анемии — анемии, связанные с нарушением
кровообразования в красном костном
мозгеПостгеморрагические
анемии — связанные с острой или
хронической кровопотерейГемолитические
анемии — связанные с повышенным
разрушением эритроцитовВ12
— и фолиеводефицитные
анемии
Патогенез
анемий:
Различают
три основных механизма развития анемии:
Анемия
как следствие нарушения
образования нормальных эритроцитов и
синтеза гемоглобина.
Такой механизм развития наблюдается
в случае недостатка железа, витамина
B12, фолиевой кислоты, во время заболеваний
красного костного мозга. Иногда анемия
возникает при приёме больших доз
витамина С (витамин С в больших дозах
блокирует действие витамина B12).Анемия
как следствие потери
эритроцитов
— является, главным образом, следствием
острых кровотечений (травмы, операции).
Следует отметить, что при хронических
кровотечениях малого объёма причиной
анемии является не столько потеря
эритроцитов, сколько недостаток железа,
который развивается на фоне хронической
потери крови.Анемия
как следствие ускоренного
разрушения эритроцитов крови.
В норме длительность жизни эритроцитов
составляет около 120 дней. В некоторых
случаях (гемолитическая анемия,
гемоглобинопатии и пр.) эритроциты
разрушаются быстрее, что и становится
причиной анемии. Иногда разрушению
эритроцитов способствует употребление
значительных количеств уксуса,
вызывающего ускоренный распад
эритроцитов.
Общие
показатели крови, связанные с эритроцитами:
RBC
— абсолютное содержание эритроцитов
(норма 4,3—5,15 кл/л), содержащих гемоглобин,
транспортирующих кислород и углекислый
газ.HGB
— концентрация гемоглобина в цельной
крови (норма 132—173 г/л). Для анализа
используют цианидный комплекс или
бесциандидные реактивы (как замена
токсичному цианиду). Измеряется в молях
или граммах на литр или децилитр.HCT
— гематокрит (норма 0,39—0,49), часть (% =
л/л) от общего объёма крови, приходящаяся
на форменные элементы крови. Кровь на
40—45 % состоит из форменных элементов
(эритроцитов, тромбоцитов, лейкоцитов)
и на 60—65 % из плазмы. Гематокрит это
соотношение объёма форменных элементов
к плазме крови. Считается, что гематокрит
отражает соотношение объёма эритроцитов
к объёму плазмы крови, так как в основном
эритроциты составляют объём форменных
элементов крови. Гематокрит зависит
от количества RBC и значения MCV и
соответствует произведению RBC*MCV.
Эритроцитарные
индексы (MCV, MCH, MCHC):
MCV
— средний объём эритроцита в кубических
микрометрах (мкм) или фемтолитрах
(фл)(норма 80—95 фл). В старых анализах
указывали: микроцитоз, нормоцитоз,
макроцитоз.MCH
— среднее содержание гемоглобина в
отдельном эритроците в абсолютных
единицах (норма 27—31 пг), пропорциональное
отношению «гемоглобин/количество
эритроцитов». Цветной показатель крови
в старых анализах. ЦП=MCH*0.03MCHC
— средняя концентрация гемоглобина в
эритроцитарной массе, а не в цельной
крови (норма 300—380 г/л, отражает степень
насыщения эритроцита гемоглобином.
Снижение MCHC наблюдается при заболеваниях
с нарушением синтеза гемоглобина. Тем
не менее, это наиболее стабильный
гематологический показатель. Любая
неточность, связанная с определением
гемоглобина, гематокрита, MCV, приводит
к увеличению MCHC, поэтому этот параметр
используется как индикатор ошибки
прибора или ошибки, допущенной при
подготовке пробы к исследованию.
Соседние файлы в предмете Лабораторная диагностика
- #
- #
- #
- #
- #
- #
- #
1. Регенераторная форма анемии (с достаточной функцией костного мозга) – ретикулоцитов больше 1% (при гемолитических анемиях, ретикулоцитарном кризе при лечении витамином В12 пернициозной анемии, после кровопотерь).
2. Гипорегенераторная форма анемий (с пониженной регенераторной функцией костного мозга) – ретикулоцитов меньше 1% (при железодефицитных анемиях, хронических кровопотерях).
3. Гипопластическая или апластическая форма анемии (с резким угнетением процессов эритропоэза) – ретикулоцитов менее 0,2% (при гипопластических анемиях, панмиелофтизе).
Об эритропоэтической функции костного мозга судят по содержанию в периферической крови ретикулоцитов. Нормальное содержание ретикулоцитов 0,2-1%.
Классификация анемий по степени тяжести
· Лёгкая степень – Нв – 110-90 г/л.
· Средняя степень – Нв – 89-70 г/л.
· Тяжёлая степень – 69 г/л и менее.
Железодефицитная анемия
Железодефицитная анемия (ЖДА) – это клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов.
Этиология
Основные причины развития железодефицитной анемии:
· Хронические кровопотери различной локализации:
– желудочно-кишечные;
– маточные;
– носовые;
– почечные;
– ятрогенные и искусственные кровопотери.
· Нарушение всасывания железа.
· Повышенная потребность в железе.
· Нарушения транспорта железа.
· Алиментарная недостаточность.
Патогенез
Железо является одним из наиболее распространённых и значимых микроэлементов человеческого организма.
Железо обеспечивает:
· перенос кислорода;
· участвует в процессах окисления;
· участвует в синтезе белков;
· влияет на количество и функциональные свойства Т-лимфоцитов;
· входит в состав нервных клеток.
В целом организм содержит от 4 до 5 г железа, которое распределено следующим образом:
– клеточное железо, входящее в состав гемоглобина (62%), миоглобина (10%), тканевых ферментов (4%);
– внеклеточное железо, транспортное железо в виде трансферрина, содержится в плазме (менее 0,1%);
– железо запаса (ферритин, гемосидерин) – в депо (24% в печени, селезёнке,
мышцах) и включается в обмен при недостаточности клеточного железа.
Недостаточное поступление железа в костный мозг обусловливает нарушение эритропоэза, снижение уровня гемоглобина и количества эритроцитов, нарушается транспорт кислорода, развивается гемическая гипоксия. Недостаток кислорода частично компенсируется увеличением минутного объёма крови за счёт повышения ударного объёма и учащения сердечных сокращений. Если этот механизм становится недостаточным при выраженной анемии, то развивается тканевая гипоксия. Формируется гипоксический или общеанемический синдром, свойственный всем анемиям.
В условиях дефицита железа происходит истощение клеточного пула железа, запасов железа, развивается тканевой дефицит железа – сидеропенический синдром, свойственный только железодефицитной анемии.
При сидеропеническом синдроме уменьшается синтез железосодержащих ферментов, что приводит к нарушению трофики клеток и тканей, а уменьшение синтеза миоглобина обусловливает развитие мышечной гипотонии, дистрофии, в том числе сердечной мышцы.
Клиника
Клинические проявления ЖДА складываются из нескольких групп симптомов:
общеанемического (гипоксического), синдром, который присущ всем анемиям и обусловлен развитием тканевой гипоксии:
– головокружение, шум в ушах, мелькание мушек перед глазами, сонливость днём и плохое засыпание ночью, обморочные состояния; возможна декомпенсация имеющегося сосудистого поражения головного мозга;
– сердцебиение, перебои в области сердца, одышка, стенокардические боли; возможна дестабилизация предшествующей ИБС с появлением или нарастанием клиники аритмического синдрома, синдрома коронарной и сердечной недостаточности; – вследствие плохого кровоснабжения кожи больные гиперчувствительны к холоду, зябки;
– при длительной и глубокой анемии появляется группа диспепсических жалоб, обусловленных ухудшением кровоснабжения желудочно-кишечного тракта;
– длительное и тяжёлое течение ЖДА может сопровождаться функциональной недостаточностью печени. На фоне гипоксии возникает гипопротеинемия, гипоальбуминемия, гипогликемия, гипопротромбинемия;
– при объективном исследовании выявляется бледность кожных покровов, которая часто приобретает алебастровый или зеленоватый оттенок; отёки стоп и голеней; пульс обычно частый, АД нормальное или сниженное, пульсовое давление увеличено, I тон на верхушке усилен, выслушивается систолический шум на верхушке, точке Боткина и во II межреберье слева, определяется «шум волчка»; если на фоне нормализации гемоглобина и эритроцитов сохраняется систолический шум, I тон на верхушке становится слабленным;
сидеропенического синдрома, свойственного только ЖДА. Клинические проявления этого синдрома связаны с тканевым дефицитом железа, необходимого для нормального функционирования тканей и органов. Основная симптоматика сидеропении наблюдается со стороны эпителиальных тканей в результате снижения активности железосодержащих ферментов:
– отмечается сухость кожи, нарушение целостности эпидермиса, ломкость и слоистость ногтей, выпадение и раннее поседение волос, сечение кончиков волос;
– снижение аппетита, чувство жжения языка, извращение вкуса (pica chlorotica) – склонность к острой, кислой пище, неукротимое желание есть мел, глину, зубную пасту, пепел, известь; извращение обоняния – пристрастие к некоторым запахам (ацетон, бензин); абдоминальные боли и группа диспепсических жалоб, связанных с атрофическими изменениями слизистой оболочки желудка;
– группа жалоб, отражающих изменения мышечного аппарата вследствие снижения синтеза миоглобина: затруднение глотания (сидеропеническая дисфагия), недержание мочи при смехе, кашле из-за слабости сфинктеров; симптомы ночного энуреза; мышечная слабость, не соответствующая глубине анемии;
– при объективном исследовании: кожа сухая с наклонностью к образованию трещин, часто трещины, изъязвления в углах рта (ангуллёзный стоматит); может быть лёгкая желтизна ладоней и носогубного треугольника, связанная с нарушением обмена каротина из-за тканевого дефицита железа; поперечная исчерченность ногтей, ногти становятся плоскими, приобретая вогнутую ложкообразную форму; волосы тусклые, ломкие; часто отмечается «синева» склер (симптом голубых склер) из-за дистрофических изменений роговицы глаза, через которую просвечивают сосудистые сплетения, создающие синеву; тусклая и тёмная эмаль зубов, кариес.
Классификация анемий: этиологическая, патогенетическаяПо определению анемия это заболевания эритроцитной системы, заключающиеся в сокращении массы эритроцитов и количества гемоглобина, а в отдельных случаях — лишь в уменьшении последнего. В настоящее время известны механизмы, обусловливающие развитие анемии, при этом современные классификации разработаны с учетом вызывающего их патогенетического механизма. Однако уже долгое время применяются классификации анемий по обычным методам гематологического исследования. Так, с учетом количественных параметров различаются нормо-, микро- и макроцитные анемии, в то время как по показателю нагрузки гемоглобином красных кровяных клеток или по классическому цветного показателя известны нормо-, гипо- и гиперхромные анемии. Однако ни одна из отмеченных классических гематологических классификаций не указывает патогенетический вид анемии. В этой связи нормохоромная анемия бывает гемолитической, за счет острой кровоточивости или костномозговой аплазии, в то время как микроцитная — гемолитической или гипохромной. Гиперхромным и макроцитным анемиям, рассматриваемым как злокачественные, не соответствует общий патогенный механизм — недостаток витамина В12 или фолиевой кислоты. С патофизиологической точки зрения уже давно выделены регенеративные, гипо- или арегенеративные анемии, в зависимости от функционального состояния костного мозга, который, морфологически бывает гипо- или апластическим, равно как и нормо- или гиперпластическим. Перечисленная характеристика, относящаяся к морфологии красной кровяной клетки или морфофункциональному состоянию костного мозга сохранена в номенклатуре отдельных видов анемии, но лишь в целях дополнения характера той или иной из них, которая определяется по соответствующему пусковому механизму. Итак, в основе любой современной классификации заложен обусловливаяющий анемии патогенетический механизм. Когда оказывается возможным дополнительно учитывается этиологическое условие, которое определяет данный патогенез. Использование строго этиологических терминов классы фикации представляется правильным лишь в определенных случаях комплексного патогенеза. Отдельные патогенетические факторы, такие как токсические, химические и медикаментозные обусловливают ряд анемий, при том они способствуют и развитию гемолитических или ацластических костномозговых процессов. И наоборот, некоторые патогенетические виды анемии развиваются под воздействием ряда цитологических факторов. Так, апластическую анемию обусловливают токсические, инфекционные факторы, лейкемическая инфильтрация, миелосклероз, неопластический метастаз и пр. Этиологическая классификация анемий Для клинициста, равно как и в целях постановки диагноза лабораторным работником наиболее целесообразным представляется точное отнесение данной анемии к тому или иному виду по определенной патогенетической концепции, в которой различные механизмы действуют на кронную ткань. Эти механизмы изменяют массу эритроцитов с точек зрения структуры и распространенности, понятия об единой ткани — эритрон —, периферического и центрального составов. Эритроидный ряд (эритрон) содержит массу периферических красных кровяных клеток, определяемую количественно интенсивностью периферического гемолиза и скоростью их продуцирования костным мозгом с дальнейшим их поступлением в периферическое кровообращение. Кибернетическое регулирование продукции — кровеобразования — обусловлено кибернетическими факторами ауторегуляции, в связи с чем происходит ежедневное расплавление 50 мл эритроцитной массы и поступление в кровоток такого-же количества после регенеративной пролиферации в эритробластпческом костном мозге. Установлено, что в рамках общего миелопоэза, эритропоэз обусловлен костномозговой структурой, с разделами стромы и паренхимы. Раздел стромы содержит участки покоящихся бластических недифференцированных клеток — «stem cell» — в особой трофической взаимосвязи с сосудо-коллагенной стромой. Отсюда клетки-штамм переходят в активную группу и приобретают способность пролиферации и дифференциации в целях образования активной эритропоэтической паренхимы. Нормальная морфологическая структура покоящихся клеток и активной паренхимы составляет основу способности кроветворного восстановления. Последнее обусловливается следующими тремя функциями костного мозга: митотического деления, дифференциации и созревания, цитодиабеза зрелых эритроцитов. Эти функции развертываются под генетическим управлением, заложенным в клетках-штамм, которое становится активным посредством эпигенетических факторов дерепрессии. Эти факторы обусловливают переход покоящихся недифференцированных клеток в активный раздел пролиферации и дифференциации. Известна направляющий роль эритропоэтина в процессе дифференциации клетки-штамм для целей кроветворения. Далее в процессе правильного созревания красных кровяных клеток, нормальных по форме, объему и содержанию гемоглобина, участвуют и другие эритропоэтические факторы. Ранее рассматривались уже хорошо известные факторы регуляции эритропоеэза, факторы оспоримого влияния, в том эндокринные и невровегетативные, также отдельные факторы питания. Патогенетическая классификация анемий Классификация анемий, применяемая более 20 лет, основывается на единой оценке кровяной ткани и центрального и периферического компонентов основных функций костного мозга. Используемая классификация, в основу которой заложена морфофункциональная концепция о кровяной ткани, выделяет три крупные группы анемий, определяемых альтерационным изменением центрального компонента эритрона, и другие две — за счет изменений периферического компонента. На рисунке приведены все группы, зависящие от центрального и периферического компонентов. В 1-ую группу отнесены анемии, развивающиеся за счет недостатка первой функции костного мозга (функция митотического деления), в том числе, гипо- или апластические анемии арегенеративного характера, определяемые сокращением популяции эритробластов. Немецкими авторами (Gasser) эти анемии относятся за счет эритробластопении, что совпадает с классическими терминами аплазия или гипоплазия, которые были созданы также немецкими, но более давними авторами (Erlich, Frank). В связи с современными знаниями о кроветворении Erslev в американском гематологическом труде вносит справедливое дополнение, по которому недостаток пролиферации поражает либо недифференцированные полипотентные клетки-штамм в условиях общей костномозговой аплазии, в которой сохраняются лишь первичные клетки-штамм, либо лишь клетки-штамм, развивающиеся в целях кроветворения и в таком случае появляется красная селективная аплазия — эритробластопения. Американским автором отмечается дополнительно, что красная аплазия или эритробластопения развивается на определенном уровне эритропоэтической дифференциации, как это наблюдается при бирмеровской или сидероаккрестической анемиях, за счет прекращения созревания на различных стадиях эритро- и мегалопоэза. В таблице ниже приведены все виды апластической анемии, определяемой этиологическими факторами, которые разрушают эритробласт, но не затрагивают механизмы клеточного деления на поздних или ранних сроках созревания. Во 2-ую группу отнесены анемии за счет нарушения дифференциации и созревания от проэритробласта до эритроцита. В отдельных случаях, как например, при тяжелой анемии за счет недостатка витамина В12, прекращение созревания происходит на ранних фазах — проэритробласта или промегалобласта. Но бывают и случаи блокирования на более поздних фазах — в базофильных или полихроматофильных эритробластах, как это наблюдается в случаях недостаточности образования гемоглобина за счет общего железодефицита или образования запасов железа макрофагами. По данным таблицы видно, что в большинстве анемий этой группы неполноценность созревания относится за счет известных этиологических факторов, таких как, бирмеровская и гипохромная анемии. При иных формах этиопатогенетические факторы неизвестны, быть может они генетической природы, при этом в объяснение патогенеза нарушения созревания приводятся гипотезы, как в случае сидероаккрестической анемии и даже анемии, развивающейся при синдроме Di Guglielmo или макро- бластических дисэритропоэтических анемиях. 3-тья группа анемий центральной природы носит больше теоретический характер, поскольку не известны случаи развития анемии за счет уменьшения массы циркулирующих эритроцитов по причине нарушения исключительно функции цитодиабеза. Точно доказано, что зрелые клетки нового поколения выходят из костного мозга с помощью периферического механизма обратной связи. Но дефект разряда наблюдается лишь как следствие нарушения созревания, при этом сокращение массы эритроцитов составляет результат низкого показателя разряда по причине уменьшенной массой зрелых клеток в костном мозге. Более давние и к тому же не проверенные гипотезы (Doan, Crosby) утверждали, что в условиях гиперспленизма, периферическая гемоцитопения развивается и в связи с угнетением селезенкой цитодиабеза. По существу заниженный цитодиабез это последствие недостаточности остальных двух функций костного мозга. Виды периферической анемии развиваются резким или медленным но непрерывным сокращением массы эритроцитов, не компенсирующимся восстановительной способностью костного мозга. По механизму сокращения массы эритроцитов различаются группа анемий за счет острой геморрагии и группа анемий, обусловливаемых расплавлением крови. В зависимости от этиопатогенетического механизма развития геморрагии или гемолиза в каждой из них различается ряд форм. Так, кровотечение может быть наружным или внутренним, местной или общей причины за счет нарушения функции гемостаза. Гемолитическая анемия долится на эндоэритроцитную, за счет сокращающего жизнь эритроцита дефекта морфологической и биохимической структуры, и экзоэритроуцитную, при которой отдельные факторы внутренней среды нарушают морфологическую или биохимическую структуру эритроцита ускоряя процесс разрушения сосудистой крови или крови отдельных органов с большим содержанием макрофагов. – Также рекомендуем “Клиническая диагностика анемии – признаки малокровия” Оглавление темы “Гемолитические анемии”:
|


