Клинические рекомендации по лечению анемий у новорожденных
Российская ассоциация специалистов перинатальной медицины составила инструкцию по анемиям новорожденных
 Существует много причин развития анемии у новорожденных. Общность механизмов развития ее при разной этиологии позволяет выделить несколько групп анемий: связанных с острой или хронической кровопотерей (постгеморрагические), обусловленных повышенным разрушением эритроцитов (гемолитические), развившихся вследствие недостаточности эритропоэза (дефицитные, гипо- и апластические, ранняя анемия недоношенных)
Существует много причин развития анемии у новорожденных. Общность механизмов развития ее при разной этиологии позволяет выделить несколько групп анемий: связанных с острой или хронической кровопотерей (постгеморрагические), обусловленных повышенным разрушением эритроцитов (гемолитические), развившихся вследствие недостаточности эритропоэза (дефицитные, гипо- и апластические, ранняя анемия недоношенных)
Данная классификация необходима для выделения ведущего патогенетического механизма развития анемии, однако необходимо учитывать, что во многих случаях отмечается сочетание нескольких причин анемизации.
В рекомендации перечислили причины развития анемии у новорожденных, которые лежат в основе классификации заболевания. Дали практические рекомендации по профилактике и лечению анемий новорожденных.
↯
Больше статей в журнале
«Заместитель главного врача»
Активировать доступ
Виды анемий новорожденных
Классификации анемий по функциональному состоянию эритропоэза
По функциональному состоянию эритропоэза анемии делят на:
- гипорегенераторные;
- регенераторные;
- гиперрегенераторные
При первом варианте число ретикулоцитов, как правило, меньше 15 ‰, во втором 15-50‰, и в последнем более 50‰.
Однако оценка состояния эритропоэза по числу ретикулоцитов в ряде случаев может быть ошибочна, так как при этом не учитывается тяжесть анемии. В связи с этим целесообразно определять ретикулоцитарный индекс.
Формула определения ретикулоцитарного индекса
Смотреть
Морфологические классификации анемий
В последнее время в связи с широким распространением автоматических анализаторов распространение получили морфологические классификации анемий. Однако данный метод классификации в оценке состояний новорожденных, особенно у недоношенных детей, может быть ошибочным.
Узнать, в чем причина ошибочности метода
Причины возникновения анемии у новорожденных
Рассматривая анемии у новорожденных детей целесообразно выделить причины их развития в зависимости от времени действия патологических факторов. Это группа антенатальных, интранатальных и постнатальных причин.
Представили наиболее частые причины клинически значимых анемий в неонатальном периоде:
- Постгеморрагические анемии
- Гемолитическая болезнь новорожденных
- Ранняя анемия недоношенных детей
- Анемии при генерализованных инфекционных заболеваниях
- Флеботомические потери у новорожденных детей в отделении реанимации
Подробно каждый вид анемий рассмотрели в полной версии рекомендации.
Читать разбор в рекомендации >>
Профилактика анемий
Различные мета-анализы показали, что отсроченное пережатие пуповины (от 30 секунд до, максимум 2 или 3 минуты после рождения) играет важную роль в снижении анемии, как у недоношенных, так и доношенных новорожденных.
Также было показано, что пережатие пуповины через 120 секунд после рождения у недоношенных детей снижает в последующем частоту переливаний ЭВ, при отсутствии увеличения частоты полицитемии, гипербилирубинемии. Более того это даже приводит к снижению частоты внутричерепных кровоизлияний.
Узнать, об альтернативе позднему пережатию пуповины
Среди профилактических мер по снижению риска развития анемии большую важность имеет снижение уровня флеботомических потерь за счет минимизации объемов крови для проведения анализов, в особенности у детей с низкой и экстремально низкой массой тела, а также уменьшение продолжительности парентерального питания и улучшение весовой динамики.
К профилактическим мерам также относят введение препаратов эритропоэтина, в результате чего уменьшается тяжесть анемии, а следовательно и частота переливаний эритроцитной взвеси.
В полной версии рекомендации привели подробный обзор причин развития анемий у новорожденных, рассказали о методах лечения.
Развернуть рекомендацию полностью >>

Материал проверен экспертами Актион Медицина
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).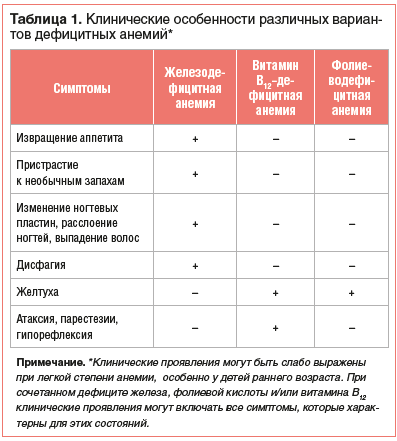
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.

Анемия недоношенных – это патология, возникающая у детей, которые были рождены ранее 37 недель беременности, и выражающаяся в снижении гемоглобина крови. Основные проявления сводятся к бледности слизистых оболочек и кожи, снижению двигательной активности и сосания, ухудшению аппетита, тахикардии. Клиническая симптоматика при начальных стадиях анемии может отсутствовать вовсе. Диагностика основывается на изучении клинического анализа крови, который может дополняться биохимическими исследованиями. Для лечения используются гемотрансфузии, эритропоэтин, препараты железа, витамины Е, В12 и фолиевая кислота.
Общие сведения
Благодаря развитию современной медицины процент выживаемости детей с III – IV степенью недоношенности увеличился на 50–70%, а с I–II степенями – до 95%. Обратной стороной ситуации явился рост случаев заболеваемости, в том числе анемией недоношенных. Её описание впервые встречается в работах Д. Шульмана, датируемых 1959 годом. Частота выявления патологии на сегодняшний день колеблется от 16 до 91%. Тяжесть течения напрямую зависит от гестационного возраста ребёнка. Чем он ниже, тем серьёзнее проявления заболевания. Так, у детей, рождённых до 30 недель с массой тела до 1,5 кг, состояния, требующие переливания эритромассы, возникают более чем в 90% случаев. У недоношенных обоих полов анемия обнаруживается с одинаковой частотой.
Анемия недоношенных
Причины
Главными причинами, обусловливающими развитие анемического синдрома, являются функциональная незрелость костного мозга и усиленный распад клеток крови, в которых располагается фетальный гемоглобин. Особое значение отводится уровню эритропоэтина – почечного гормона, играющего ключевую роль в адаптации организма в условиях тканевой гипоксии и необходимого для эритропоэза. Синтез эритропоэтина у недоношенных изначально высок, но вскоре после рождения резко снижается. Также важными моментами в развитии анемии недоношенных являются:
- Дефицит железа. Постоянно увеличивающийся общий объём крови требует немалых количеств микроэлемента, баланс которого отрицательный. Кроме того, у детей с малым сроком гестации отмечается низкая способность к использованию Fe, которое остаётся после распада эритроцитов. Срок жизни последних составляет в 2 раза меньше – около 50-70 дней. Также у недоношенных увеличено выведение железа с каловыми массами.
- Нарушение баланса фолиевой кислоты. Запасы витамина В9 у новорождённого малы, а потребность растущего организма в нем очень велика. Фолиевая кислота, продуцируемая микрофлорой кишечника и депонируемая в печени, расходуется за 2–4 недели. Недостаточность стремительно формируется и прогрессирует при дефиците фолата у матери во время вынашивания плода или в период лактации.
- Недостаточность витамина Е. Он участвует в синтезе гема и защищает мембраны эритроцитов от окисления. Его запасы также низки и составляют у доношенных около 20 мг, а у недоношенных при массе 1000 г всего 3 мг. Через кишечник витамин всасывается в крайне малом количестве. На его усвояемость неблагоприятно влияют асфиксия, инфекции и родовые травмы. Назначение средств, содержащих железо, и вскармливание коровьим молоком повышают его потребность.
Патогенез
У плода кроветворение начинается рано. До 2-х недель эритроциты синтезируются желточным мешком, до 16 недель – печенью и селезёнкой. Начиная с 20 недели, главным кроветворным органом становится красный костный мозг. Но у глубоко недоношенных детей очаги экстрамедуллярного кроветворения существуют еще в течение 1-2 месяцев после рождения. После их затухания на костный мозг ложится повышенная нагрузка, поэтому в условиях его функциональной незрелости и недостатка веществ, откладывающихся в депо на последних месяцах беременности (кобальт, медь, витамины из групп С и В), число гемоглобина в эритроцитах резко снижается.
Все ткани и внутренние органы недополучают нужного количества кислорода. Возникают дистрофические изменения кожного покрова, мочевыводящих путей, слизистых ЖКТ, поперечнополосатой мускулатуры, мышечной оболочки сердца и др. Снижается активность многих ферментных систем. Особенно стремительно анемия недоношенных развивается при наличии инфекционного поражения, внутричерепной родовой травмы и пренатальной гипотрофии.
Классификация
Заболевание может протекать в лёгкой (Hb 85-100 г/л), средней (70-84 г/л) и тяжёлой (69 г/л и ниже) форме. Лёгкая степень тяжести симптоматически может не проявляться, для остальных характерна развёрнутая клиническая картина. Тактика лечения напрямую зависит от уровня гемоглобина. Выделяются следующие фазы данной патологии:
- Ранняя. Выявляется в период с 4 по 8 недели внеутробной жизни. Возникает из-за угнетения эритропоэза и постоянно увеличивающейся массы тела, для которой требуется все большее число эритроцитов. Баланс железа сохранён или даже увеличен.
- Промежуточная. Эритропоэз восстанавливается, о чём свидетельствует появление в крови ретикулоцитов, которые ранее у ребёнка не определялись. Но разрушение эритроцитов и объём крови постоянно нарастают, расходуются запасы Fe, которых хватает на 16-20 недель.
- Поздняя. Связана с истощением депо железа и развитием Fe-дефицитной анемии. Проявления заболевания отчётливо заметны после 16-20 недели, и без должного лечения они только прогрессируют.
В педиатрии ряд авторов отдельно выделяют мегалобластную и гемолитическую анемию недоношенных. Первый тип связан с недостаточностью фолатов и их неустойчивым балансом. Второй формируется при дефиците витаминов из группы Е в период особой чувствительности эритроцитов к процессам окисления. Оба вида встречаются на протяжении с 6 по 10 недели новорожденности и не несут большой угрозы для жизни детей.
Симптомы анемии недоношенных
Клиническая картина зависит от формы и степени тяжести анемического синдрома. При показателях гемоглобина свыше 90 г/л симптоматика анемии недоношенных может отсутствовать или проявляться незначительно. Ранний тип имеет более благоприятное течение. Характерными особенностями являются ухудшение сосания груди или бутылочки со смесью, уменьшение активности движений ребёнка, прогрессирующая бледность слизистых структур и кожи, возникновение систолического шума в области верхушки сердца. Частота дыхательных движений и сердечных сокращений могут, как увеличиваться, так и уменьшаться.
Поздняя форма имеет высокие темпы развития. Она проявляется нарастающей бледностью, повышенным шелушением кожи, сонливостью, слабостью, вялостью, заторможенностью, снижением аппетита, вплоть до полного отказа от грудного или искусственного вскармливания. Тоны сердца приглушены, отмечается тахикардия, которая направлена на компенсацию гипоксического состояния путём увеличения перфузии тканей. Важными характерными симптомами В12 и фолиеводефицитной анемии являются периферическая невропатия, умеренная гепато- и спленомегалия, “лакированный” язык. При гиповитаминозе Е из клинических проявлений выделяются гемолитические кризы и отёчный синдром.
Осложнения
На современном этапе их формирование происходит крайне редко ввиду оказания своевременной медицинской помощи. Из осложнений можно встретить хроническую гипоксию тканей и внутренних органов. Она приводит к отставанию в физическом и умственном развитии, функциональной нестабильности органов желудочно-кишечного тракта и сердечно-сосудистой системы. Это сопровождается длительным расстройством стула, перепадами артериального давления и пульса, в тяжёлых случаях нарушениями сердечного ритма – экстрасистолиями, атриовентрикулярными блокадами, фибрилляцией предсердий и прочими.
Диагностика
Выявлением анемии недоношенных занимаются врачи неонатологи и педиатры. При патронаже новорожденных обращают внимание на окраску слизистых и кожных покровов, антропометрические показатели, физическое развитие. Любой подозрительный на анемию случай в обязательном порядке подтверждается результатами лабораторных тестов крови:
- Общий анализ крови. Основными диагностическими критериями являются снижение Hb, эритроцитов, сниженное или нормальное число ретикулоцитов, несколько повышенное или нормальное СОЭ. Кроме того, обнаруживается деформация эритроцитов (пойкилоцитоз) и изменение их размера (анизоцитоз). При проведении анализа на геманализаторе определяется снижение среднего размера эритроцита, среднего содержания и концентрации Hb в эритроците.
- Биохимический анализ крови. Наиболее важно его проведение в поздней фазе. Исследуют железосвязывающую способность сыворотки, уровень ферритина и железа. Последние клинические рекомендации включают определение рТФР – растворимых трансферриновых комплексов, которые снижаются при недостатке Fe.
Дифференциальную диагностику проводят с гемолитической болезнью новорождённых и другими наследственными патологиями – серповидно-клеточной анемией, талассемиями, болезнью Миньковского-Шоффара, недостаточностью ферментов пентозофосфатного цикла. Для уточнения диагноза привлекают врачей-генетиков, гематологов.
Лечение анемии недоношенных
Ранняя форма анемии активной терапии не требует, поскольку является физиологическим процессом. Для её коррекции важны нормальное питание, дополнительные источники фолатов, витаминов С, Е и В. Гемотрансфузии проводятся только при гематокрите ниже 30% и гемоглобине менее 70 г/л. Одним из эффективным лекарств, снижающих необходимость в переливании эритроцитарной массы, является человеческий эритропоэтин. При его введении потребность в Fe возрастает, что требует дополнительного назначения микроэлемента. В качестве источника антиоксидантов назначается перорально витамин Е.
Лечение поздней формы основывается на ферротерапии. Высокой эффективности и хорошей переносимости добиваются путём внутривенного введения препаратов, содержащих железо. В среднем активный курс приёма Fe составляет около 7 недель, а поддерживающий – до 1 года. Не менее важны полноценный сон, свежий воздух, лечебная гимнастика и грудное вскармливание. Введение овощного прикорма начинают с 4 месяцев, мясного – с 7 месяцев.
Прогноз и профилактика
Прогноз при грамотном подходе к лечению благоприятный, ранние и отдалённые осложнения встречаются в единичных случаях. В качестве профилактики со стороны матери важно соблюдение принципов питания, терапии токсикоза и лечения хронической патологии. Принимать фолиевую кислоту беременным рекомендуется в последнем триместре, а недоношенным детям с рождения. В первые 3 месяца жизни при низкой массе тела в форме капель используется витамин Е. Препараты Fe следует назначать на первом году жизни, начиная с 8 недели. Наблюдение педиатра осуществляется на протяжении года. Прививки недоношенным детям с анемией не противопоказаны.
