Количество генов контролирующих синтез гемоглобина

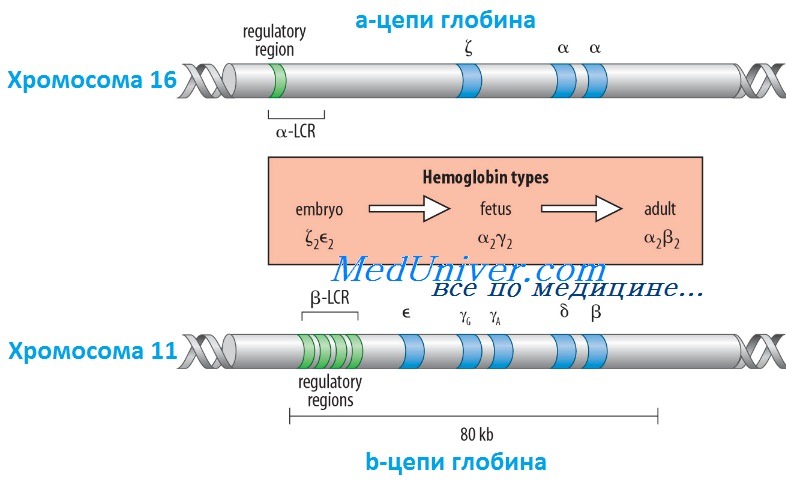
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Гемоглобин синтезируется в клетках костного мозга. Все необходимые для синтеза гемоглобина составные части поступают с током крови.
Белковая часть молекулы синтезируется как и все простые белки из аминокислот матричным способом.
Синтез гема протекает в несколько стадий под влиянием различных ферментов:
1. Вначале происходит образование дельта-аминолевулиновой кислоты. Это реакция протекает в результате конденсации сукцинил-КоА и глицина в митохондриях под действием фермента аминолевулинатсинтетазы.
2.Следующая реакция протекает в цитоплазме. Происходит образование порфобилиногена в результате реакции конденсации двух молекул дельта-аминолевулиновых кислот.
3.Затем, в результате многоступенчатых реакций из четырех монопиррольных молекул порфобилиногена образуется протопорфирин 1Х, являющийся непосредственным предшественником гема.
4. Протопорфирин IX присоединяет молекулу железа (реакция осуществляется под влиянием фермента гемсинтетазы или феррохелатазы) и образуется гем, который затем используется для биосинтеза всех гемопротеидов. Оба фермента, участвующие в синтезе ПБГ, регулируемые, они ингибируются гемом и НЬ. Поэтому гем не образуется в избытке или недостатке. Также строго в определенном количестве образуется и белковая часть Нb, т. к. ее синтез может происходить только в присутствии тема, и образующиеся полипептидные цепи тут же соединяются с гемом. При низкой концентрации гема, когда нарушается его синтез, образование гемоглобина также замедляется.
Каждая из образовавшихся полипетидных цепей глобина присоединяются кодному гему, образуя моном ер гемоглобиан. 4 таких мномера, объединивщись, образуют гемоглобин.
Основной функцией гемоглобина является перенос кислорода из легких к тканям и перенос углекислого газа от тканей к легким, участие в поддержке рН крови. Свои функции гемоглобин выполняет только в составе эритроцита. Продолжительность жизни эритроцита 110-120 дней. Затем эритроцит подвергается гемолизу
3. Распад гемоглобина. Превращение билирубина в желудочно- кишечном тракте. Свободный и связанный билирубин. Свойства.
При гемолизе эритроцитов гемоглобин попадает в кровь и соединяется с белком гаптоглобином, в виде комплекса гемоглобин-гаптоглобин (Нр-Нb) транспортируется в клетки макрофагально-моноцитарной системы (ММС): это Купферовы клетки печени, клетки лимфоузлов, селезенки, пейеровых бляшек в кишечнике.
Процесс начинается с окислительного расщепления метинового мостикамежду первым и вторым пиррольными кольцами и образуется вердоглобин. Затем от вердоглобина отщепляется глобин, железо и образуется биливердин (зеленого цвета), вещество линейной структуры. Железо соединяется с b-глобулинами и в виде трансферина доставляется в печень и селезенку, где депонируется в виде ферритина. Глобин распадается так же как и все простые белки до аминокислот.
Биливердин восстанавливается за счет НАДФН2 в неконьюгированный,
свободный билирубин, который не растворим в воде и является токсичным соединением. Свободный билирубин выходит из клеток ММС, соединяется с
альбуминами и поступает в гепатоциты. В крови он называется непрямым потому, что дает реакцию с реактивом Эрлиха не сразу, а после добавления в сыворотку крови кофеинового реактива или спирта для осаждения белка.
В Купферовых клетках печени распад гемоглобина также начинается с
образования вердоглобина, затем биливердина. В печени непрямой билирубин обезвреживается в гепатоцитах путем реакции конъюгации, соединяясь с одной или двумя молекулами глюкуроновой кислоты, образуя моно- или диглюкуронид билирубина. Такой билирубин называется конъюгированным и
связанным и прямым. Этот билирубин хорошо растовряется в воде, не обладает токсическими свойствами. Биливердин и прямой билирубин собираются в желчном пузыре, придавая желчи оливковый цвет и потому их относят к пигментам желчи. Желчь поступает в тонкий кишечник, но в желчном протоке прямой билирубин, теряя глюкуроновые кислоты, снова превращается в непрямой. Биливердин проходит через весь кишечник не изменяя своей химической структуры и удаляется с калом, окрашивая его в зеленоватый цвет, т.е. он является пигментом кала. А непрямой билирубин в кишечнике восстанавливается до мезобилиногена (уробилиногена), часть которого всасывается в воротную вену и возвращается в печень, где распадается до бесцветных моно- и дипирролов. Последние выводятся через почки вместе с мочой.
Большая часть мезобилиногена поступает в толстый кишечник, где под
влиянием ферментов микроорганизмов восстанавливается в стеркобилиноген. Часть стеркобилиногена, всасываясь в кровь через геморроидальные вены, попадает в почки. В моче под действием света и воздуха происходит окисление стеркобилиногена до стеркобилина, который придает моче желтый цвет, т.е. является пигментом мочи. Остальная часть стеркобилиногена окисляется в толстом кишечнике на свету до стеркобилина и вместе с биливердином является пигментом кала, придавая ему коричнево-зеленый цвет.
У грудных детей в кишечнике нет гнилостных бактерий, поэтому
билирубин не превращается в стеркобилиноген и выводится как таковой. Соответственно цвет кала у детей обусловлен биливердином и билирубином (желто-зеленый).
У детей в первые три месяца эмбрионального периода образуется эмбриональный гемоглобин. Затем он преобразуется в фетальный (гемоглобин F), который доминирует вплоть до рождения ребенка. После рождения в течение первого месяца жизни фетальный гемоглобин постепенно заменяется на гемоглобин взрослого (гемоглобин А), отличающегося составом полипептидных цепей. Эмбриональный и фетальный гемоглобин обладают более высоким сродством к кислороду по сравнению с гемоглобином взрослого.
Пигменты желчи, кала и мочи.
При распаде гемоглобина образуются пигменты желчи, кала и мочи.
Пигменты желчи: биливердин (зеленого цвета), связанный билирубин (глюкурониды билирубина –желтого цвета). Цвет желчи зависит от соотношения этих пигментов.
Пигменты кала: биливердин (зеленого цвета), стеркобилин (коричневого цвета)
Пигмент мочи: стеркобилин
Цвет сыворотки крови тоже зависит в определенной степени от наличия в ней билирубина. В норме количество общего билирубина в крови равно 8—20 мкмоль/л, на долю непрямого билирубина приходится 75- 100%, а прямого от 0 до 25%. Количество прямого билирубина незначительно. Прямой билирубин проходит через пачечную ткань, и появляется в моче, непрямой билирубин в моче появиться не может, вследствие его нерастворимости в воде.
Молекулы гемоглобина- тетрамеры , содержащие по 2 пары гемоглобиновых цепей различного типа.
В ходе развития организма наблюдают образование различных вариантов Нв в зависимости от экспрессии разных глобиновых типов.
Различают:
1. Эмбриональный Нb – состоит из 2ζ(дзета) цепей и 2 ε(эпсилон)
2. Фетальный Нb – состоит из 2α(альфа) и 2γ (гамма)
3. Нb взрослых – состоит из 2α(альфа) и 2 β(бетта)
В течении 2 месяца беременности снижается синтез ζ и ε цепей, а усиливается синтез α и γ.- образуется фетальный гемоглобин.
На 3 месяце беременности активируются гены β и δ (дельта) цепей глобина, тогда как концентрация γ падает, это переключение ускоряется и фетальный гемоглобин заменяется на взрослый.
Преобладающим типом гемоглобина является гемоглобинА (α2β2), α и β цепи различаются по многим аминокислотным остаткам.
У всех взрослых помимо Нв-А, еще и Нв-А2 (α2δ2), характерная для А2 δ цепь отличается от β цепи только по 10 аминокислотным остаткам.
Около 1% фетального Нв может присутствовать и во взрослом организме.
γ цепь значительно отличается от α и β и обладает бОльшим сродством к кислороду, так как плод получает кислород через плаценту(но там содержание не высокое), поэтому фетальный Нв содержит γ цепь.
Известно 2 типа γ цепей:
1) С аланином
2) С глицерином в 136 положении.
Ζ цепи похожи по аминокислотному составу на α , а ε цепей на β.
Синтез γ цепей у эмбриона происходит в печени, селезенке и костном мозге.
Синтез β цепей происходит в костном мозге.
Все глобиновые цепи имеют общее эволюционное развитие, возникают в последствии дупликации генов и их дальнейшей модификации. Синтез небелковых гемогрупп также кодируется генами(т к они кодируют структуру ферментов обеспечивающих биосинтез гемма).
Глобиновые гены распологаются в 11 и 16 хромосомах. И образуют α и β подобные кластеры.
Α подобные кластеры располагаются в коротком плече 16 хромосомы, а β подобные кластеры в коротком плече 11 хромосомы
Структурные гены расположены в порядке от 5’ к 3’ концу.
Все глобиновые гены имеют по 3 экзона(информативные участки) и 2 интрона (неинформативные участки),интроны транскрибируются вместе с экзонами, поэтому они есть в первичном транскрипте.
Процессинг- созревание первичного транскрипта( интрены вырезаются, экзона сшиваются).
Гемоглобинопатии – это группа патологических состояний, обусловленные нарушениями структуры цепей глобина (заменой одной или нескольких аминокислот в цепи глобина, отсутствие участка цепи или ее удлинением.)
Существуют четыре основных типа болезней гемоглобина:
1. Гемолитические анемии, вызванные нестабильностью гемоглобина.
2. Метгемоглобинемии, обусловленные ускоренным окислением гемоглобина.
3. Эритроцитоз, вызванный нарушением сродства гемоглобина к кислороду.
4. Серповидно-клеточные нарушения как следствие повреждений клеточных мембран эритроцитов.
Гемолитические анемии. Они вызываются нестабильными формами гемоглобина. В большинстве случаев мутация затрагивает β-цепь. У многих нестабильных гемоглобинов в полипептидной цепи обнаруживаются аминокислотные замены или делеции в участках связывания гема. Нестабильность может быть едва заметной, что не имеет никаких клинических последствий, до выраженной нестабильности, при которой происходит интенсивное разрушение эритроцитов. Нестабильность часто обусловлена преждевременной диссоциацией гема и глобиновых цепей. Точный диагноз может быть затруднен, особенно если не наблюдается изменений электрофоретической подвижности. В таком случае необходимо выделение глобиновых цепей для дальнейшего анализа в специализированных лабораториях.
Метгемоглобинемия, обусловлена ускоренным окислением двухвалентного железа до трехвалентного. Больные с мутацией в α–цепи, вызывающими образование HbМ, страдают цианозом от рождения. При мутации в β-цепи цианоз развивается только через 6 месяцев после рождения, когда происходи замена γ–цепи на β-цепь.
Эритроцитоз, вызванный образованием гемоглобинов с нарушенным сродством к кислороду. Существует около 30 гемоглобинов с повышенным сродством к кислороду.
Повышенное сродство к кислороду приводит к уменьшению количества кислорода, освобождающегося из комплекса с гемом в тканях организма, и вызывает гипоксию. Гипоксия ведет к выделению гормона эритропоэтина, стимулирующего образование эритроцитов и собственно эритроцитоз.
Было обнаружено всего три гемоглобина с уменьшенным сродством к кислороду. При таком дефекте количество кислорода, поступающее в ткани, увеличивается, поэтому следует ожидать уменьшение синтеза эритропоэтина. В двух случаях, как и следовало ожидать, наблюдалась слабовыраженная анемия.
Серповидно-клеточная анемия — это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение — так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа).
Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью и пониженной кислород-транспортирующей способностью, поэтому у больных с серповидноклеточной анемией повышено разрушение эритроцитов в селезенке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Больные серповидноклеточной анемией обладают повышенной (хотя и не абсолютной) врождённой устойчивостью к заражению различными штаммами малярийного плазмодия.
Симптомы серповидноклеточной анемии делятся на две основные категории. Из-за хрупкости красных клеток крови всегда наблюдается анемия, которая может привести к потере сознания, делает больного физически менее выносливым и может вызвать желтуху (связанную с чрезмерным распадом гемоглобина).