Компенсаторные процессы при анемии
Все
анемии сопровождаются развитием
гемической гипоксии. Срочная
адаптация:
5. Приспособительные
реакции системы внешнего дыхания:
увеличение
альвеолярной вентиляции за счет
углубления и учащения дыхания и
мобилизации резервных альвеол (вызывает
развитие дыхательного алкалоза, кривая
диссоциации НЬОг сдвигается влево и
оксигенация крови улучшается);увеличение
легочного кровотока и повышение
перфузионного давления в капиллярах
легких;возрастание
проницаемости альвео-калиллярных
мембран для газов.
6.Приспособительные
реакции в системе кровообращения:
развитие
тахикардии, увеличение ударного и
минутного объемов сердца;увеличение
массы циркулирующей крови за счет
выброса из кровяного депо;увеличение
системного артериального давления и
скорости кровотока;расширение
сосудов (под влиянием СО2, рН, аденозина).
7. Приспособительные
реакции системы крови:
усиление
диссоциации оксиНЬ за счет ацидоза;повышение
кислородной емкости крови за счет
усиления вымывания эритроцитов
из костного мозга;
8.Тканевые
приспособительные реакции:
ограничение
функциональной активности органов и
тканей, непосредственно
не участвующих в обеспечении транспорта
кислорода;увеличение
сопряжения окисления и фосфорилирования
и активности ферментов
дыхательной цепи;усиление
анаэробного синтеза АТФ за счет активации
гликолиза (накапливается
лактат, рН смещается в кислую сторону,
а кривая Баркрофта – вправо, НЪС>2
легче диссоциирует, отдавая кислород).
Долговременная
адаптация:
увеличение
силы дыхательных мышц и дыхательной
поверхности легких;гипертрофия
миокарда;активация
эритропоэза за счет усиления образования
эритропоэтинов в почках и,
возможно, других органах;увеличение
массы митохондрий.
163
3.2. Лейкоцитозы и лейкопении. Лейкозы.
Лейкоциты
–
это гетерогенная группа клеток, которые
являются основой антимикробной
защиты организма (рис. 3.2Л.)
В
клинической практике лейкоциты обычно
группируют в соответствии с морфологией
клеточного ядра (полиморфно-ядерные
и мононуклеарные) или по наличию
цито-плазматических включений (гранулоциты
и агранулоциты). Базофилы,
эозинофилы и ней-трофилы –
полиморфно-ядерные гранулоциты; лимфоциты
и моноциты –
мононуклеарные агранулоцитарные
лейкоциты.

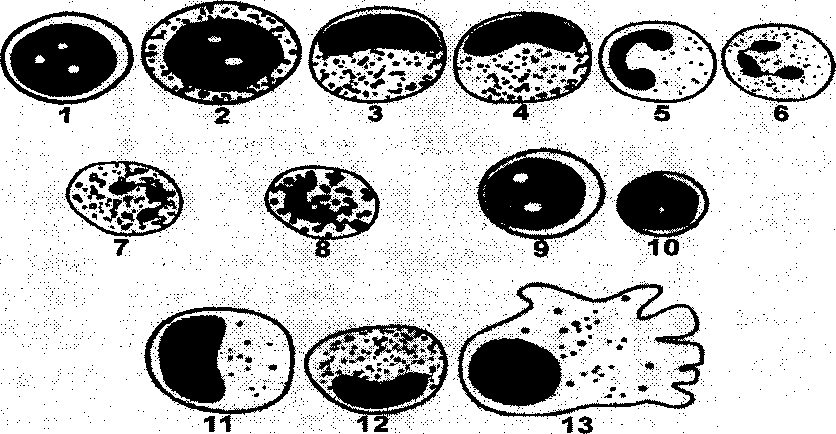
Рис.
3.2.1. Схематическое изображение различных
видов лейкоцитов. 1 – миелобласт*, 2 –
промие-лоцит,
3 – миелоцит, 4 – метамиелоцит, 5 – «юный»
или палочко-ядерный нейтрофил, 6 –
сегменто-ядерный нейтрофил,
7 – эозинофил, 8 – базофил, 9 – лимфобласт*,
10 – «зрелый» лимфоцит, 11 – промоноцит*,
12 -моноцит,
13 -макрофаг*.
*
– У
здоровых людей эти клетки локализуются
в костном мозге и обычно в мазках
периферической крови не встречаются.
Нейтрофилы
(молодые
формы – миелоциты, метамиелоцит («юные),
палочко-ядерные; зрелые формы –
сегментоядерные) представляют собой
самую большую группу циркулирующих
лейкоцитов. В крови нейтрофилы находятся
около 6-8 ч?
а затем мигрируют во внесосудистое
пространство. В очагах инфекции они
распознают, захватывают и уничтожают
бактерии.
Эозинофилы
играют
особую роль в борьбе с паразитами и
контроле аллергии; способны к хемотаксису,
фагоцитозу и обладают бактерицидной
активностью.
Базофилы
–
самая малочисленная группа циркулирующих
гранулоцитов; опосредуют аллергические
реакции, особенно 1§Е-зависимые.
Моноциты
проводят
в кровотоке всего около 20 ч, далее
мигрируют в периваску-лярные пространства,
где трансформируются в макрофаги
ретикулоэндотелиальной системы
(РЭС). Моноциты и макрофаги – долгоживущие
клетки, функциональные особенности
которых во многом схожи с таковыми у
гранулоцитов. Они более эффективно
захватывают и поглощают микобактерии,
грибки и макромолекулы; менее значима
их роль в фагоцитозе пиогенных бактерий.
В селезенке макрофаги ответственны за
утилизацию сенсибилизированных и
стареющих эритроцитов. Макрофаги играют
важную роль в про-цессинге и представлении
антигенов лимфоцитам в ходе клеточных
и гуморальных иммунных реакций.
Лимфоциты
–
небольшие мононуклеарные клетки,
осуществляющие иммунный. Лимфоциты
подразделяются на В-, Т-клетки и
клетки-киллеры. Подгруппы лимфоцитов
164
отличаются
по месту их образования и эффекторным
молекулам, но имеют общее свойство
– способность опосредовать высокоспецифический
антигенный ответ.
В
1 л крови здорового человека содержится
4-
9*109
лейкоцитов. Увеличение
концентрации лейкоцитов – лейкоцитоз,
снижение.—
лейкопения.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Компенсация железа осуществляется за счет расхода запасов (ретикулоэндотелиальных), которые хранятся в виде ферритиновых гранул в МФ костного мозга, селезенки и печени и в сидеробластах- эритробластических клетках костного мозга. Железо вновь может сохраняться в МФ при гемолизе ЭЦ при участии гемопексина путем аутофагоцитоза и эндоцитоза. Гемосидерин- малорастворимый комплекс кристаллов железа- мобилизируется медленно.
Насчет уровня запаса железа судят по уровню ферритина.
Нарушения обмена железа в организме (депо железа, суточная потребность, его транспорт). Расстройства в организме, связанные с нарушением обмена железа. Железодефицит. Этиология, патогенез, стадии. Сидеробластические анемии. Гемохроматоз, этиология, патогенез, виды
Железо не подпадает под формальный критерий микроэлементов. Выполняет свои функции в связанной с белками форме.
Важнейшие железосодержащие белки:
1. Гемопротеины (гемоглобин, миоглобин, цмтохромы, цитохромоксидаза, миелопероксидаза и т.д.)
2. Железофлавопротеины (цитохром-C-редуктаза, сукцинатдегидрогеназа, НАДФ-дегидрогеназа, ацил-КоА-дегидрогеназа, ксантиноксидаза)
3. Белки, содержащие железо различных молекулярных конфигураций, – трансферрин, ферритин, феррин, гемосидерин, мобил-феррин, лактоферрин и др.)
Функции железа:
1) Участие в энергетическом метаболизме (половина ферментов и КоФакторов цикла Кребса содержат этот железо/нуждаются в его присутствии)
2) Формирование в мозге дофаминовых рецепторов (недостаток нарушает нормальное функционирование и развитие D-рецепторов)
3) Низкий уровень железа мешает деградации ГАМК/нарушает функционирование нейронов, производящих дофамин
Потребность взрослого человека в железе – 15 мг/сутки
Всасывание и транспорт (адская хрень впереди!)
Способность организма выводить железо строго ограничена. В целом, только малая часть железа, содержащегося в продуктах, абсорбируется. Количество всосавшегося железа определяется меж- и внутри индивидуальными различиями.
Всасывание железа в основном идет в верхней части тонкого кишечника. Соляная кислота желудка и витамин С способствуют переходу железа во всасываемую, некомплексную Ферро-форму.
Железо всасывается как в виде гема (10% поглощаемого железа), так и в негемовой (9%) форме с помощью ворсинок верхней части тонкого кишечника. (рис. 1). Железо присутствует в пищевых продуктах в формах: окисной (Fe3+) и закисной (Fe2+).
Лучше всего усваивается окисное железо в составе гемина из животных продуктов.
Геминовое железо. Содержится лишь в небольшой части пищевого рациона (мясные продукты). Оно очень хорошо всасывается (на 20-30%) и на его усвоение не влияют другие компоненты пищи:
· Железо гемина свободно проходит через клетки интестинальной слизистой,
· Внутри энтероцитов гем деградирует под действием ферментов, а железо присоединяется к пулу внутриклеточного белка ферритина.
Большая часть пищевого железа – негемовое (оно содержится в основном в листовых овощах). Степень его усвоения определяется рядом факторов, которые могут, как мешать, так и способствовать абсорбции железа.
Негеминовое железо: а)
1) Всасывание негеминового ферри-железа требует связывания с кишечным муцином
a. Сначала комплекс железо-муцин фиксируется на β3-интегрине люменальной мембраны энтероцитов
b. Затем комплекс связывается с мобилферрином – цитоплазматическим белком энтероцитов (гомологом кальретикулина)
2) Белок DMT-I – обеспечивает транспорт закисного железа Fe2+ в энтероциты. Состоит из 2-x компонентов: Ферроредуктазы щеточной каймы энтероцитов, которая восстанавливает ферри-железо в ферро-форму, и лиганд ферро-железа.
a. Белок SFT – стимултор транспорта железа – обеспечивает индукцию DMT-I и секрецию мобилферрина при недостатке железа в организме
В итоге все процессы всасывания железа передают его далее на апоферритин.
В кровь из энетероцитов железо попадает через образования комплекса с базолатеральным транспортером железа – гефестином.
Схема поступления экзогенного железа в ткани.
1) В полости кишечника железо освобождается из белков и солей органических кислот пищи. (Усвоению железа способствует аскорбиновая кислота, восстанавливающая железо в ферро-Fe2+ форму)
2) В клетках слизистой оболочки кишечника избыток поступившего железа соединяется с белком апоферритином с образованием ферритина (при этом ферритин окисляет ферро Fe2+ в ферри Fe3+)
3) Поступление железа из клеток слизистой оболочки кишечника в кровь сопровождается окислением железа ферментом сыворотки крови ферроксидазой. В крови Fe3+ транспортирует белок сыворотки крови трансферрин.
4) В тканях Fe2+ используется для синтеза железосодержащих белков или депонируется в ферритине.
Трансферрин переносит железо во многие ткани:
1) В основном в костный мозг, где больше всего экспрессируется трансферриновый рецептор 1-го типа (может отрываться от поверхности клетки и циркулировать, связывая трансферрин в крови, эритропоэтин усиливает его экспрессию)
2) В печени низкоаффинный трансферриновый рецептор 2-го типа (важен для обратной связи в системе гепцидина)
В эритроидных клетках железо делится между а) митохондриями (где включается в гем) и б) белком ферритином. В миелоидных клетках часть попадает в защитный белок лактоферрин. В макрофагах включается в ферритин (в макрофаги идет железо гемолизнувших эритроцитов при участии гаптоглобина и механизмов аутофагоцитоза).
Ферритин – депо железа
При избытке железа и усилении свободно-радикальных процессов ферритин превращается в гемосидерин. Избыток гемосидерина наблюдается при усиленном разрушении эритроцитов.
Анемия (малокровие) – уменьшение в крови общего количества гемоглобина, которое, за исключением острых кровопотерь, характеризуется снижением уровня гемоглобина в единице объема крови. В большинстве случаев при анемии падает и уровень эритроцитов в крови. Однако при железодефицитных состояниях, анемиях, связанных с нарушением синтеза порфиринов, талассемии содержание эритроцитов в крови может оставаться нормальным (при талассемии – нередко повышенным) при низком уровне гемоглобина. При острых кровопотерях (массивное кровотечение или острый гемолиз) в первые часы уровень гемоглобина и эритроцитов в крови остается нормальным, хотя есть очевидные признаки малокровия – бледность кожных покровов, конъюнктив, славшиеся вены, сердцебиение и одышка при небольшой нагрузке, а в тяжелых случаях и падение артериального давления.
Анемии всегда вторичны, т. е. являются одним из симптомов какого-то общего заболевания. Наряду с часто встречающимися и легко диагностируемыми формами анемии имеются и очень редкие анемические синдромы, требующие для диагностики сложных методических приемов. Некоторые формы анемии можно диагностировать лишь в специализированных учреждениях.
Классификация. Из многочисленных классификаций, строившихся по этиологи-ческому, патогенетическому и клиническому принципу, наиболее удачными оказались патогенетические.
I. Дефицитные анемии
Преимущественно белково-дефицитные
Преимущественно витамино-дефицитные
Преимущественно железодефицитные
II. Постгеморрагические анемии
Анемии вследствие острых кровопотерь
Анемии вследствие хронических кровопотерь
III. Гипо-и апластические анемии
А. Врожденные формы
1. С поражением эритро-, лейко- и тромбоцитопоэза:
а) с врожденными аномалиями развития (тип Фанкони);
б) без врожденных аномалий развития (тип Эстрена-Дамешека)
2. С парциальным поражением гемопоэза:
а) избирательная эритроидная аплазия (тип Блекфена-Даймонда)
Б. Приобретенные формы
1.С поражением эритро-, лейко- и тромбоцитопоэза: а) острая апластическая;
б) подострая гипопластическая; в) хроническая гипопластическая;
г) хроническая гипопластическая с гемолитическим компонентом на почве аутоиммунизации
2.Парциальная гипопластическая анемия с избирательным поражением эритропоэза
IV. Гемолитические анемии
А. Наследственные
1.Мембранопатии (микросфероцитоз, элиптоцитоз, пиропойкилоцитоз, стоматоцитоз, ксероцитоз, пароксизмальная ночная гемоглобинурия и др.);
2.Ферментопатии (дефекты цикла Эмбдена – Мейергофа, пентозофосфатного цикла, обмена нуклетотидов, метгемоглобинемия)
3.Дефекты структуры и синтеза гемоглобина (серповидноклеточная болезнь и другие гемоглобинозы с аномальными гемоглобинами; талассемии, эритропорфирии).
Б. Приобретенные
1.Иммунные и иммунопатологические (изоиммунные – переливание несовместимой крови, гемолитическая болезнь новорожденных; утоиммунные, гаптеновые медикаментозные и др.);
2.Инфекционные (цитомегаловирусная и другие вирусные инфекции, бактериальные инфекции – менингококковая и др.);
3.Витаминодефицитные (Е-витаминодефицитная анемия недоношенных) и анемии, обуслов-ленные отравлениями тяжелыми металлами, ядом змей.
4.ДВС-синдром разной этиологии.
Анемией или малокровием называется уменьшение содержания эритроцитов и (или) гемоглобина в единице объема крови, часто сочетающееся с их качественными изменениями.
Основной функцией эритроцитов является перенос кислорода и углекислого газа. Эта функция становится недостаточной вследствие:
уменьшения количества эритроцитов в крови;
падения содержания гемоглобина;
появления в крови незрелых или патологически измененных эритроцитов;
наличия эритроцитов с наследственным дефектом;
потери способности гемоглобина связывать кислород и других причин.
Чаше всего в клинической практике недостаточность функции эритроцитов отмечается при анемиях.
Анемии возникают на почве:
различных заболеваний и интоксикаций;
недостатка факторов, участвующих в кроветворении;
гипоплазии костного мозга;
гемолиза эритроцитов;
кровопотерь и т. д.
При анемиях нарушается дыхательная функция крови – доставка кислорода к тканям. Потребность организма в кислороде в какой-то степени компенсируется мобилизацией защитно-приспособительных реакций, которые обычно возникают при гипоксических состояниях. В случае прогрессирующей анемии наступает тяжелая кислородная недостаточность, которая может стать причиной смерти.
Для различных видов анемий характерны не только уменьшение количества эритроцитов и гемоглобина, но и качественные изменения эритроцитов крови, степени их зрелости, размеров, формы, окраски, структуры и биохимических свойств.
Анемия – это синдром, либо самостоятельное заболевание, характеризующееся понижением содержания в крови гемоглобина, которое как правило сопровождается понижением содержания эритроцитов. Клиническая симптоматика характеризуется общими признаками для всех видов анемий: головокружение, шум в ушах, слабость, обмороки. Классификация анемий: 1. По типу эритропоэза выделяет нормобластические и мегалобластические анемии. 2. По диаметру эритроцитов выделяют нормоцитарные анемии (7,5-8,5 мкм); макроцитарные анемии (более 8,5 мкм); микроцитарные анемии (менее 7,5 мкм). 3. По цветовому показателю выделяют нормохромные анемии (0,85-1,05), гипохромные (менее 0,85) и гиперхромные (более 1,05). Цветовой показатель рассчитывается по формуле: . 4. По регенераторной способности красного костного мозга выделяют: регенераторные анемии – 0,8-10% ретикулоцитов, гиперрегенаторные – более 10% ретикулоцитов и гипорегенераторные – менее 10% ретикулоцитов. В норме содержание ретикулоцитов составляет от 0,2 до 1%. 5. По этиопатогенезу выделяют анемии: а) в следствии кровопотери. К ним относятся острая постгеморрагическая и хроническая постгеморрагическая анемии. б) в следствии нарушенного кровообразования: железодефицитная, В12 и фолиеводефицитная, гипо- и апластическая анемии. в) в следствии избыточного кроворазрушения: наследственные и приобретенные гемолитические анемии. Практически при всех видах анемий имеет место качественное изменение со стороны эритроцитов. К ним относятся: анизоцитоз, пойкилоцитоз, анизохромия, наличие патологических включений в эритроцитах (тельца Жолли и кольца Кебота), базофильная пунктация, в следствии коагуляции белков цитоплазмы, сидероциты и сидеробласты.
Железодефицитная анемия — заболевание, для которого характерно снижение уровня гемоглобина в крови. По результатам исследований в мире около 2 миллиардов людей страдают данной формой анемии разной степени тяжести.
Больше всего подвержены этому заболеванию дети и кормящие женщины: каждый третий ребенок в мире страдает анемией, практически у всех кормящих женщин наблюдается анемия различной степени.
Данная анемия первый раз была описана в 1554 году, а препараты для ее лечения первый раз были применены в 1600 году. Она является серьезной проблемой, которая угрожает здоровью общества, так как оказывает не малое влияние на работоспособность, поведение, психическое и физиологическое развитие.
Это заметно снижает социальную активность, но, к сожалению, анемия часто недооцениваются, потому что постепенно человек привыкает к уменьшению запасов железа в своем организме.
Причины железодефицитной анемии
Что это такое? Среди причин возникновения железодефицитной анемии выделяют несколько. Зачастую наблюдается комбинация причин.
Недостаток железа зачастую испытывают люди, организм которых требует повышенной дозы этого микроэлемента. Такое явление наблюдается при усиленном росте организма (у детей и подростков), а также во время беременности и кормления грудью.
Наличие достаточного уровня железа в организме во многом зависит от того, что мы едим. Если рацион питания несбалансирован, прием пищи нерегулярен, потребляются совсем не те продукты, то в совокупности все это вызовет недостаток поступления железа в организм с продуктами питания. К слову, основные пищевые источники железа — мясные: мясо, печень, рыба. Относительно много железа в яйцах, фасоли, бобах, сое, горохе, орехах, изюме, шпинате, черносливе, гранате, гречке, черном хлебе.
Почему появляется железодефицитная анемия, и что это такое? Главные причины этого недуга следующие:
- Недостаточное поступление с питанием железа, особенно у новорожденных детей.
- Нарушение процессов всасывания.
- Хронические кровопотери.
- Повышение потребности в железе при интенсивном росте у подростков, при беременности и лактации.
- Внутрисосудистый гемолиз с гемоглобинурией.
- Нарушение транспорта железа.
Даже минимальное кровотечение в 5—10 мл/сут приведет к потере 200—250 мл крови за месяц, что соответствует приблизительно 100 мг железа. И если источник скрытого кровотечения не установлен, что достаточно сложно по причине отсутствия клинической симптоматики, то через 1-2 года у больного может развиться железодефицитная анемия.
Этот процесс происходит быстрее при наличии других предрасполагающих факторов (нарушение всасывания железа, недостаточное его потребление и пр.).
Как развивается ЖДА?
- Организм мобилизует железо запаса. Анемии нет, жалоб нет, может быть выявлен дефицит ферритина при исследовании.
- Мобилизуется тканевое и транспортное железо, синтез гемоглобина сохранен. Анемии нет, появляется сухость кожи, мышечная слабость, головокружение, признаки гастрита. При обследовании выявляется дефицит сывороточного железа и снижение насыщения трансферрина.
- Страдают все фонды. Появляется анемия, снижается количество гемоглобина, а затем и эритроцитов.
Степени
Степени анемии железодефицитной по содержанию гемоглобина:
- легкая – гемоглобин не опускает ниже 90 г/л;
- средняя – 70-90 г/л;
- тяжелая – гемоглобин ниже 70 г/л.
В норме уровень гемоглобина в крови:
- у женщин – 120-140 г/л;
- у мужчин – 130-160 г/л;
- у новорожденных – 145-225 г/л;
- у детей 1 мес. – 100-180 г/л;
- у детей 2 мес. – 2 лет. – 90-140 г/л;
- у детей 2-12 лет – 110-150 г/л;
- у детей 13-16 лет – 115-155 г/л.
Вместе с тем клинические признаки тяжести анемии не всегда соответствуют степени тяжести анемии по лабораторным критериям. Поэтому предложена классификация анемий по степени выраженности клинических симптомов.
- 1 степень — клинические симптомы отсутствуют;
- 2 степень — умеренно выражены слабость, головокружение;
- 3 степень — имеются все клинические симптомы анемии, нарушена трудоспособность;
- 4 степень — представляет собой тяжелое состояние прекомы;
- 5 степень — носит название «анемическая кома», длится несколько часов и приводит к летальному исходу.
Признаки латентной стадии
Латентный (скрытый) дефицит железа в организме может привести к появлению симптомов сидеропенического (железодефицитного) синдрома. Они имеют следующих характер:
- мышечная слабость, быстрая утомляемость;
- снижение внимания, головные боли после умственной нагрузки;
- тяготение к соленому и пряному, острой пище;
- першение в горле;
- сухая бледная кожа, бледность слизистых;
- ломкость и бледность ногтевых пластин;
- тусклость волос.
Несколько позже развивается анемический синдром, тяжесть которого обусловлена уровнем гемоглобина и эритроцитов в организме, а также скоростью развития анемии (чем быстрее она развивается, тем выраженнее будут клинические проявления), компенсаторными возможностями организма (у детей и пожилых людей они менее развиты) и наличием сопутствующих заболеваний.
Симптомы железодефицитной анемии
Железодефецитная анемия развивается медленно, поэтому ее симптомы не всегда ярко выражены. При анемии часто слоятся, деформируются и ломаются ногти, секутся волосы, кожа становится сухой и бледной, появляются заеды в углах рта, появляется слабость, недомогание, головокружение, головная боль, мелькание мушек перед глазами, обмороки.
Очень часто у пациентов с анемией отмечается изменение вкуса, появляется непреодолимая тяга к непищевым продуктам, таким как мел, глина, сырое мясо. Многих начинает привлекать резкие запахи, например, бензина, эмалевой краски, ацетона. Полная картина заболевания открывается только после общего анализа крови на основные биохимические показатели.
Диагностика ЖДА
В типичных случаях диагностика железодефицитной анемии не вызывает затруднений. Нередко заболевание выявляется в анализах, сданных совсем по другому поводу.
В общем анализе крови, выполненном вручную, выявляются снижение гемоглобина, цветового показателя крови, и гематокрита. При выполнении ОАК на анализаторе изменения обнаруживаются в эритроцитарных индексах, характеризующих содержание гемоглобина в эритроцитах и размеры эритроцитов.
Выявление подобных изменений является поводом к исследованию обмена железа. Подробнее тонкости оценки обмена железа раскрыты в статье, посвященной железодефициту.
Лечение железодефицитной анемии
Во всех случаях железодефицитной анемии перед началом лечения необходимо установить непосредственную причину возникновения данного состояния и по возможности ликвидировать ее (чаще всего устранить источник кровопотери или провести терапию основного заболевания, осложнившегося сидеропенией).
Лечение железодефицитной анемии у детей и взрослых должно быть патогенетически обоснованным, комплексным и нацеленным не только на ликвидацию анемии как симптома, но и на ликвидацию дефицита железа и восполнение его запасов в организме.
Классическая схема лечения анемии:
- ликвидация этиологического фактора;
- организация правильного питания;
- прием препаратов железа;
- профилактика осложнений и рецидивов болезни.
При правильной организации вышеописанных процедур можно рассчитывать на избавление от патологии в течение нескольких месяцев.
Препараты железа
В большинстве случаев железодефицитное состояние устраняется с помощью солей железа. Наиболее доступным препаратом, которым производится лечение железодефицитной анемии на сегодняшний день является сульфат железа в таблетках, в нем содержится 60 мг железа, и принимают его 2-3 раза в день.
Хорошими всасывающимися свойствами обладают и другие соли железа, как например глюконат, фумарат, лактат. Учитывая то, что с пищей всасывание неорганического железа понижается на 20-60%, принимать такие лекарства лучше до еды.
Возможные побочные эффекты от препаратов железа:
- металлический вкус во рту;
- дискомфорт в животе;
- запор;
- диарея;
- тошнота и/или рвота.
Длительность лечения зависит от способности организма больного усваивать железо и продолжается до тех пор, пока не нормализуются лабораторные показатели крови (содержание эритроцитов, гемоглобина, цветовой показатель, уровень сывороточного железа и железосвязывающая способность).
После устранения признаков железодефицитной анемии рекомендовано применение того же препарата, но в уменьшенной профилактической дозе, так как основной направленностью лечения является не столько устранение признаков анемии, сколько восполнение дефицита железа в организме.
Диета
Диета при железодефицитной анемии представляет собой употребление продуктов, богатых железом.
Показано полноценное питание с обязательным включением в рацион продуктов, содержащих гемовое железо (телятины, говядины, баранины, мяса кролика, печени, языка). Следует помнить, что усилению ферросорбции в ЖКТ способствуют аскорбиновая, лимонная, янтарная кислота. Ингибируют всасывание железа оксалаты и полифенолы (кофе, чай, соевый протеин, молоко, шоколад), кальций, пищевые волокна и др. вещества.
Однако, сколько бы мы ни ели мяса, в кровь из него за сутки попадет всего 2,5 мг железа — именно столько способен усвоить организм. А из железосодержащих комплексов всасывается в 15—20 раз больше — вот почему с помощью одной только диеты проблему анемии не всегда получается решить.
Вывод
Железодефицитная анемия – опасное состояние, которое требует адекватного подхода к лечению. Только длительный прием препаратов железа и устранение причины кровотечения приведет к избавлению от патологии.
Чтобы избежать серьезных осложнений от лечения, следует постоянно контролировать лабораторные анализы крови на протяжении всего курса терапии заболевания.
