Кооперативность субъединиц гемоглобина во взаимодействии с кислородом
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
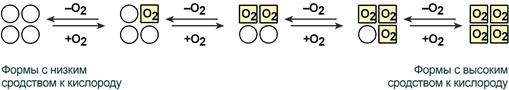
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
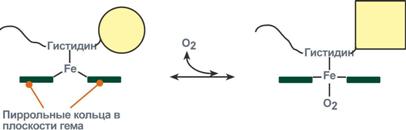
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
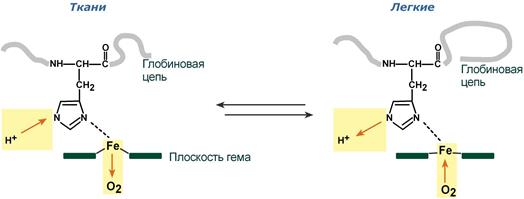
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
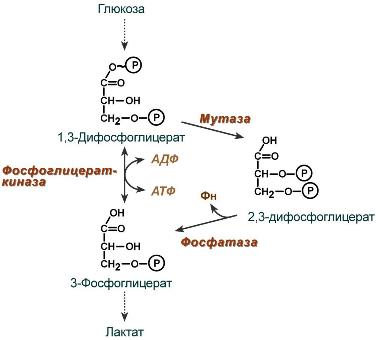
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
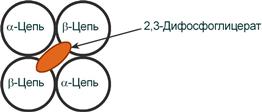
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Гемоглобин – хромопротеин, гемопротеин, железопротеин. Простетическая группа –гем(железо).
Глобин (белковая часть) является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Эта простетическая группа нековалентно связана с гидрофобной впадиной молекул глобина.
Из многообразия производных гемоглобина, представляющих несомненный интерес для врача, следует прежде всего указать на оксигемоглобин НbО2 – соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Поэтому кривая насыщения гемоглобина кислородом имеет сиг-моидную форму, свидетельствующую о кооперативности связываниякислорода. Эта кооперативность обеспечивает не только связывание максимального количества кислорода в легких, но и освобождение кислорода в периферических тканях; этому способствует также наличие Н+ и СО2 в тканях с интенсивным обменом. В свою очередь кислород ускоряет высвобождение СО2 и Н+ в легочной ткани. Эта аллостерическая зависимость между присоединением Н+, О2 и СО2 получила название эффектаБора.
2. Распад и синтез гликогена в печени. Гликогенолиз в мышцах.
Гликоген– главная форма запасания углеводов у животных и человека. Накапливается гликоген главным образом в печени (до 6% от массы печени) и в скелетных мышцах, где его содержание редко превышает 1%. Запасы гликогенав скелетных мышцах ввиду значительно большей массы последних превышают его запасы в печени. Гликоген присутствует в цитозоле в форме гранул диаметром от 10 до 40 нм. Синтез и распад гликогена регулируют содержание глюкозы в крови и создают резерв глюкозы для интенсивной мышечной работы.
Гликогенез – синтез гликогена.
Всего 4 реакции:
3
Реакция катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глю-козы.
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
Гликогенолиз – анаэробный распад гликогена.
Гликоген распадается с образованием глюкозо- 1- фостфата.
Фосфорилазы переводят полисахариды (в частности, гликоген) из запасной формы в метаболически активную форму; в присутствии фосфо-рилазы гликоген распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепления на более крупные обломки молекулы полисахарида. В общей форме эту реакцию можно представить в следующем виде:
(C6H10O5)n+ H3PO4–> (C6H10O5)n–1+ Глюкозо-1-фосфат,
Образовавшийся в результате фосфоролитического распада гликогена глюкозо-1-фосфат превращается под действием фосфоглюкомутазы в глюкозо-6-фосфат. Для осуществления данной реакции необходима фосфорилированная форма фосфоглюкомутазы, т.е. ее активная форма, которая образуется, как отмечалось, в присутствии глюкозо-1,6-бисфосфата .
Образование свободной глюкозы из глюкозо-6-фосфата в печени происходит под влиянием глюкозо-6-фосфатазы. Данный фермент катализирует гидролитическое отщепление фосфата:
3.Гормоны коры надпочечников. Их строение и механизм действия. Влияние на обмен веществ
Глюкокортикоиды: кортикостерон, кортизон, гидрокортизон(кортизоЛ), 11-дезоксикортизон, 11- дигидрокортикостерон.
Минералокортикоиды: альдостерон, дезоксикортикостерон.
Основной путь биосинтеза кортикостероидов включает последовательное ферментативное превращение холестерина(ола) в прегненолон, который является предшественником всех стероидных гормонов.
В основе структуры всех кортикостероидов лежит циклопентанпергидрофенантрен.
Установлено, что предшественником кортикостероидов является холес-терин(ол) и процесс стероидогенеза, как и нормальное гистологическое строение и масса надпочечников, регулируется АКТГ гипофиза. В свою очередь синтез АКТГв гипофизе, а значит, и кортикостероидов в корковом веществе надпочечников регулируется гипоталамусом, который в ответ на стрессовые ситуации секретирует кортиколиберин. Имеются неоспоримые доказательства быстрого (кратковременного) и медленного (хронического) действия АКТГ на надпочечники, причем в остром случае ткань железы отвечает кратковременным увеличением синтеза кортикостероидов, в то время как при хроническом воздействии АКТГотмечается его трофический эффект, который сводится к стимулированию всех обменных процессов, обеспечивающих рост и размножение клеток железы, а также продолжительное увеличение секреции стероидных гормонов.
Предполагают, что механизмы такого действия стероидов включают проникновение гормона вследствие легкой растворимости в жирах через липидный бислой клеточной мембраны, образование стероидрецепторного комплекса вцитоплазме клетки, последующее преобразование этого комплекса в цитоплазме, быстрый транспорт в ядро и связывание его с хроматином. Считают, что в этом процессе участвуют как кислые белки хроматина, так и непосредственно ДНК. В настоящее время разработана концепция о существовании в организме определенной последовательности механизма кортикостероидной регуляции обмена веществ:
ГОРМОН –> ГЕН –> БЕЛОК (ФЕРМЕНТ).
Глюкокортикоиды.
Вызывают снижение проницаемости клеточных мембран и соответственно торможение поглощения глюкозы и аминокислот; в то же время в печени они оказывают противоположное действие.
Конечным итогом воздействия глюкокорти-коидов является развитие гипергликемии, обусловленной главным образом глюконеогенезом.
Вызывают снижение синтеза гликогена в мышцах, торможение окисления глюкозы в тканях и усиление распада жиров (соответственно сохранение запасов глюкозы, так как в качестве источника энергии используются свободные жирные кислоты).
Действуют на первую стадию передачи генетической информации – стадию транскрипции, способствуя синтезу мРНК( влияние через ферментативные системы).
Минералокортикоиды:
Регулируют главным образом обмен натрия, калия, хлора и воды.
Способствуют удержанию ионов натрия и хлора в организме и выведению с мочой ионов калия. Происходит обратное всасывание ионов натрия и хлора в канальцах почек в обмен на выведение других продуктов обмена, в частности мочевины.
Известно, что период полураспада кортикостероидов составляет всего 70–90 мин. Кортикостероиды подвергаются иливосстановлению за счет разрыва двойных связей (и присоединения атомов водорода), или окислению, которое сопровождается отщеплением боковой цепи у 17-го углеродного атома, причем в обоих случаях снижается биологическаяактивность гормонов. Образовавшиеся продукты окисления гормонов коркового вещества надпочечников называют 17-кетостероидами; они выводятся с мочой в качестве конечных продуктов обмена. перейти в каталог файлов
перейти в каталог файлов
Отношение занятых кислородом участков связывания к их общему числу представляет собой степень насыщения, или просто насыщение гемоглобина кислородом, и обозначается У. Значение изменяется от (все участки свободны) до 1 (все участки заняты). График зависимости от парциального
Рис. 4.1. Модель гемоглобина при низком разрешении. а-Цепи представлены желтым, Р-цепи-синим, гем – красным. (Perutz M.F., The hemoglobin molecule, Scientific American, Inc., 1964.)
давления кислорода называется кривой диссоциации кислорода. Кривые диссоциации кислорода для гемоглобина и миоглобина различаются в двух отношениях (рис. 4.2 и 4.3). Во-первых, при любом для миоглобина насыщение выше, чем для гемоглобина. Другими словами, миоглобин обладает более высоким сродством к чем гемоглобин. Сродство к кислороду характеризуют величиной численно равной парциальному давлению кислорода, при котором насыщены 50% участков связывания Для миоглобина составляет обычно 1 торр, а для гемоглобина-26 торр.
Торр – единица давления, численно равная тому давлению, которое производит столбик ртути высотой при 0°С и стандартном ускорении силы тяжести Названа в честь Эванджелисты Торричелли (1608-1647), изобретателя ртутного барометра.
Второе различие состоит в том, что кривая диссоциации кислорода в случае миоглобина имеет гиперболическую форму, а в случае гемоглобина-сигмоидную. Как будет указано ниже, сигмоидная форма кривой идеально соответствует физиологической роли гемоглобина как переносчика кислорода в крови. На молекулярном уровне сигмоидность формы означает, что связывание кислорода гемоглобином происходит кооперативно, т. е. присоединение кислорода к одному гему облегчает его присоединение к остальным.
Рассмотрим кривые диссоциации кислорода с количественной стороны, начав с миоглобина как более простого. Связывание кислорода с миоглобином описывается следующим уравнением:
Константа равновесия процесса диссоциации оксимиоглобина составит
где концентрация оксимиоглобина, -концентрация дезоксимиоглобина, -концентрация свободного кислорода, причем все эти величины выражены в молях на литр. Степень насыщения определяется как
Производя замещения в уравнении (3) на основе равенства (2), получаем
Поскольку это газ, удобнее выражать его концентрацию в виде т.е. парциального давления кислорода (в торрах) в окружающей раствор атмосфере. Тогда уравнение (4) принимает следующий вид:
Уравнение (5) графически выражается гиперболой. В самом деле, кривая диссоциации кислорода, рассчитанная по уравнению (5) при равном 1 торр, хорошо соответствует экспериментальной кривой, полученной для миоглобина.
В отличие от этого для гемоглобина кривая диссоциации кислорода имеет
Рис. 4.2. Диссоциационная кривая кислорода для миоглобина и гемоглобина. Насыщенность участков, связывающих кислород, показана как функция парциального давления кислорода в окружающем растворе.
сигмоидную форму и не совпадает ни с одной кривой, описываемой уравнением (5). Это свидетельствует о кооперативном связывании молекулой гемоглобина. Рассмотрим крайний случай, когда имеются только дезоксигемоглобин и гемоглобин содержащий 4 связанные молекулы
Константа равновесия этой гипотетической реакции составит
и далее
Графически уравнение (8) выражается сигмоидной кривой (рис. 4.4). Заметим, однако, что расчетная кривая идет круче, чем кривая, полученная экспериментально. Другими словами, схема процесса, описанная уравнением (6), является крайностью.
Рис. 4.3. Кривая диссоциации кислорода для гемоглобина. На оси абсцисс отмечены значения характерные для капилляров работающей мышцы и для альвеол легких. Обратите внимание, что для гемоглобина в физиологических условиях лежит между этими величинами.
Рис. 4.4. Кривая насыщения гемоглобина кислородом лежит между диссоциационными кривыми, рассчитанными для (некооперативное связывание) и (полностью кооперативное связывание).
Как же тогда охарактеризовать процесс связывания с промежуточной степенью кооперативности? В 1913 г. Арчибальд Хилл показал, что кривая, построенная по данным определения связывания кислорода гемоглобином, описывается уравнением, соответствующим гипотетическому процессу
Насыщение в этом случае составит
После преобразований получим
Последнее уравнение показывает, что отношение оксигема к дезоксигему равно возведенному в степень отношению Прологарифмируем это уравнение:
Подчеркнем, что зависимость от выразится прямой с углом
наклона Такой график называется графиком Хилла, а величина наклона в точке полунасыщения кислородом составляет коэффициент Хилла.
Миоглобин дает линейный график Хилла с тогда как гемоглобин (рис. 4.5). Наклон, равный означает, что молекулы кислорода присоединяются к миоглобину независимо друг от друга, как это описано в уравнении (1). С другой стороны, коэффициент Хилла, равный 2,8, указывает на кооперативное связывание кислорода гемоглобином. Присоединение к одному гему облегчает присоединение кислорода к другим гемам того же тетрамера, и обратно: отщепление кислорода от одного гема облегчает его отщепление от остальных. Другими словами, в молекуле гемоглобина имеется взаимосвязь между темами. Кооперативность связывания кислорода гемоглобином называют иногда взаимодействием гем—гем. Механизм его мы обсудим ниже.
Рис. 4.5. График Хилла для связывания кислорода миоглобином и гемоглобином. Наклон 2,8 для гемоглобина свидетельствует о кооперативном связывании кислорода; миоглобин, напротив, связывает кислород некооперативно, о чем свидетельствует наклон кривой, равный
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 4. ГЕМОГЛОБИН: АЛЛОСТЕРИЧЕСКИЙ БЕЛОК
4.2. Кооперативность связывания кислорода гемоглобином
Отношение занятых кислородом участков связывания к их общему числу представляет собой степень насыщения, или просто насыщение гемоглобина кислородом, и обозначается У. Значение У изменяется от 0 (все участки свободны) до 1 (все участки заняты). График зависимости У от парциального давления кислорода рO2 называется кривой диссоциации кислорода. Кривые диссоциации кислорода для гемоглобина и миоглобина различаются в двух отношениях (рис. 4.2 и 4.3). Во-первых, при любом рO2 для миоглобина насыщение У выше, чем для гемоглобина. Другими словами, миоглобин обладает более высоким сродством к O2, чем гемоглобин. Сродство к кислороду характеризуют величиной Р50, численно равной парциальному давлению кислорода, при котором насыщены 50% участков связывания (т.е. У= 0,5). Для миоглобина Р50 составляет обычно 1 торр, а для гемоглобина-26 торр.
Рис. 4.2. Диссоциационная кривая кислорода для миоглобина и гемоглобина. Насыщенность участков, связывающих кислород, показана как функция парциального давления кислорода в окружающем растворе

Рис. 4.3. Кривая диссоциации кислорода для гемоглобина. На оси абсцисс отмечены значения pO2, характерные для капилляров работающей мышцы и для альвеол легких. Обратите внимание, что Р50 для гемоглобина в физиологических условиях лежит между этими величинами

Торр-единица давления, численно равная тому давлению, которое производит столбик ртути высотой 1 мм при 0°С и стандартном ускорении силы тяжести (1 мм Hg). Названа в честь Эванджелисты Торричелли (1608-1647), изобретателя ртутного барометра.
Второе различие состоит в том, что кривая диссоциации кислорода в случае миоглобина имеет гиперболическую форму, а в случае гемоглобина-сигмоидную. Как будет указано ниже, сигмоидная форма кривой идеально соответствует физиологической роли гемоглобина как переносчика кислорода в крови. На молекулярном уровне сигмоидность формы означает, что связывание кислорода гемоглобином происходит кооперативно, т. е. присоединение кислорода к одному гему облегчает его присоединение к остальным.
Рассмотрим кривые диссоциации кислорода с количественной стороны, начав с миоглобина как более простого. Связывание кислорода с миоглобином (МЬ) описы-
вается следующим уравнением:
МbO2 ⇄Мb + O2. (1)
Константа равновесия процесса диссоциации оксимиоглобина составит
![]()
где [МbO2]- концентрация оксимиоглобина, [Мb]-концентрация дезоксимиоглобина, [O2]- концентрация свободного кислорода, причем все эти величины выражены в молях на литр. Степень насыщения У определяется как
![]()
Производя замещения в уравнении (3) на основе равенства (2), получаем
![]()
Поскольку O2 – это газ, удобнее выражать его концентрацию в виде рO2, т.е. парциального давления кислорода (в торрах) в окружающей раствор атмосфере. Тогда уравнение (4) принимает следующий вид:
![]()
Уравнение (5) графически выражается гиперболой. В самом деле, кривая диссоциации кислорода, рассчитанная по уравнению (5) при Р50, равном 1 торр, хорошо соответствует экспериментальной кривой, полученной для миоглобина.
В отличие от этого для гемоглобина кривая диссоциации кислорода имеет сигмоидную форму и не совпадает ни с одной кривой, описываемой уравнением (5). Это свидетельствует о кооперативном связывании О2 молекулой гемоглобина. Рассмотрим крайний случай, когда имеются только дезоксигемоглобин и гемоглобин (Нb), содержащий 4 связанные молекулы O2:
Нb(O2)4 ⇄ Нb + 4O2. (6)
Константа равновесия этой гипотетической реакции составит
![]() (7)
(7)
и далее
![]() (8)
(8)
Графически уравнение (8) выражается сигмоидной кривой (рис. 4.4). Заметим, однако, что расчетная кривая идет круче, чем кривая, полученная экспериментально. Другими словами, схема процесса, описанная уравнением (6), является крайностью.
Рис. 4.4. Кривая насыщения гемоглобина кислородом лежит между диссоциационными кривыми, рассчитанными для n — 1 (некооперативное связывание) и n = 4 (полностью кооперативное связывание)

Как же тогда охарактеризовать процесс связывания с промежуточной степенью кооперативности? В 1913 г. Арчибальд Хилл показал, что кривая, построенная по данным определения связывания кислорода гемоглобином, описывается уравнением, соответствующим гипотетическому процессу:
Нb(O2) n ⇄ Нb + nO2. (9)
Насыщение У в этом случае составит
![]() (10)
(10)
После преобразований получим
![]() (11)
(11)
Последнее уравнение показывает, что отношение оксигема (У) к дезоксигему (1 — У) равно возведенному в n-ю степень отношению рO2 к Р50. Прологарифмируем это уравнение:
![]() (12)
(12)
Подчеркнем, что зависимость Ig [У/(1— — У)] от Ig pO2 выразится прямой с углом наклона n. Такой график называется графиком Хилла, а величина наклона n в точке полунасыщения кислородом (У=0,5) составляет коэффициент Хилла.
Миоглобин дает линейный график Хилла с n = 1, 0, тогда как гемоглобин-с n = 2,8 (рис. 4.5). Наклон, равный 1,0, означает, что молекулы кислорода присоединяются к миоглобину независимо друг от друга, как это описано в уравнении (1). С другой стороны, коэффициент Хилла, равный 2,8, указывает на кооперативное связывание кислорода гемоглобином. Присоединение O2 к одному гему облегчает присоединение кислорода к другим гемам того же тетрамера, и обратно: отщепление кислорода от одного гема облегчает его отщепление от остальных. Другими словами, в молекуле гемоглобина имеется взаимосвязь между гемами. Кооперативность связывания кислорода гемоглобином называют иногда взаимодействием гем—гем. Механизм его мы обсудим ниже.
Рис. 4.5. График Хилла для связывания кислорода миоглобином и гемоглобином. Наклон 2,8 для гемоглобина свидетельствует о кооперативном связывании кислорода; миоглобин, напротив, связывает кислород некооперативно, о чем свидетельствует наклон кривой, равный 1,0

