Кооперативные взаимодействия в гемоглобине

Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
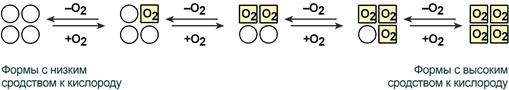
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

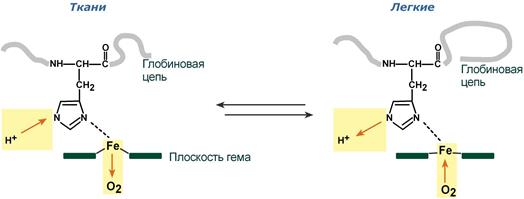
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
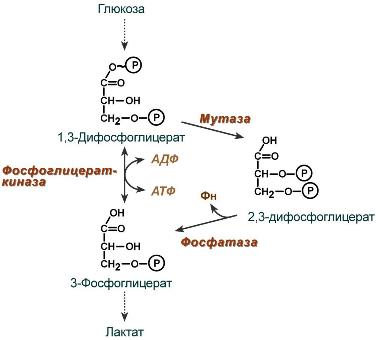
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
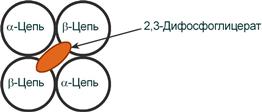
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Àâòîð òåêñòà Àíèñèìîâà Åëåíà Ñåðãååâíà.
Àâòîðñêèå ïðàâà çàùèùåíû. Ïðîäàâàòü òåêñò íåëüçÿ.
Êóðñèâ íå çóáðèòü.
Çàìå÷àíèÿ ìîæíî ïðèñûëàòü ïî ïî÷òå: exam_bch@mail.ru
https://vk.com/bch_5
Ïàðàãðàô ó÷åáíèêà ïî áèîõèìèè 59:
«×ÅÒÂÅÐÒÈ×ÍÀß ÑÒÐÓÊÒÓÐÀ ÁÅËÊλ.
(Ñì. ñíà÷àëà ï.57 è 58, çàòåì ï.6)
Ñîäåðæàíèå ïàðàãðàôà 59:
59. 1. ×åòâåðòè÷íàÿ ñòðóêòóðà áåëêîâ.
59. 2. Ñâÿçè â ÷åòâåðòè÷íîé ñòðóêòóðå.
59. 2. Ïîëîæèòåëüíàÿ è îòðèöàòåëüíàÿ êîîïåðàòèâíîñòü â îëèãîìåðàõ.
59. 2. 1. Ïðèìåð ïîëîæèòåëüíîé êîîïåðàòèâíîñòè.
59. 2 .2. Ïðèìåð îòðèöàòåëüíîé êîîïåðàòèâíîñòè.
59. 3. Îëèãîìåðíûå áåëêè è ïîëèáåëêîâûå êîìïëåêñû (ïîëèôåðìåíòíûå êîìïëåêñû).
59. 1. ×åòâåðòè÷íàÿ ñòðóêòóðà áåëêîâ.
Ãëîáóëû (ñì. ï.58) è ôèáðèëëû, èìåþùèå òðåòè÷íóþ ñòðóêòóðó,
ìîãóò ñîåäèíÿòüñÿ (íåêîâàëåíòíî îáû÷íî),
îáðàçóÿ êîìïëåêñû.
Ýòî è åñòü ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà.
Îïðåäåëåíèå:
×åòâåðòè÷íàÿ ñòðóêòóðà áåëêà
ýòî ñîåäèíåíèå (êîìïëåêñ)
èç íåñêîëüêèõ îòäåëüíûõ ïîëèïåïòèäíûõ öåïåé (ÏÏÖ),
ó êàæäîé èç êîòîðûõ îáû÷íî åñòü òðåòè÷íàÿ ñòðóêòóðà.
Êðàòêî: ÷åòâåðòè÷íàÿ ñòðóêòóðà ýòî êîìïëåêñ ãëîáóë. Èëè íèòåé-ôèáðèëë.
Òåðìèíû:
Ïðè íàëè÷èè ó áåëêà ÷åòâåðòè÷íîé ñòðóêòóðû
(à îíà íå ó âñåõ áåëêîâ åñòü, õàðàêòåðíà äëÿ ðåãóëèðóåìûõ áåëêîâ)
îòäåëüíóþ ÏÏÖ (ãëîáóëó, íàïðèìåð) íàçûâàþò ÑÓÁÚÅÄÈÍÈÖÅÉ
èëè ïðîòîìåðîì, èëè ìîíîìåðîì
(íî íå ïóòàéòå ýòè ìîíîìåðû
ñ ìîíîìåðàìè òèïà àìèíîêèñëîò â ÏÏÖ èëè ãëþêîçû â ãëèêîãåíå).
Êîìïëåêñ ñóáúåäèíèö íàçûâàþò ÎËÈÃÎÌÅÐÎÌ
(îëèãî- îçíà÷àåò íåñêîëüêî).
Îëèãîìåðû èç äâóõ ñóáúåäèíèö íàçûâàþò äèìåðàìè,
èç ÷åòûð¸õ ÒÅÒÐÀÌÅÐÀÌÈ,
èç øåñòè ãåêñàìåðàìè,
èç âîñüìè îêòàìåðàìè.
Ïðèìåð îêòàìåðà îêòàìåð ãèñòîíîâ,
íà êîòîðûé «íàìàòûâàåòñÿ» äóïëåêñ ÄÍÊ ï.73 è 74.
Ïðèìåðû òåòðàìåðîâ
ãåìîãëîáèí è ïðîòåèíêèíàçà À
(â àññîöèèðîâàííîì âèäå ï.6).
59. 2. Ñâÿçè â ÷åòâåðòè÷íîé ñòðóêòóðå.
Êàêèå ñâÿçè óäåðæèâàþò ñóáúåäèíèöû â êîìïëåêñå
è òåì ñàìûì ñòàáèëèçèðóþò ÷åòâåðòè÷íóþ ñòðóêòóðó (îëèãîìåð)?
Òå æå ñàìûå, ÷òî è òðåòè÷íóþ,
êðîìå äèñóäüôèäíûõ
êîâàëåíòíûå ñâÿçè íå õàðàêòåðíû äëÿ ÷åòâåðòè÷íîé ñòðóêòóðû,
ïîñêîëüêó âàæíî, ÷òîáû ñóáúåäèíèöû ìîãëè ñîåäèíÿòüñÿ è ðàçúåäèíÿòüñÿ.
Òå æå ñàìûå òî åñòü èîííûå, âîäîðîäíûå è ò.ä.
59. 2. Ïîëîæèòåëüíàÿ è îòðèöàòåëüíàÿ êîîïåðàòèâíîñòü â îëèãîìåðàõ.
Ñóáúåäèíèöû ìîãóò âëèÿòü íà êîíôîðìàöèþ äðóãèõ ñóáúåäèíèö îëèãîìåðîâ
è çà ñ÷¸ò ýòîãî
ìåíÿòü àêòèâíîñòü ñóáúåäèíèö
àêòèâèðîâàòü èëè èíàêòèâèðîâàòü èõ.
Ýòî âëèÿíèå îäíèõ ñóáúåäèíèö íà àêòèâíîñòü äðóãèõ ñóáúåäèíèö îëèãîìåðà
íàçûâàåòñÿ ÊÎÎÏÅÐÀÒÈÂÍÎÑÒÜÞ.
Àêòèâàöèÿ ñóáúåäèíèöû äðóãîé ñóáúåäèíèöåé (ïðè ñâÿçûâàíèè ñ íåé)
íàçûâàåòñÿ ÏÎËÎÆÈÒÅËÜÍÎÉ êîîïåðàòèâíîñòüþ,
à èíàêòèâàöèÿ ñóáúåäèíèöû äðóãîé ñóáúåäèíèöåé
íàçûâàåòñÿ ÎÒÐÈÖÀÒÅËÜÍÎÉ êîîïåðàòèâíîñòüþ.
Ïðèìåðû.
59. 2. 1. Ïðèìåð ïîëîæèòåëüíîé êîîïåðàòèâíîñòè.
Ìîëåêóëà ãåìîãëîáèíà ñîñòîèò èç ÷åòûð¸õ ñóáúåäèíèö,
òî ÿâëÿåòñÿ òåòðàìåðîì.
Ñóáúåäèíèöû ãåìîãëîáèíà àêòèâèðóþò äðóã äðóãà
(òî åñòü â òåòðàìåðå ãåìîãëîáèíà íàáëþäàåòñÿ ïîëîæèòåëüíàÿ êîîïåðàòèâíîñòü)
áëàãîäàðÿ ýòîìó àêòèâíîñòü òåòðàìåðà â 400 ðàç âûøå,
÷åì àêòèâíîñòü îòäåëüíîé ñóáúåäèíèöû
èëè ÷åì àêòèâíîñòü ìîëåêóëû ìèîãëîáèíà, ó êîòîðîé åñòü òîëüêî îäíà ñóáúåäèíèöà.
(Ìèîãëîáèí ýòî áåëîê ìûøö.
Îí òîæå ñâÿçûâàåò êèñëîðîä, êàê è ãåìîãëîáèí,
íî ãëîáóëû ìèîãëîáèíà íå îáðàçóþò îëèãîìåðû).
59. 2 .2. Ïðèìåð îòðèöàòåëüíîé êîîïåðàòèâíîñòè.
Åñòü ãðóïïà ôåðìåíòîâ, êîòîðûå êàòàëèçèðóþò ôîñôîðèëèðîâàíèå áåëêîâ
è íàçûâàþòñÿ ïðîòåèíêèíàçàìè.
Îäíà èç íèõ íàçûâàåòñÿ ïðîòåèíêèíàçîé À (ÏÊ À).
Ìîëåêóëà ïðîòåèíêèíàçû À (ñì. ï.6 è 95) òîæå ÿâëÿåòñÿ òåòðàìåðîì,
òî åñòü ñîñòîèò èç ÷åòûð¸õ ñóáúåäèíèö, êàê è ãåìîãëîáèí.
Äâå ñóáúåäèíèöû ÏÊ À
ñïîñîáíû êàòàëèçèðîâàòü ðåàêöèþ
(ôîñôîðèëèðîâàòü áåëêè)
è ïîýòîìó íàçûâàþòñÿ ÊÀÒÀËÈÒÈ×ÅÑÊÈÌÈ.
À äâå äðóãèå ñóáúåäèíèöû ïðîòåèíêèíàçû À
íå êàòàëèçèðóþò ðåàêöèè,
èõ ôóíêöèÿ ðåãóëèðîâàòü àêòèâíîñòü êàòàëèòè÷åñêèõ,
ïîýòîìó îíè ýòè ñóáúåäèíèöû íàçûâàþòñÿ ÐÅÃÓËßÒÎÐÍÛÌÈ.
Êîãäà ðåãóëÿòîðíûå ñóáúåäèíèöû ñâÿçàíû ñ êàòàëèòè÷åñêèìè,
òî êàòàëèòè÷åñêèå íå ìîãóò ðàáîòàòü
òàê êàê ðåãóëÿòîðíûå èõ èíàêòèâèðóþò
(òî åñòü ðåãóëÿòîðíûå ÿâëÿþòñÿ èíãèáèòîðàìè êàòàëèòè÷åñêèõ),
ïîýòîìó òåòðàìåð ïðîòåèíêèíàçû íå àêòèâåí.
Êîîïåðàòèâíîñòü â ïðîòåèíêèíàçå À îòðèöàòåëüíàÿ.
Êàòàëèòè÷åñêèå ñóáúåäèíèöû ìîãóò ðàáîòàòü òîëüêî òîãäà,
êîãäà ðåãóëÿòîðíûå îòñîåäèíÿþòñÿ îò íèõ.
Îòñîåäèíåíèå ðåãóëÿòîðíûõ îò êàòàëèòè÷åñêèõ
(è â èòîãå àêòèâàöèÿ ïðîòåèíêèíàçû À)
ïðîèñõîäèò òîãäà,
êîãäà ñ ðåãóëÿòîðíûìè ñóáúåäèíèöàìè ñâÿçûâàåòñÿ öÀÌÔ.
Ïîýòîìó öÀÌÔ ñ÷èòàåòñÿ àêòèâàòîðîì ïðîòåèíêèíàçû À.
Òàêèì îáðàçîì, ïðè ïîëîæèòåëüíîé êîîïåðàòèâíîñòè îëèãîìåðû àêòèâíåå ñóáúåäèíèö,
à ïðè îòðèöàòåëüíîé êîîïåðàòèâíîñòè îëèãîìåðû íå àêòèâíû.
59. 3. Îëèãîìåðíûå áåëêè
è ïîëèáåëêîâûå êîìïëåêñû (ïîëèôåðìåíòíûå êîìïëåêñû).
Îëèãîìåðíûå áåëêè ýòî áåëêè, êîòîðûå îáðàçóþò îëèãîìåðû.
Î íèõ âûøå.
Íåêîòîðûå áåëêè îáðàçóþò êîìïëåêñû èç ìíîæåñòâà ÏÏÖ (îáû÷íî ãëîáóë).
Ýòî è åñòü ïîëèáåëêîâûå êîìïëåêñû.
Åñëè ýòî êîìïëåêñ ôåðìåíòîâ, òî îí íàçûâàåòñÿ ïîëèôåðìåíòíûì êîìïëåêñîì.
Ïðèìåð òàêîãî êîìïëåêñà ïèðóâàò/äåãèäðîãåíàçíûé êîìïëåêñ (ÏÄÃ),
êàòàëèçèðóþùèé ïðåâðàùåíèå ïèðóâàòà â àöåòèëÊîÀ (ï.32, 20).
 ýòîì êîìïëåêñå îáúåäèíåíû ôåðìåíòû,
êîòîðûå êàòàëèçèðóþò ïîñëåäîâàòåëüíîñòü ðåàêöèé.
×òî äà¸ò îáúåäèíåíèå áåëêîâ â êîìïëåêñ? ïîâûøåíèå ýôôåêòèâíîñòè ðàáîòû.
Ãëîáóëû îòäåëüíûõ ôåðìåíòîâ ïåðåäàþò äðóã äðóãó ìåòàáîëèòû, ðàáîòàÿ êàê êîíâåéåð.
Гемоглобин связывает и передает тканям за сутки около 600 л О2, в тканях образуется примерно 500 л СО2, который выводится из организма при участии гемоглобина.
Скорость оксигенирования и транспорт кислорода из лёгких в ткани зависит от изменений сродства гемоглобина к О2.
Присоединением О2 к одному из протомеров гемоглобина в лёгких при высоком рО2, (100 мм рт. ст.) вызывает конформационные изменения во всей олигомерной структуре гемоглобина и облегчает присоединение последующих молекул О2. Это явление носит название кооперативных изменений гемоглобина или кооперативного связывания О2, благодаря которому гемоглобин максимально связывает О2 в легких и легко отдает О2 в периферических тканях при более низких значениях рО2 (рис кривая насыщения миоглобина и гемоглобина).
Давление в капиллярах Давление в лёгочных
работающей мышцы а л ь в е о л а х
Рис.Кривые насыщения (диссоциации) миоглобина и гемоглобина кислородом.
Кривая насыщения для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на кооперативное связывание О2 (в легких при высоком рО2) и освобождении О2 (в тканевых капиллярах при более низком рО2).
Эффект Бора
Гемоглобин не только переносит О2 от легких к периферическим тканям, но и ускоряет транспорт СО2 и протонов от тканей к легким.
Эффект Бора – это влияние концентрации СО2 и Н+ на сродство гемоглобина к О2.
Увеличение концентрации протонов и СО2 снижает сродство О2 к гемоглобину и усиливает транспорт О2 в ткани. Разные органы потребляют неодинаковые количества кислорода. Наиболее активно извлекают кислород из крови работающие мышцы (до 85%).
Если гемоглобин насыщен кислородом почти на 100%, то все молекулы гемоглобина находятся в R-форме, Нb(О2)4. Такое состояние гемоглобина возникает при высоком парциальном О2в капиллярах легких (100 мм рт. ст.) и при высоком сродстве Нb к О2. В капиллярах мышц и других тканей более низкое парциальное давление О2 , в этих условиях от гемоглобина могут отщепляться молекулы О2 и поступать в ткани. Например, при парциальном давлении кислорода в капиллярах 40 мм рт. ст. гемоглобин имеет насыщение ≈ 65%.
Далее действуют другие факторы, приводящие к снижению сродства гемоглобина к О2, тем самым увеличивая доставку кислорода в ткани:
а) гемоглобин протонируется, связывая три пары Н+ в пептидных цепях гемоглобина, вновь формируется Т-структура;
б) гемоглобин обратимо присоединяет часть СО2 (до 15%) к концевым аминогруппам пептидных цепей, образуется карбогемоглобин: R-NH-COO- +Н+, где R-белковая цепь гемоглобина. Это также снижает сродство гемоглобина к О2. Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3 -.
Таким образом, диоксид углерода, образовавшийся в тканях реагирует с водой, образуя угольную кислоту, которая диссоциирует на бикарбонат- ион и Н+. Синтез углекислоты, как и её разложение на СО2 и Н2О происходит при участии фермента карбоангидразы. В периферических тканях гемоглобин отдает О2, сам протонируется и связывает часть СО2, его R-форма переходит в Т-форму, сродство к О2 резко снижается. В легких происходят обратные процессы.
Влияние 2,3-БФГ на сродство гемоглобина к кислороду
2,3-биcфосфоглицерат (2,3-дифосфоглицерат) – образуется в эритроцитах в ходе анаэробного гликолиза из промежуточного соединения 1,3-биcфосфоглицерата. 2,3-БФГ является аллостерическим регулятором гемоглобина (от греч. «аллос» – другой), он соединяется ионными связями с дезоксигемоглобином не в области гема, а в другом участке, т. е. аллостерическом центре, содержащим положительно заряженные радикалы аминокислот Лиз 82 и Гис 143 β-цепей.
Структура 2,3-бифосфоглицерата
Образовавшиеся дополнительные солевые мостики (или ионные связи) делают структуру дезоксигемоглобина ещё более жесткой и поэтому сродство Нb к О2 снижается. Концентрация 2,3-БФГ в крови близка к концентрации гемоглобина и одинакова в артериальной и венозной крови. 2,3-БФГ реагирует только с дезоксигемоглобином, т. е. Т-формой, т. к. он имеет доступную центральную полость с центром связывания 2,3-БФГ. В оксигемоглобине (R-форма) эта полость закрыта.
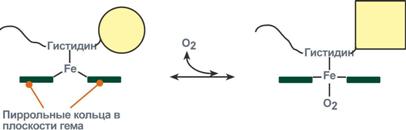
О2 связывается с протомерами гемоглобина через Fe2+ , который соединён с четырьмя атомами азота пиррольных колец тема и атомом азота
Рис. 1-32. Строение гемоглобина.
Гис F8 белковой части протомера. Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с О2, но обеспечивает оптимальные условия для его связывания (рис. 1-33).
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fe2+ выступает из плоскости гема в направлении Гис F8. Присоединение О2 к атому Fe2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Так как протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы О2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы О2. Четвёртая молекула О2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1-34).
Рис. 1-33. Изменение прложения Fe2+ и белковой части гемоглобина при присоединении О2.
Рис. 1-34. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2.
Изменение конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул О2.
Кривые диссоциации О2 для миоглобина и гемоглобина
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации О2 для миоглобина и гемоглобина (рис. 1-35).
Отношение занятых О2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки О2 при различных значениях парциального давления кислорода.
Кривая диссоциации О2 для миоглобинаимеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы (схема ниже).
Схема
Рис. 1-35. Кривые диссоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода.
Процессы образования и распада оксимиоглобина находятся в равновесии, и это равновесие смещается влево или вправо в зависимости от того, добавляется или удаляется кислород из системы. Миоглобин связывает кислород, который в капиллярах тканей высвобождает гемоглобин, и сам миоглобин может освобождать О2 в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании О2 в результате физической нагрузки.
Миоглобин имеет очень высокое сродство к О2. Даже при парциальном давлении О2, равном 1-2 мм рт. ст., миоглобин остаётся связанным с О2 на 50%.
Кривая диссоциации О2 для гемоглобина.Из графика на рис. 1-35 видно, что гемоглобин имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около 26 мм рт. ст.).
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше О2 отдают протомеры, тем легче идёт отщепление последующих молекул О2.
В капиллярах покоящихся мышц, где давление О2 составляет около 40 мм рт. ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе давление О2 в капиллярах мышц падает до 10-20 мм рт. ст. Именно в этой области (от 10 до 40 мм рт. ст.) располагается “крутая часть” S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы протомеров.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин – присоединять О2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин – присоединять О2 в лёгких, где его насыщение доходит до 100%, и отдавать О2 в капиллярах тканей в зависимости от изменения в них давления О2
4. Перенос Н+ и С02 из тканей в лёгкие
с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада – СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3-
СО2 + Н2О – H2CO 3 – H+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух ?-цепей, радикалам Гис122 и концевым ?-аминогруппам двух ?-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление О2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СО2 + Н2О – Н2СО3 – Н+ + НСО3- сдвигается влево и образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б). Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство О2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3-. Небольшое количество
Рис. 1-36. Перенос Н+ и СО2 с кровью. Эффект Бора. А – влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б – оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
Рис. 1-37. Влияние рН на кривую диссоциации О2 для гемоглобина.
СО2 (около 15-20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым ?-аминогруппам. R-NH2+ СО2 = R-NH-COO + Н+, в результате образуется карбогемоглобин, где R – полипептидная цепь гемоглобина. Присоединение СО2 к гемоглобину также снижает его сродство к О2.
5. 2,3-Бифосфоглицерат – аллостертеский регулятор сродства гемоглобина к О2
2,3-Бифосфоглицерат (БФГ) – вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
