Кривая оксигенации гемоглобина и миоглобина

Почему
миоглобин не способен транспортировать
кислород, но зато активно его запасает?
Для миоглобина изотерма адсорбции
кислорода имеет форму гиперболы. Давление
О2
в ткани, окружающей легочные капилляры,
составляет 100 мм рт.ст., поэтому миоглобин
в легких мог бы весьма эффективно
насыщаться кислородом. В венозной крови
Р О2
равно 40 мм рт. ст., а в активно работающей
мышце – 20 мм рт.ст. Но даже при парциальном
давлении 20 мм рт. ст. степень насыщения
миоглобина кислородом будет весьма
значительна, и поэтому миоглобин не
может служить транспортной молекулой
для доставки О2
от легких к периферическим тканям.
Однако при кислородном голодании,
которым сопровождается тяжелая физическая
работа, парциальное давление О2
в тканях может понизиться и до 5 мм
рт.ст.; при столь низком давлении миоглобин
легко отдает кислород, обеспечивая тем
самым окислительный синтез АТФ в
митохондриях мышечных клеток.
Кинетика
оксигенирования гемоглобина коренным
образом отличается от кинетики
оксигенирования миоглобина. Кривая
насыщения гемоглобина О2
имеет сигмоидальную форму. Т.о., способность
гемоглобина связывать О2
зависит от того, содержатся ли в данном
тетрамере другие молекулы О2.
Если да, то последующие молекулы О2
присоединяются легче. Для гемоглобина
характерна кинетика кооперативного
связывания, благодаря которой он
связывает максимальное количество О2
в легких и отдает максимальное количество
О2
при тех значениях Р О2
, которые имеют место в периферических
тканях.
Сродство
гемоглобинов к О2
характеризуется величиной Р50-
значением парциального давления О2,
при котором наблюдается полунасыщение
гемоглобина кислородом. Например, для
HbA
Р50
= 26 мм рт.ст., а для HbF
– 20 мм рт. ст. Благодаря этой разнице
гемоглобин F
отбирает кислород у HbA,
находящегося в плацентарной крови.
2)
У олигомерных белков имеется специальный
центр, отличный от активного, к которому
присоединяется аллостерический лиганд.
Этот центр получил название аллостерического.
Рассмотрим
аллостерическую регуляцию на примере
HbА.
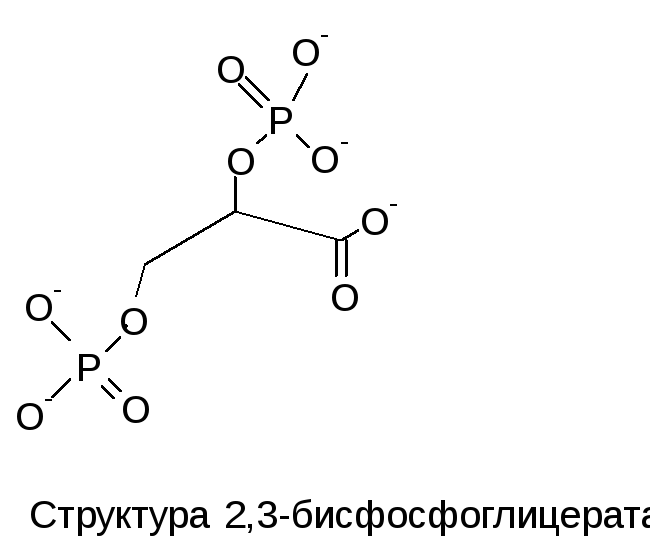
В центре молекулы HbА
находится полость, которая является
местом присоединения 2,3-ДФГ. Это соединение
накапливается в эритроцитах при
недостатке О2.
Непосредственным предшественником
служит 1,3-дифосфоглицерат – промежуточный
продукт гликолиза. 2,3-ДФГ имеет сильный
отрицательный заряд и взаимодействует
с 5 положительно заряженными группами
аллостерического центра. В результате
взаимодействия образуется 5 дополнительных
ионных связей, что снижает сродство Hb
к кислороду и облегчает его отдачу в
ткани.
Кооперативные
изменения конформации олигомерных
белков составляют основу механизма
регуляции функциональной активности
не только Hb,
но и большого числа других белков, в том
числе аллостерических
ферментов.
5. Изофункциональные белки
Белок,
выполняющий определенную функцию в
клетке, может быть представлен несколькими
формами – изофункциональными белками
или изобелками.
Такие белки хоть и выполняют одинаковую
функцию, но отличаются константой
связывания, что приводит к некоторым
различиям в функциональном отношении.
Например, в эритроцитах человека
обнаружено несколько форм гемоглобина:
HbA
(96%), HbF
(2%), HbA2
(2%).
Все гемоглобины представляют собой
тетрамеры, построенные из протомеров
,
,
,
(HbA
-22,
HbF
– 22,
HbA2
– 22).
Все протомеры сходны между собой по
первичной, вторичной и третичной
структурам. Все формы гемоглобинов
предназначены для переноса кислорода
в клетки тканей, но HbF,
например, имеет большее сродство к
кислороду, чем HbA.
HbF
характерен для эмбриональной стадии
развития человека. Он способен отнимать
кислород у HbA,
что обеспечивает нормальное снабжение
кислородом плода.
Изобелки
– это результат наличия более чем одного
структурного гена в генофонде вида.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
а) Факторы, сдвигающие кривую диссоциации оксигемоглобина. Их значение для транспорта кислорода. Кривые диссоциации оксигемоглобина (для облегчения понимания просим вас изучить рисунки ниже) справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
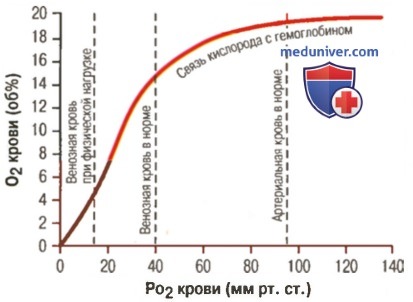
Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови
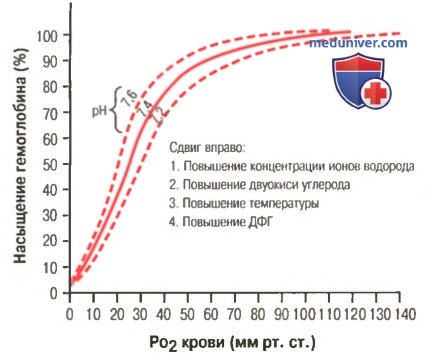
Сдвиг кривой диссоциации оксигемоглобина вправо в результате повышения концентрации ионов водорода (снижения pH). ДФГ — 2,3-дифосфоглицерат
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
б) Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается PO2, а затем концентрации угольной кислоты (H2CO3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз (для облегчения понимания просим вас изучить рисунок выше), уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются PCO2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного PO2, что увеличивает транспорт кислорода к тканям.
в) Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при PO2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
г) Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне PO2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
– Также рекомендуем “Участие кислорода в метаболизме. Метаболическое потребление кислорода”
Оглавление темы “Кислород и его доставка в организме”:
1. Диффузия газов через дыхательную мембрану. Дыхательная мембрана
2. Емкость дыхательной мембраны. Диффузионная емкость для кислорода
3. Вентиляционно-перфузионный коэффициент. Парциальное давление кислорода и двуокиси углерода
4. Концепция физиологического шунта. Концепция физиологического мертвого пространства
5. Обмен кислорода в организме. Транспорт кислорода из легких в ткани
6. Транспорт кислорода артериальной кровью. Диффузия кислорода
7. Гемоглобин. Роль гемоглобина в транспорте кислорода
8. Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях
9. Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
10. Участие кислорода в метаболизме. Метаболическое потребление кислорода
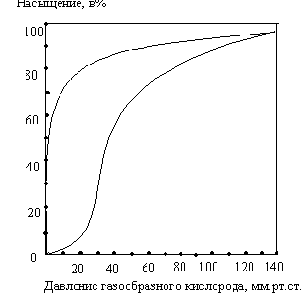
Особые свойства молекулы гемоглобина, которые делают его столь эффективным переносчиком кислорода в крови, легче всего уяснить из сравнения миоглобина и гемоглобина в отношении их сродства к кислороду. На рис. 8-16 показаны кривые насыщения кислородом для гемоглобина и миоглобина, характеризующие степень насыщения этих белков кислородом (т.е. отношение числа участков молекулы, связывающих кислород, к общему числу участков, способных к такому связыванию) в зависимости от парциального давления газообразного кислорода, находящегося в равновесии с раствором белка.
Рис. 8-15. Фоток рафия нормальных эритроцитов человека, полученная при помощи сканирующего электронного микроскопа.
Прежде всего из графика ясно, что миоглобин имеет очень высокое сродство к кислороду: при парциальном давлении кислорода, равном всего лишь 1-2 мм рт. ст., он уже на 50% насыщен кислородом. Кроме того, мы видим, что кривая насыщения миоглобина кислородом имеет вид простой гиперболы, как и следует ожидать из закона действующих масс применительно к равновесной реакции:
При парциальном давлении кислорода, равном 20 мм рт. ст., миоглобин оказывается насыщенным кислородом более чем на 95%. В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду; кроме того, кривая насыщения гемоглобина кислородом имеет сигмоидную, т.е. S-образную, форму (рис. 8-16). Это означает, что при связывании первой молекулы кислорода (нижняя часть S-образной кривой, соответствующая парциальным давлениям кислорода ниже 10 мм рт. ст.), гемоглобин имеет очень низкое сродство к кислороду, тогда как при связывании следующих молекул кислорода его сродство к ним становится намного выше, о чем свидетельствует крутая часть -образной кривой.
Рис. 8-16. Кривые насыщения кислородом для миог лобина и гемоглобина. Миоглобин обладает намного более высоким сродством к кислороду, чем гемоглобин. 50%-ное насыщение миоглобина кислородом достигается уже тогда, когда парциальное давление О, составляет всего 1 -2 мм рт. ст., тогда как для гемоглобина такое насыщение кислородом наступает лишь при парциальном давлении кислорода около 26 мм рт. ст. Обратите внимание, что в артериальной крови, вытекающей из легких (при парциальном давлении кислорода около 100 мм рт. ст.) оба белка – и миоглобин и гемоглобин – насыщены кислородом более чем на 95 %„ тогда как в покоящейся мыщце, где парциальное давление кислорода равно 40 мм рт. ст., гемоглобин насыщен кислородом лишь на 75%, а в работающей мышце при парциальном давлении кислорода всего около 10 мм рт. ст. только на 10%. Таким образом, гемоглобин очень эффективно отдает свой кислород в мышцах и других периферических тканях. Что же касается миоглобина, то при парциальном давлении кислорода, равном всего 10 мм рт. ст„ он все еще остается насыщенным кислородом почти на 90% и поэтому даже при столь низких парциальных давлениях кислорода отдает очень малую часть связанного с ним кислорода. Таким образом, сигмоидная кривая насыщения гемоглобина кислородом является результатом молекулярной адаптации гемоглобина к выполнению им транспортной функции в составе эритроцитов.
Фактически после связывания первой молекулы кислорода сродство повышается почти в 500 раз. Таким образом, четыре гемсодержащие полипептидные субъединицы гемоглобина различаются по степени их сродства к кислороду и зависят друг от друга в процессе его связывания.
Как только первая гемсодержащая полипептидная субъединица свяжет молекулу кислорода, она передает информацию об этом остальным субъединицам, у которых сразу же резко повышается сродство к кислороду. Такой обмен информацией между четырьмя гемсодержащими полипептидными субъединицами гемоглобина обусловлен кооперативным взаимодействием между субъединицами. Поскольку связывание первой молекулы кислорода одной из субъединиц гемоглобина увеличивает вероятность связывания следующих молекул кислорода остальными субъединицами, мы говорим, что гемоглобин имеет положительную кооперативностъ. Для положительной кооперативности характерны сигмоидные кривые связывания, подобные кривой насыщения гемоглобина кислородом. При связывании кислорода миоглобином, содержащим одну гемогруппу, молекула белка может присоединить только одну молекулу кислорода; в этом случае кооперативного связывания не наблюдается и кривая насыщения имеет вид простой гиперболы. Теперь мы понимаем. почему миоглобин и гемоглобин столь сильно различаются между собой по кислород-связывающей способности.
Мы будем использовать термин лиганд для обозначения специфической молекулы, связывающейся с белком; это может быть, например, молекула кислорода, если речь идет о гемоглобине (слово «лиганд» происходит от латинского слова, которое переводится как «связывать», «присоединять» и буквально означает «то, что присоединяется»). Многие другие олигомерные белки тоже имеют по нескольку лиганд-связывающих центров и, подобно гемоглобину, проявляют положительную кооперативность. Однако есть олигомерные белки, проявляющие отрицательную кооперативность: в этом случае связывание одной молекулы лиганда уменьшает вероятность связывания других молекул лиганда.
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |


