Механизм буферного действия гемоглобин оксигемоглобин

Самая мощная буферная система. На ее долю приходится 75% всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислоты.
Состав гемоглобинового буфера можно выразить так:
Гемоглобиновая буферная система состоит из HHb гемоглобина, который является слабой кислотой и его калиевой соли – и оксигемоглобиновой буферной системы .
Системы гемоглобина и оксигемоглобина взаимопревращающиеся системы и работают как единое целое.
При насыщении гемоглобина кислородом гемоглобин становится более сильной кислотой – HНbО2 и увеличивает отдачу в раствор ионов водорода.
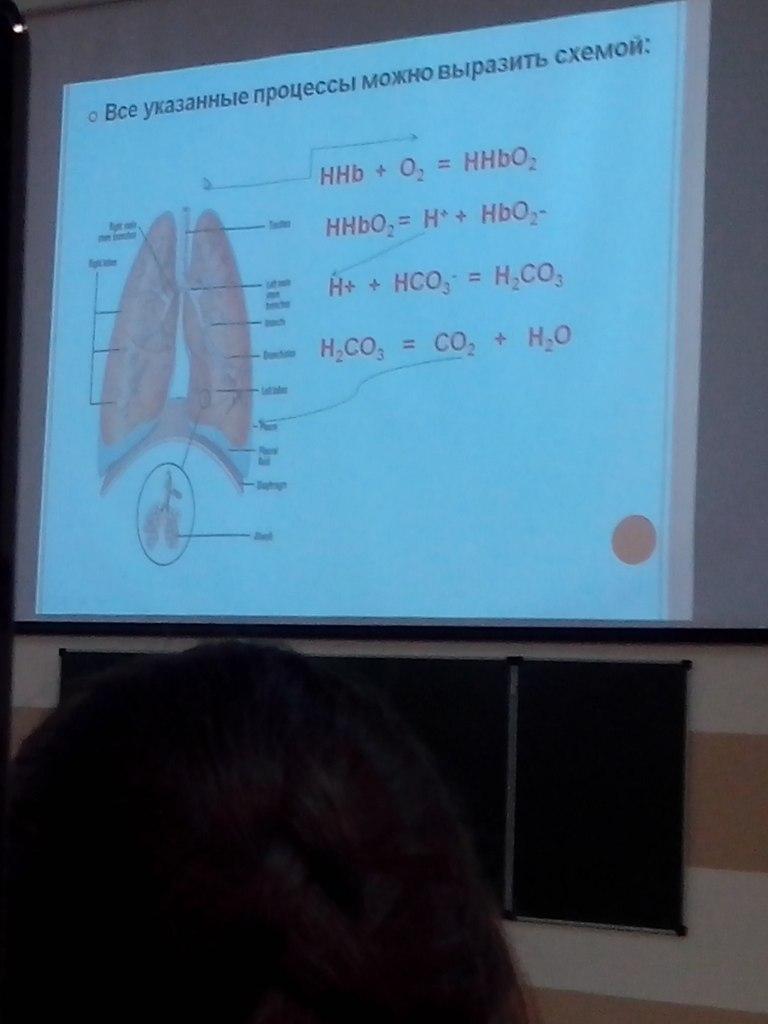
В капиллярах легких, гемоглобин присоединяет кислород и превращается в оксигемоглобин:
HHb + О2 HНbО2
Образование оксигемоглобина приводит к некоторому подкислению крови, вытеснению части угольной кислоты из бикарбонатов:
HНbО2 + КНСО3 КНbО2 + Н2СО3
Щелочной резерв крови понижается.
В периферических капиллярах большого круга кровообращения калиевая соль оксигемоглобина диссоциирует и гемоглобин эритроцитов отдает кислород тканям:
КНbО2 О2 + КНb
В результате способность гемоглобина связывать ионы водорода увеличивается. Одновременно в эритроциты поступает углекислый газ. Под влиянием фермента карбангидразы углекислый газ взаимодействует с водой с образованием угольной кислоты:
СО2 + Н2О Н2СО3
За счет угольной кислоты возникает избыток ионов водорода, который связывается с калиевой солью гемоглобина, отдавшей кислород:
КbHb + Н2СО3 К+ + + HHb
В результате этого процесса накапливаются анионы , которые выходят из эритроцитов в плазму. В обмен на ионы в эритроциты поступают ионы хлора, а натрий остается в плазме. В плазме повышается содержание бикарбоната и это способствует восстановлению щелочного резерва крови.
Взаимодействие буферных систем и физиологических механизмов в регуляции КЩР.
Кислые продукты нейтрализуются бикарбонатной и гемоглобиновой системами. Буферные основания и КНbО2 связывают протоны и переходят в Н2СО3 и ННb. В легких фермент карбоангидраза разлагает Н2СО3 на СО2 и Н2О. Углекислота удаляется из организма с вдыхаемым воздухом, а ННb переходит в КНbО2. восполнение дефицита ионов бикарбоната, а также удаление из организма кислых продуктов в виде кислы фосфатов и солей аммония осуществляют почки.
Роль почек в регуляции КЩР.
В клетках эпителия почечных канальцев из СО2 и Н2О под действием карбоангидразы образуется угольная кислота, которая диссоциирует на ионы Н+ и . Протоны секретируются в просвет канальцев, а ионы бикарбоната поступают в кровь, восполняя дефицит -ионов. С секрецией Н+ сопряжена реабсорбция ионов Na+.
Судьба ионов Н+, попавших в мочу.
1. Н+ + Н2СО3
2. Н+ + – выводится
3. Н+ + N+Н4 ( + Сl + Na NH4Cl +Na ).
Ионы и обусловливают кислую реакцию мочи и в составе кислых фосфатов и солей аммония выводятся из организма.
По механизму
1. Метаболический
2. Респираторный (газовый)
Метаболический ацидоз – много кислых продуктов (кетоновые тела, лактат, пируват). Наблюдается при голодании, диабете, лихорадке, нарушении кровообращения, поражении почек.
Респираторный (газовый) ацидоз наблюдается при заболеваниях легких (бронхиты, пневмонии), недостаток кровообращения.
По компенсации:
1. Компенсаторный, рН в N, но меняются другие показатели КЩР.
2. Декомпенсированный – ацидотическая кома.
Алкалоз – состояние дефицита ионов водорода в крови.
Метаболический алкалоз – дефицит ионов Н+ в крови, сочетается со снижением содержания ионов К+ в крови.
Компенсация метаболического алкалоза осуществляется дыхательным и почечным путем (снижение вентиляции с повышением СО2 и увеличением экскреции бикарбоната почками).
Причины: дефицит калия, понос, рвота, инфекции ЖКТ, длительное введение стероидных гормонов. Бывает компенсированный и реже декомпенсированный.
Дыхательный алкалоз – избыточное выведение Н2СО3. возникает при быстром удалении СО2 и сопровождается развитием гипокапнии (понижение парциального давления СО2 в артериальной крови – менее 35 мм рт. столба).дыхательный алкалоз наблюдается при вдыхании чистого кислорода, при подъеме на высоту, при компенсаторной одышке.
Бывает компенсированный.
Причины гипопротеинемий
Задержка воды в организме при отеках на почве цирроза печени, потеря белков с мочой при нефритах, угнетение синтеза белков (при длительных инфекционных заболеваниях, при раковой кахексии, при голодании).
Причины гиперпротеинемий
Потеря больших количеств воды при диарее, неукротимой рвоте, тяжелых травмах ожогах. Это относительная гиперпротеинемия. Абсолютная гиперпротеинемия обусловлена резким нарастанием иммуноглобулинов и патологических белков. (миеломная болезнь).
Строение молекулы Ig.
Молекула Ig состоит из 4 полипептидных цепей: 2 тяжелых – Н-цепи и 2 легких – L-цепи. Легкие и тяжелые цепи соединены дисульфидными мостиками. Легкие цепи Ig бывают 2 видов: каппа и лямбда. Тяжелые цепи определяют специфичность Ig и различаются по аминокислотному составу. Различают 5 типов тяжелых цепей: IgG – , IgA – , IgM – , IgD – . На легких и тяжелых цепях выделяют вариабельные и константные участки. Вариабельные участки у иммуноглобулинов, направленных против различных АГ различны.
Для связывания АГ на молекуле Ig имеются активные центры.
А.ц. образован V-участками легкой и тяжелой цепи. Разрыв S-S между цепями приводит к исчезновению активных центров. На молекуле Ig два активных центра, т.е. Ig бивалентны.
А.ц. – щель, которая комплементарна молекуле АГ. Комплементарность стереоспецифическая и электрохимическая.
В молекуле Ig имеется шарнирный участок – это середина Н-цепей. Шарнирный участок не имеет вторичной структуры, здесь находится пролин и молекула Ig делает изгиб, что обеспечивает приспособление Ig к взаимодействию с АГ. Вторичная структура Ig представлена -спиралью, в которой есть -структуры или «клубки». «Клубки» называются доменами, которые возникают при образовании дисульфидных связей между аминокислотными остатками внутри одной цепи.
Ig расщепляются протеолитическими ферментами: папаином и пепсином.
Папаин расщепляет молекулу Ig в шарнирной области на 3 фрагмента: 2 Fab и Fc-фрагмент. Fab-фрагмент имеет активный центр и это обеспечивает его связывание с АГ, происходит образование комплекса АГ-АТ.
Fc-фрагмент выполняет эффекторную функцию: обеспечивает прохождение через плаценту, прохождение через мембрану клеток, обеспечивает фиксацию иммуноглобулинов на поверхности собственных клеток, связывает комплемент, который способен лизировать клетку.
IgG составляет 70-75% общего количества иммуноглобулинов. Концентрация IgG в сыворотке достигает нормы к 7-летнему возрасту. Повышенная концентрация IgG наблюдается при инфекциях, при болезнях печени.
Пониженная концентрация IgG наблюдается у новорожденных, при недостаточности гуморального иммунитета.
IgG – единственный иммуноглобулин, проникающий через плаценту; благодаря этому плод получает материнские антитела.
IgM представляет собой пентамер молекулы IgG. Пять молекул, аналогичных IgG, соединены между собой полипептидной цепью J. IgM лучше, чем другие связывает комплемент. IgM синтезируется в ответ на большинство антигенов у детей первого года жизни. Обнаружение у плода антител класса М указывает на внутриматочную инфекцию.
IgA сывороточный иммуноглобулин А бывает в разных формах: обычной, димерной и трехмерной. IgA, которые выходят из кровяного русла через слизистые оболочки в просвет дыхательных путей, помимо J-цепи, имеют секреторный компонент – SC. SC-структура защищает IgA от разрушающего действия ферментов, находящихся в скретах слизистых оболочек. Содержание IgA достигает нормы к 10 годам. IgA – типичный иммуноглобулин слизистых оболочек. Функция IgA – защита слизистых оболочек от инфекций.
IgE – содержится в крови в низких концентрациях. IgE обладает высокой цитофильностью, т.е. способностью присоединяться к тучным клеткам и базофилам. Присоединение антигена к IgE, находящаяся на этих клетках, приводит к выделению гистамина и это вызывает развитие реакций гиперчувствительности немедленного типа (аллергических реакций).
IgD – не связывает комплемент, не проходит через плаценту, не связывается с тканями. Биологическая функция не ясна; вероятно, он служит рецептором В-лимфоцитов.
Динамика выработки антител.
IgM являются антителами первичного иммунного ответа. Через несколько дней происходит переключение синтеза IgM на IgG. При вторичном ответе сразу синтезируются IgG.
Материнские IgG с периодом полураспада 25 дней проникающие в кровь плода через плаценту, обеспечивают пассивный иммунитет новорожденных, к 3 месяцу из содержание уменьшается вдвое.
Синтез собственных IgM осуществляется плодом с 5 недели внутриутробного развития.
Катаболизм Ig
Период полураспада антител зависит от интенсивности обменных процессов и возраста, у новорожденных это 30-35 дней, затем этот срок сокращается.
Ig разрушаются под влиянием тканевых катепсинов на Fc и 2 Fab-фрагмента, небольшое количество около 10% IgG выводится в свободном виде, активный центр сохраняется и по мере выведения продукты катаболизма оказывает защитное действие, связывая АГ.
Патология обмена Ig
1. Гипогаммаглобулинемия – снижение уровня всех классов Ig.
Бывает 3 видов: 1. Транзитная – у детей. 2. Врожденная. 3. Приобретенная (инфекция, интоксикация, нарушение синтеза Ig, ускоренное разрушение, потеря с мочой).
2. Дисгаммаглобулинемия – снижение (изменение) соотношения между классами Ig. Виды: 1. Врожденная. 2. Приобретенная.
I тип – нет G, A, > M
II тип – нет M, A, >A
III тип – N G,M < A
Белки плазмы крови.
Кровь состоит из плазмы и взвешенных в ней форменных элементов. Плазма составляет около 55% от объема крови. Эритроциты составляют основную массу форменных элементов – 44%.
Из 9-10% сухого остатка плазмы крови на болю белков приходится 6,5-8,5%.
Общее содержание белков составляет 60 – 80 г/л.
Для разделения белков плазмы крови используют следующие методы:
- Высаливание.
Разделение белков проводят с использованием солей щелочных и щелочноземельных металлов. Наиболее часто используют сульфат аммония. Различные белки высаливаются из растворов при разных концентрациях растворов сульфата аммония: альбумины выпадают при 100% насыщении, глобулины при 50%.
При действии сульфата аммония, ацетона, спирта белки теряют гидратную оболочку, утрачивают устойчивость и выпадают в осадок.
В результате высаливания получают 2 фракции:
- Альбумины – 40 – 50 г/л
- Глобулины – 20 – 30 г/л
На долю фибриногена приходится – 2 – 4 г/л.
Плазма, лишенная фибриногена, называется сывороткой.
В условиях клинических лабораторий для разделения белков сыворотки крови применяют метод электрофореза.
Сыворотка – плазма, не содержащая фибриноген и др. факторы свертывания (т.е. жидкость, которая остается после формирования сгустка крови).
Высаливание.
Для высаливания применяют соли в разных концентрациях.
При малой концентрации солей осаждаются наиболее крупные, тяжелые и обладающие наименьшим зарядом частицы.
При повышенной концентрации солей выпадают все более мелкие частицы и устойчивые белковые фракции.
При использовании 33%-ного раствора (NH4)2SO4 выпадают белки сыворотки крови, имеющие наибольший молекулярный вес – эйглобулины, при 50%-ной концентрации – псевдоглобулины, при 100%-ной – самые «легкие» альбумины.
Белки, осажденные сульфатом аммония, почти не денатурируются; после удаления соли из белкового осадка (диализом через целлофановую мембрану) ее растворяют и используют для различных целей.
Чтобы лишить высокомолекулярные частицы устойчивости, необходимо удалить их водные оболочки и снять электрический заряд.
При электрофорезе в поддерживающих средах имеет значение размер пор геля (молекулярно-ситовой эффект геля) и размеры молекул белка.
Электрофорез на бумаге.
Сыворотку крови наносят на бумажную полоску, смоченную буфером. Концы бумажной полосы опущены в раствор электролита, где находятся электроды источника постоянного тока. При замыкании электрической цепи белковые молекулы движутся со скоростью. Пропорциональной величине заряда. За единицу времени проходят разные расстояния, т.е. оказываются на разных участках бумажной полосы.
2. Электорфорез основан на передвижении заряженной частицы в электрическом поле.
Белки сыворотки крови различаются по молекулярной массе, заряду и изоэлектрической точке. На основании этих различий белки разделяются в электрическом поле.
В зависимости от условий проведения разделения различают электрофорез на бумаге, в растворе и в геле: крахмала, целлюлозы и полиакриламидном геле.
а) Электрофорез на бумаге позволяет получить 5 белковых фракций: 1. Альбумины. 2. 1-глобулины. 3. 2-глобулины. 4. -глобулины. 5. -глобулины.
б) Электрофорез в крахмальном геле позволяет получить 10 фракций.
в) Электрофорез в полиакриламидном геле позволяет получить до 18 фракций.
При электрофорезе в полиакриламидном геле используют пары буферных растворов с различными значениями рН и различной степени пористости гель.
3. Изоэлектрофокусировние – проведение электрофореза в поддерживающих средах с градиентом рН. Нахождение белка определяется его изоэлектрической точкой.
4. Иммунофорез представляет собой комбинацию электрического и иммунологического методов. Происходит электрофорез и реакция преципитации в одной среде.
Иммуноэлектрофорез – сочетание электрофореза в агаровом геле и иммунодиффузии. После электрофоретического разделения белков в канавку, идущую параллельно пути движения антигенов, вносят перциптирующую иммунную сыворотку. Антигены и антитела диффундируют на месте встречи дугообразные полосы преципитации.
Электрофорез основан на способности белков перемещаться в электрическом поле.
Для функционирования белков сыворотки крови чаще всего используют веронал-мединаловый буфер с рН 8,6. При этом значении рН белки заряжаются отрицательно и движутся к аноду.
В связи с различием в размерах молекул и в величине заряда скорость движения белков самые малые и имеющие наибольший заряд альбумины, затем -, -, и -глобулины.
Скорость передвижения белка в электрическом поле зависит от его электрофоретической подвижности.
Самая мощная буферная система. На ее долю приходится 75% всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислоты.
Состав гемоглобинового буфера можно выразить так: [HHb/KHb] [HHbO2/KHbO2]
Гемоглобиновая буферная система состоит из HHb гемоглобина, который является слабой кислотой и его калиевой соли [HHb/KHb] и оксигемоглобиновой буферной системы [HHbO2/KHbO2]
Системы гемоглобина и оксигемоглобина взаимопревращающиеся системы и работают как единое целое.
При насыщении гемоглобина кислородом гемоглобин становится более сильной кислотой – HНbО2 и увеличивает отдачу в раствор ионов водорода.
В капиллярах легких, гемоглобин присоединяет кислород и превращается в оксигемоглобин:
HHb + О2 HНbО2
Образование оксигемоглобина приводит к некоторому подкислению крови, вытеснению части угольной кислоты из бикарбонатов:
HНbО2 + КНСО3 КНbО2 + Н2СО3 (CO2 + H2O)
Щелочной резерв крови понижается.
В периферических капиллярах большого круга кровообращения калиевая соль оксигемоглобина диссоциирует и гемоглобин эритроцитов отдает кислород тканям:
КНbО2 О2 + КНb
В результате способность гемоглобина связывать ионы водорода увеличивается. Одновременно в эритроциты поступает углекислый газ. Под влиянием фермента карбангидразы углекислый газ взаимодействует с водой с образованием угольной кислоты:
СО2 + Н2О Н2СО3
За счет угольной кислоты возникает избыток ионов водорода, который связывается с калиевой солью гемоглобина, отдавшей кислород:
КbHb + Н2СО3 К+ + + HHb
В результате этого процесса накапливаются анионы , которые выходят из эритроцитов в плазму. В обмен на ионы в эритроциты поступают ионы хлора, а натрий остается в плазме. В плазме повышается содержание бикарбоната и это способствует восстановлению щелочного резерва крови.
Значение фосфатного буфера для различных сред организма. Уравнение Гендерсона- Гассельбаха.
ФОСФАТНЫЙ БУФЕР
Под этим названием объединены свойства многих органических молекул, содержащих фосфатные группы: нуклеотиды, нуклеиновые кислоты, фосфосахара. Входящие в их состав остатки фосфорной кислоты способны протонироваться при ацидозе (закисление среды) и депротонироваться при алкалозе (защелачивание среды), обеспечивая эффективное поддержание рН в цитоплазме и ядре клеток. Например, ДНК состоит из тысяч нуклеотидов, объединенных в цепи. В каждом нуклеотиде есть фосфатная группа, несущая отрицательный заряд при физиологических рН, и готовая принять протоны при ацидозе. Органические фосфаты работают только внутри клеток.
СОСТАВ ФОСФАТНОГО НЕОРГАНИЧЕСКОГО БУФЕРА
NaН2РО4 Na2НРО4
Дигидрофосфат гидрофосфат натрия
кислотная компонента основная компонента
Этот буфер играет важную роль в поддержании рН внеклеточной жидкости и, особенно, слюны.
Н2РО4– –анионывыполняют роль слабой кислоты
НРО42- –анионы выполняют роль соли.
Так как рКа (Н2РО4–) = 6,86 в плазме крови при 36,6°С и
[НРО42-] = 1,6
[Н2РО4–]
из уравнения Гендерсона-Гассельбаха следует, что рН = 6,86 + lg1,6, т.е.
рН = 7,4.
Отношение [НРО42-] при рН = 7,4
[Н2РО4–]
не изменяется, т.к. при избыточном накоплении одного из компонентов, он выделяется с мочой.
Особенности фосфатного буфера. Буферная емкость фосфатной системы меньше, чем карбонатной:
bк = 1-2 ммоль-экв/л bщ = 0,5 ммоль-экв/л
Буферная емкость по кислоте и основанию имеет близкие значения, поэтому фосфатная система принимает участие в нейтрализации как кислых, так и основных продуктов метаболизма. В связи с малым содержанием фосфатов в плазме крови она менее мощная, чем гидрокарбонатная.
Основная роль фосфатного буфера заключается в выведении H+ в мочу. В почках:
НРО42-+ H+ = Н2РО4–
Образующийся дигидрофосфат-анион выделяется в мочу. Ежесуточно из организма экскретируется 30-40 ммоль ионов H+.
рН= рКа- lg(C(NaH2PO4)/ C(Na2HPO4))
Буферные системы
Буферные растворы
Организм человека
располагает тонкими механизмами
координации происходящих в нем процессов
и поддержания постоянства внутренней
среды.Эта координация
называется гомеостазом.
Она осуществляется с помощью гуморальной
регуляции,
т.е. через кровь, тканевую жидкость,
лимфу с помощью биологически активных
веществ (ферментов, гормонов и других
веществ).Сохранение постоянства
pH
жидких сред организма имеет очень
важное значение для жизнедеятельности
человеческого организма, т.к.Ионы H+
катализируют многие биохимические
превращения (расщепление белков в жкт),Кроме того, многие
ферменты и гормоны проявляют свою
биологическую активность только в
строго определенном интервале pHДаже незначительные
сдвиги pH
могут оказать существенное влияние на
величину осмотического давления
биологических жидкостей.
Буферные растворы
Поддержание на
постоянном уровне концентрации ионов
водорода способствуют буферные
растворы –
растворы, рН которых не меняется при
добавлении к ним небольших количеств
сильных кислот, щелочей, а также при
разведении.Простейший буферный
раствор –
это смесь слабой кислоты и соли, имеющей
с этой кислотой общий анион – буферная
система I
типа.Смесь слабого
основания и соли с общим катионом.
Классификация
буферных растворов
1 тип буферных
растворов:
Ацетатный – CH3COOH
и СН3СООNaФосфатный – NaH2PO4
и Na2HPO4Бикарбонатный –
H2CO3
и NaHCO3Белковый – PtCOOH
и PtCOONaГемоглобиновый –
HHb и
KHbОксигемоглобиновый
– HhbO2
и KHbO2
* Все ацетатные
буферные системы входят в состав
организменных сред
2 тип буферных
растворов:
Аммиачный – NH4OH
и NH4Cl
По более современной
классификации БР делят на следующие
группы:
БР, состоящие из
слабой кислоты и ее аниона – HA/A-
(CH3COOH
/ CH2COO-)БР, состоящие из
слабого основания и его катиона – B/BH+
(NH4OH
/ NH4+)БР, состоящие из
аниона кислой и средней соли, или из
анионов двух кислых солей, например,
фосфатная буферная система – H2PO4-/HPO42-БР, состоящие из
ионов и молекул амфолитов. К ним относятся
белковые БС, гемоглобиновая и
оксигемоглобиновая БС.
pH буферных
растворов

Так как концентрация
ионов CH3COO-
велика из-за диссоциации соли, процесс
диссоциации CH3COOH
по принципу Ле-Шателье сдвинут влево,
поэтому концентрация
недиссоциированных молекул CH3COOH
практически равна общей концентрации
кислоты в БР.А концентрация
ионов CH3COO-
равна концентрации соли в БР, поэтому:

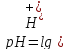
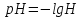
Механизм буферного
действия
Если к буферному
раствору добавить сильную кислоты, то
ионы водорода будут соединяться с
анионами с образованием слабого
электролита и реакция среды при этом
не меняется:CH3COONa
+ HCl = CH3COOH
+ NaClCH3COO-
+ H+
= CH3COOH
pH
практически не изменится, т.к. добавленный
сильный электролит замещается
эквивалентным количеством слабого
электролита
Механизм буферного
действия
Если к буферному
раствору прибавить сильное основание,
то ионы ОН-
будут взаимодействовать с ионами Н+,
которые содержатся в небольшом количестве,
вследствие небольшой диссоциации
кислоты. В результате образуется Н2О.
Кроме этого, увеличение
концентрации ионов СН3СОО-
приводит к смещению равновесия процесса
диссоциации СН3СООН
влево, поэтому рН не изменяется:
CH3COOH
+ NaOH = CH3COONa
+ H2OCH3COOH
+ OH- = CH3COO-
+ H2O
Уравнение
Гендерсона-Гассельбаха показывает, что
рН буферного раствора данного состава
определяется соотношением кислоты и
соли не зависит от разбавления, т.к. при
изменении объема раствора концентрация
каждого компонента изменяется в
одинаковое число раз, а их соотношение
остается постоянным.
Буферная
емкость.
Способность буферного
раствора сохранять рН при добавлении
сильных кислот или щелочей не беспредельна
и ограничена величиной, называемой
буферной емкостью.За единицу буферной
емкости принята емкость такого БР, для
изменения рН которого на единицу
требуется введение сильной кислоты
или щелочи в количестве 1 моль эквивалента
на 1 литр буферного раствора.

Буферная
емкость
От природы и общих
концентраций компонентов буферного
раствора, а также от соотношения их
концентраций:Чем больше концентрация
компонентов иЧем ближе отношение
кислота/соль к 1, тем больше буферная
емкость.
Буферные
системы крови
Для каждой
биологической жидкости характерно
определенное значение рН и сохранение
этого значения имеет очень важную роль
для нормальной жизнедеятельности
организма.Значение рН крови
в норме 7.36, которое поддерживается за
счет буферных систем, содержащихся в
крови.
Буферные
системы плазмы крови
Водородкарбонатная
(гидрокарбонатная) – состоит из слабой
H2CO3
и сопряженного основания HCO3-Углекислота
образуется при взаимодействии
растворенного в плазме СО2
с водой:
СО2
+ Н2О
= Н2СО3

при поступлении в
кровь кислот (например, молочной кислоты)
гидрокарбонат их нейтрализует, а избыток
СО2
выводится через легкие, вызывая
увеличение легочной вентиляции.Таким образом,
соотношение НСО3-/Н2СО3,
а следовательно, и рН крови не меняется.

у гидрокарбонатной
буферной системы наибольшая взаимосвязь
со всеми буферными системами и вне-, и
внутриклеточных жидкостейнарушение в любой
буферной системе сказывается на
концентрациях составляющих гидрокарбонатной
БС, поэтому изменение ее параметров
может достаточно точно характеризовать
состояние дыхательных или метаболических
нарушений, т.е. кислотно-основного
состояния.Фосфатная буферная
система состоит из слабой кислоты
Н2РО4-
и сопряженного основания НРО42-.
В основе ее действия лежит равновесие:
Н2РО4-
↔ НРО42-
+ Н+
Фосфатная буферная
система способна сопротивляться
изменению рН в интервале 6,2-8,2, т.е.
обеспечивает значительную долю буферной
емкости крови.Отношению НРО42-/Н2РО4-
в плазме крови равно 4:1, поэтому данная
буферная система имеет более высокую
емкость по кислоте, чем по щелочи (Вк =
1-2 ммоль/л; Вщ = 0,5 ммоль/л)
В связи с малым
содержанием фосфатов в плазме крови
она менее мощная, чем гидрокарбонатная,
однако, эта система играет решающую
роль в других биологических средах –
в клетке, моче и соках пищеварительных
желез.
Белковые буферные
системы – состоят из остатков аминокислот,
которые содержат –NH2
группы, имеющие слабый основный характер,
и –СООН группы, со слабыми кислотными
свойствами, поэтому белки способны
противодействовать как подкислению,
так и подщелачиванию среды.

при увеличении
количества ионов Н+
(при избыточном образовании молочной
кислоты при гипоксии или 3 гидроксимасляной
кислоты при диабетическом кетозе) обе
эти реакции сдвигаются влево, образуя
PtCOOH
и СО2,
избыток которого выводится через
легкие.
Буферная емкость,
определяемая белками плазмы, зависит
от:
концентрации белков
в плазме,их вторичной и
третичной структуры,а также числа
свободных протон-акцепторных групп.Эта система способна
нейтрализовать как кислые, так и основные
продукты, однако, вследствие преобладания
формы белок-основание, ее буферная
емкость значительно выше по кислоте и
составляет для альбуминов 10ммоль/л, а
для глобулинов – 3 ммоль/л
Буферные
системы эритроцитов
-гемоглобиновая/оксигемоглобиновая
БС,
на долю которой приходится 75% буферной
емкости крови.
-Гемоглобиновый
буфер является разновидностью белковой
БС и состоит из
2х форм гемоглобина:
Восстановленного
(ННb)
Окисленного
(ННbO2)
В
эритроцитах система гемоглобин/оксигемоглобин
играет важную роль в процессах дыхания
(транспортная функция по переносу О2
к тканям и органам и удаление из них
метаболического СО2),
а также в поддержании постоянства рН
внутри эритроцитов, а в результате и в
крови в целом).
В
основе действия системы
гемоглобин/оксигемоглобин лежит
следующее уравнение:
ННb
+ O2
= HHbO2
HHb
является более слабой кислотой, чем
ННbO2:
К(HHb)
= 6.3*10-9
K(HHbO2)
= 1.12*10-7
Поэтому
ион Hb-
способен активнее связывать протон Н+,
чем ион HbO2
В
организме гемоглобиновые БС взаимодействуют
с гидрокарбонатной БС.
Совместное
действие гемоглобиновой и гидрокарбонатной
БС.
В
капиллярах большого круга кровообращения
оксигемоглобин диссоциирует и отдает
О2 тканям:
HHbO2
= HHb + O2
Вследствие
образования восстановленного гемоглобина,
являющегося более слабой кислотой,
снижается степень диссоциации кислотных
групп гемоглобина и уменьшается отдача
ионов Н+ в среду, но активная реакция
среды (рН) не меняется, т.к. из тканей в
кровь поступает СО2Под
действием угольной ангидразы СО2
превращается в Н2СО3,
при этом происходит одновременный
процесс ее диссоциации:
Н2СО3
↔ Н+
+ НСО3-
Образующиеся
в ходе этой реакции ионы Н+ связываются
в эритроцитах с восстановленным
гемоглобином, который освобождает
часть связанных ионов К+:
КHb
+ H+
= HHb + K+
Часть
ионов НСО3- образуют с ионами К+ соединение
КНСО3, другая часть ионов НСО3- переходит
в плазму, где образуется NaHCO3Из
плазмы в обмен на ионы НСО3- в эритроциты
переходят ионы Cl-,
которые с ионами К+ образуют KCl
В
капиллярах большого круга кровообращения:

В
легочных капиллярах
Через
тончайшую легочную мембрану по градиенту
парциального давления О2 переходит в
плазму и эритроциты, при этом происходит
оксигенация гемоглобина
HHb
+ O2
= HHbO2
= H+
+ HbO2-
Ионы
Н+ связываются с гидрокарбонат-ионами,
а ионы К+ с гемоглобином:
Н+
+ НСО3
= Н2СО3
К+
+ Нb-
= KHb
Угольная
кислота под действием карбоангидразы
разлагается на СО2
и Н2О.
Образовавшийся
СО2 переходит из эритроцитов в плазму,
диффундирует в легкие и удаляется с
выдыхаемым воздухом.
Вследствие
уменьшения концентрации НСО3-
в плазме крови, из эритроцитов в плазму
переходят ионы Cl-,
где связываются с ионами Na+.
В
результате этих преобразований
соотношение в артериальной крови
HCO3-/H2CO3
остается оптимальным (20:1).
Кислотно-основное
состояние
Таким
образом, благодаря буферному действию
буферных систем происходит лишь небольшое
снижение рН крови, т.е. сохраняется
кислотно-основное состояние,
несмотря на поступление в кровь
значительных количеств кислот,
Т.к.
в процессе усвоения пищи в организме
генерируется
значительное количество диоксида
углерода
(550-775 г/сут), при взаимодействии которого
с влагой образуется угольная кислота
в количестве, эквивалентном поступлению
в кровь от 25 до 35 ммоль/сут ионов Н+.
Кислотно-основное
состояние организма – неотъемлемая
часть гомеостаза внутренней среды
организма.
Физиологические
системы регуляции кислотно-основного
состояния связаны с функциональной
активностью легких и почек.
Смещение
кислотно-основного равновесия крови в
сторону повышения концентрации ионов
Н+ (снижения рН) и уменьшения резервной
щелочности называется ацидозом.
Смещение
его в сторону снижения концентрации
ионов водорода (повышение рН) и увеличение
резервной щелочности – алкалозом.
Ацидоз
и алкалоз
В
зависимости от механизма развития
расстройств кислотно-основного состояния
выделяют
-дыхательный
-метаболический
ацидоз и алкалоз.
Метаболический
ацидоз
характеризуется нарушением метаболизма
и может наступить в результате следующих
причин:
-избыточное
введение или образование в организме
стойких кислот (поступление кетокислот
при голодании и диабете,
-повышенное
образование молочной кислоты при шоке;
поступление кислот с пищей, питьем,
медикаментами, в результате вдыхания
загрязненного воздуха и т.д.);
-неполное
удаление кислот (при почечной
недостаточности);
-избыточные
потери HCO3-
иона (в результате поноса, колита, язвы
кишечника
Метаболический
алкалоз
наступает вследствие:
-потери
ионов Н+ (рвоте, кишечной непроходимости
и др.);
-увеличения
концентрации НСО3-
иона (при потере воды, введение солей
органических кислот – молочной, уксусной,
лимонной, катаболизирующихся с поглощением
ионов Н+).
Соседние файлы в папке YOBA-3000
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
