Механизм развития апластической анемии

Апластическая анемия – это крайне неприятное заболевание, способное кроме проблем со здоровьем устроить и финансовые проблемы (лечение очень дорогое). Суть заболевания сводится к нарушению производства крови. На языке медицины – нарушается гемопоэз (кроветворение). Точнее – форменные элементы крови (лейкоциты, эритроциты, тромбоциты) либо производятся в недостаточном количестве, либо их производство прекращается вовсе.
Болезнь достаточно редкая. Сложность лечения связана с тем, что самым простым разделом кроме лекарственной является заместительная трансфузионная терапия эритроцитарной и/или тромбоцитарной массы. Для сложных случаев остается только пересадка костного мозга – дорогая, с целым рядом осложнений операция.
По статистике в зоне риска апластической анемии молодые люди до 20 лет (преобладает вирусная природа патологии), а также люди старше 65-ти лет (накопленные возрастные сбои биохимических процессов как причина).
Внимание. Болезнь имеет высокую летальность – превышает 80%.
Статистику можно посмотреть в видео в конце статьи.
Что такое апластическая анемия
Справочно. Апластическая анемия – это опасное заболевание, при котором нарушается образование клеток крови на уровне костного мозга.
В зависимости от степени выраженности угнетения кроветворения различают две формы:
- гипопластическая анемия (при этой форме функция кроветворения сохранена, но значительно снижена),
- апластическая анемия (полное угнетение кроветворения).
По сути они являются одним и тем же заболеванием разной степени выраженности. Нарушается продукция эритроцитов, тромбоцитов и лейкоцитов.
Клинические проявления могут быть разнообразными и на первых этапах напоминать общее недомогание за счет снижения эритроцитов – возникают слабость, головокружения, могут появиться обмороки.
За счет нехватки тромбоцитов развиваются кровотечения, кожные геморрагические высыпания.
Внимание. Сниженное содержание лейкоцитов в крови сказывается на развитии воспалительных процессов, включая гнойные.
Апластическая анемия – причины
Выделить единственную причину невозможно, так как вызвать апластическую анемию могут различные факторы. Они разительно отличаются друг от друга, но могут приводить к одинаково тяжелым последствиям.
Справочно. Выделяют два основных типа заболевания – врожденный и приобретенный. В первом случае ребенок первоначально содержит генную мутацию, которая приводит к нарушению кроветворной функции. Во втором варианте нарушение выработки клеток крови происходят под влиянием внутренних (эндогенных) или внешних (экзогенных) факторов.
Клиническая картина этих вариантов отличается. Во-первых, врожденные формы часто проявляются на ранних сроках жизни. Во-вторых, они могут сочетаться с аномалиями развития различных органов.
Внимание. В зависимости от вида хромосомной мутации, может наблюдаться снижение производства лишь одного вида кровяных клеток.
При манифестации во взрослом возрасте первыми симптомами могут быть общее недомогание и головокружение, которые являются неспецифичным и возникают при многих заболеваниях. Скорость прогрессирования апластической анемии зависит от выраженности нарушения кроветворной функции.
Апластическая анемия у детей (врожденная)
Врожденные формы включают в себя следующие варианты:
- Синдром Даймонда-Блекфена. При данной патологии происходит нарушение на уровне клеток-предшественников эритроцитов. Фенотипическим симптомом является бледная кожа. Увеличение печени и селезенки не характерно, но может развиваться с течением времени.
- Анемия Фанкони. Наследственное заболевание, которое проявляется на пятом десятке жизни. Возникает острый лейкоз и апластическая анемия. Для данной генной мутации характерны аномалии развития, которые проявляются уже на ранних сроках жизни. В основном это аномалии костной системы (низкий рост, маленький череп, недоразвитие первого пальца верхних конечностей, лучевой кости, тяжелая дисплазия бедра, дополнительное ребро) и неврологический дефицит (аномалии глазных яблок, косоглазие, птоз, нарушение слуха, умственные нарушения развития).
- Синдром Эстрена-Дамешека. Помимо нарушения кроветворения для данных детей характерна определенная внешность – светлые волосы, широко расставленные глаза, курносый нос. Апластическую анемию в этом варианте сопровождает увеличение печени и селезенки.
Приобретенная апластическая анемия
Приобретенные формы различают по факторам, которые вызывают апластическую анемию.
- Внешние (экзогенные) факторы:
- Медикаментозное влияние – прием сульфаниламидов, антибактериальных средств (тетрациклин, левомицитин, стрептомицин), средств для лечения туберкулеза (изониазид, ПАСК), анальгина, цитостатиков.
- Воздействие химических агентов – наиболее опасны нефтепродукты, бензольные производные, ртуть.
- Радиоактивное воздействие.
- Инфекции. Наиболее опасными являются вирус, вызывающий гепатит С, цитомегаловирус, герпес-вирус. Чаще всего они оказывают выраженное повреждающее действие лишь при активно перенесенном заболевании.
- Внутренние (эндогенные) факторы:
- Аутоиммунное поражение костного мозга. Чаще наблюдается в пожилом возрасте.
- Эндокринное влияние. Выявлена связь с нарушением функции щитовидной железы, и с заболеваниями яичников у женщин.
Внимание. Данное разделение условное, так как даже экзогенные факторы могут влиять на костный мозг опосредованно через запуск аутоиммунной агрессии.
Апластическая анемия – механизм развития
В настоящее время существует три теории, объясняющих механизм развития апластической анемии. Каждая из них получила подтверждение в ходе исследований.
Внимание. В некоторых случаях ни одна из имеющихся теорий не может объяснить возникновение заболевания. При таком варианте используют название «идиопатическая апластическая анемия».
Поэтому официально теории приняты, но изучение механизмов возникновения апластической анемии продолжается.
Теории патогенеза (возникновения) апластической анемии:
- аутоиммунная;
- стромальная;
- преждевременный апоптоз.
Аутоиммунная теория
Справочно. В аутоиммунной теории за основу берется развитие иммунного ответа к клеткам костного мозга.
Возникла она в результате исследования материала биоптата костного мозга после развития апластической анемии.
В большом количестве случаев ученые увидели присутствие клеточного иммунитета (моноциты, Т-киллеры), а также факторов воспаления – фактор некроза опухолей, интенферон альфа и гамма.
После более детального изучения стало понятно, что скапливаются они из-за генной мутации. В результате нарушения работы гена PIG-A возникает дефицит специального гликопротеина, который необходим для того, чтобы снижать активность системы комплемента, входящей в состав иммунной системы.
В результате этой поломки защита собственных клеток костного мозга слабеет, они начинают восприниматься, как чужеродные и развивается аутоиммунная реакция. В зависимости от количества поврежденных клеток степень выраженности симптомов разнится.
Важно. Чем больше вовлечено ткани, тем более агрессивная анемия наблюдается у пациента.
Стромальная теория
Нормальное функционирование механизма кроветворения во многом зависит от стромы, то есть специального соединительнотканного основания, в котором находятся клетки костного мозга.
Строма отвечает за выработку специальных веществ (интерлейкины и факторы стволовых клеток), которые необходимы для направления недифференцированных молодых клеток по пути образования эритроцитов, тромбоцитов или лейкоцитов.
Стимулируется эта выработка эритропоэтином.
В случае нарушения выделения факторов роста на уровне стромы возникают низкодифференцированные клетки, которые не могут выполнять свои функции. Они не достигают дифференцировки, достаточной для определения в крови при анализе.
Справочно. Подтверждается данная теория при биопсии костного мозга – определяются предшественники клеток в большом количестве. А также определяется повышенный уровень эритропоэтина в крови. Такие изменения характерны не более чем для 20% случаев.
Теория преждевременного апоптоза
Термином апоптоз в медицине обозначают естественный процесс гибели клетки, когда она в полном объеме выполнила свою функцию. Происходит это во всех тканях организма. После определенного времени клетки подвергаются мутации, начинают восприниматься организмом, как старые, и удаляются.
В норме процесс представляет собой защитный механизм, который способствует обновлению тканей. Мутировавшие клетки могут переродиться в опухолевый процесс, и функция апоптоза – не допустить этого. Однако, если этот процесс начинает происходить раньше времени, возможно чрезмерное удаление клеток ткани. При недостаточном синтезе новых клеток этот процесс приводит к нарушению функции.
Справочно. Причиной слишком раннего удаления здоровых и молодых клеток является мутация гена, отвечающего за выработку протеина Р-450.
Изучение механизмов развития апластической анемии до сих пор является зоной научных интересов исследователей всего мира. Однако это может внести вклад в лечение заболевания в будущем, но никак не сказывается на современных пациентах.
Дело в том, что на сегодняшний момент самым эффективным методом лечения апластической анемии остается пересадка костного мозга. Для замедления процесса используют стероидные гормоны.
Внимание. Ни один из методов лечения не учитывает патогенез процесса.
Апластическая анемия – симптомы
Учитывая угнетение выработки кровяных телец, выделяют следующие синдромы апластической анемии:
- Анемический (возникает за счет недостаточности эритроцитов и, соответственно, гемоглобина);
- Геморрагический (возникает в результате нехватки тромбоцитов, которые в норме останавливают кровотечение, образовывая тромботические массы);
- Токсико-инфекционный (недостаточность лейкоцитов – клеток иммунитета, в результате чего даже незначительная инфекция может развиться до гнойного процесса).
Клиническая картина каждого синдрома отличается. Может наблюдаться как сочетание всех синдромов, так и превалирование одного.
- При анемическом синдроме преобладают:
- повышенная утомляемость;
- головокружение;
- тошнота;
- одышка даже при минимальной нагрузке;
- тахикардия;
- потемнение в глазах.
- При геморрагическом:
- Множественные, легко образующиеся синяки;
- Излишне замедленная остановка любого кровотечения;
- Возникновение носовых кровотечений;
- Обильные месячные;
- Кровоточивость из десен;
- Возникновение специфических высыпаний – тромбоцитопеническая пурпура (является по факту пропитыванием кожи кровью).
- При токсико-инфекционном:
- Тяжелое течение легких инфекционных заболеваний;
- Медленное заживление ран, часто с нагноением.
Эти признаки более характеры для развития апластической анемии во взрослом возрасте. Эти пациенты могут анализировать свое состояние и предъявлять жалобы на приеме у врача.
Апластическая анемия у детей имеет свои особенности. При возникновении заболевания в совсем раннем возрасте они не могут объяснить свои ощущения, но существуют так называемые стигмы (или особенности), которые позволяют заподозрить различные наследственные формы анемии и провести генетическое тестирование.
Обычно у детей при наличии апластической анемии отмечаются следующие особенности:
- маленькая голова,
- укорочение первого пальца верхних конечностей,
- дисплазия тазобедренного сустава при синдроме Фанконе,
- специфический фенотип (светлые волосы, курносый нос, широко поставленные глаза при синдроме Эстрена-Дамешека),
- гепато- и спленомегалия.
Апластическая анемия – диагностика
Сбор жалоб и осмотр пациента является первым звеном в постановке диагноза и дает врачу первоначальный вектор для дальнейшего
подтверждения диагноза.
Самым важным этапом является инструментальная и лабораторная диагностика, которая включает в себя:
- Стернальную пункцию костного мозга;
- Трепанобиопсию;
- биохимический анализ крови;
- общий анализ крови.
Справочно. Стернальная пункция представляет собой забор материала из грудины с помощью специальной иглы. Элементы костного мозга помещают на стекла и изготавливают миелограмму, по которой могут сказать, какие клетки содержит костный мозг, соответствует ли их количественный и качественный состав норме.
С помощью трепанобиопсии производят забор костного мозга из крыла подвздошной кости. Данный метод помогает помимо анализа клеток (цитологического) провести гистологический анализ. Это помогает получить информацию о строме, ее представленности, а также соотношении желтого (неактивного) и красного костного мозга.
Биохимический анализ позволяет получить информацию о:
- содержании сывороточного железа (необходимо для подтверждения анемии),
- эритропоэтина (повышается при недостаточной выработке факторов роста стромой), – антителах к вирусам (которые могут быть причиной заболевания),
- С-реактивного белка (высокоспецифичный показатель воспалительного процесса).
Общий анализ крови показывает количественное содержание клеток крови (эритроциты, тромбоциты, лейкоциты), а также оценивает качественные характеристики клеток.
Апластическая анемия – лечение
На первых этапах апластическую анемию стараются лечить глюкокортикоидами и цитостатиками. Выбран данный метод в связи с преобладанием аутоиммунной агрессии по отношению к костному мозгу. Данный подход приносит положительные результаты, однако часто они являются временными.
Для симптоматического лечения синдромов могу применяться антибиотики, препараты для коррекции артериального давления, ферментные препараты.
Иммуносупрессивную терапию в качестве единственного лечения применяют лишь в начале апластической анемии. Далее стараются комбинировать с цитостатиками и препаратами для симптоматического лечения в зависимости от преобладания синдромов.
Справочно. На данный момент наиболее эффективным лечением апластической анемии является пересадка (трансплантация) костного мозга.
К сожалению, она не всегда проходит гладко. Выделяют несколько наиболее частых осложнений процедуры.
Осложнения пересадки костного мозга
К основным осложнениям относят следующие:
- инфекционные осложнения. Как и при любом оперативном вмешательстве существует риск нагноения места пункции. У пациентов с апластической анемией снижен иммунитет, поэтому даже при должном соблюдении правил асептики и антисептики не исключено появление данного осложнения.
- Отторжение трансплантата. Любой пересаженный орган воспринимается иммунными клетками организма, как чужеродный. Возникает иммунная реакция с попыткой уничтожить инородную ткань.
- Реакция трансплантата против организма пациента. При пересадке стволовых клеток возникает образование клеточного иммунитета донора. Новые клетки начинают агрессивно себя вести по отношению к лимфоцитам пациента. Этот процесс приводит к образованию высыпаний, нарушениями работы сердечно-сосудистой системы и желудочно-кишечного тракта.
- отказ работы жизненно важных органов. Возникает из-за массивного стресса, оказываемого на организм процессом пересадки костного мозга, а также приемом большого количества препаратов.
Несмотря на возможность тяжелых осложнений, трансплантация костного мозга остается самым эффективным методом лечением апластической анемии.
Справочно. Для минимизации рисков осложнений используются различные препараты до и после процедуры.
Апластическая анемия – прогноз
Врожденные формы часто сложнее поддаются лечению, так как костный мозг первоначально генетически не полноценен. Так, при анемии Фалкони, медикаментозное лечение протекает крайне сложно, а пересадка костного мозга может иметь противопоказания из-за аномалий развития.
Справочно. Приобретенные виды анемии легче поддаются лечению, особенно в случае устранения повреждающего фактора, если он был определен. Успех лечения во многом зависит и от времени выявления. Ранняя диагностика существенно повышает шансы на излечение.
Кроме того, выраженность симптомов может варьировать в зависимости от выраженности повреждения костного мозга. При медленно текущем процессе с минимальными повреждениями, даже медикаментозное лечение протекает легче и приносит существенное облегчение.
Апластическая анемия — это синдром хронической первичной недостаточности гемопоэза с одновременным присутствием панцитопении (анемии, нейтро-пении и тромбоцитопении). По всей видимости, у большинства пациентов развитие заболевания инициируют аутоиммунные механизмы. Способствующим фактором, по крайней мере у некоторых пациентов, вероятно, служат наследственные или приобретенные нарушения КСК.
а) Этиология. Наиболее распространенные причины апластической анемии перечислены в таблице ниже. Большинство случаев известной этиологии связано с воздействием химических веществ и лекарственных средств. Некоторые препараты и химические вещества (включая многие противоопухолевые химиотерапевтические вещества и органический растворитель бензол) вызывают дозозависимую и обратимую супрессию костного мозга.
В других случаях апластическая анемия возникает непредсказуемым образом по типу идиосинкразии в ответ на лекарственные средства (например, хлорамфеникол и соли золота), обычно не вызывающие супрессию костного мозга.
Персистирующая аплазия костного мозга может появиться после различных вирусных инфекций; чаще всего после вирусного гепатита типа не-А, не-В, не-С, не-G (5-10% случаев). Почему апластическая анемия возникает только у некоторых индивидов, до сих пор неизвестно.
Облучение всего тела может разрушать КСК в зависимости от дозы облучения. У лиц, получавших терапевтическое облучение или подвергшихся облучению в результате несчастного случая (например, как это было в Чернобыле), существует риск развития аплазии костного мозга.
В основе некоторых форм апластической анемии лежат наследственные дефекты. Анемия Фанкони представляет собой редкое аутосомно-рецессивное заболевание, вызываемое дефектами мультибелкового комплекса, необходимого для репарации ДНК. Гипофункция костного мозга становится очевидной в раннем периоде жизни и обычно сопровождается множественными врожденными аномалиями, например гипоплазией почек и селезенки, аномалиями костей, чаще всего большого пальца кисти и лучевых костей.
Наследственные дефекты теломеразы обнаруживаются в 5-10% случаев апластической анемии, возникающей у взрослых. Напомним, что теломераза необходима для клеточного «бессмертия» и неограниченной репликации, поэтому последствием частичного дефицита активности теломеразы могут быть преждевременное истощение КСК и аплазия костного мозга. Аномально короткие теломеры, которые обнаруживаются в клетках костного мозга у 50% лиц, страдающих апластической анемией, встречаются более часто, чем мутации теломеразы. Остается неясным, обусловлено ли это укорочение какими-то другими дефектами теломеразы или является следствием избыточной репликации стволовых клеток.
В большинстве случаев инициирующий фактор идентифицировать не удается; 65% случаев попадает в эту идиопатическую категорию.

б) Патогенез. Патогенез апластической анемии изучен не полностью. Маловероятно, что в основе всех случаев лежит единый механизм. Однако очевидно, что существуют два основных этиологических фактора: внешняя, иммуноопосредованная супрессия костномозговых клеток-предшественников и внутренняя аномалия стволовых клеток.
Все большее внимание привлекает экспериментальная модель, в которой активированные Т-клетки супрессируют КСК. Вначале могут произойти антигенные изменения стволовых клеток в результате действия лекарственных средств, инфекционных агентов или других, неизвестных внешних воздействий. Это вызывает клеточный иммунный ответ, в течение которого активированные Тh1 -клетки продуцируют цитокины, например IFN-y и TNF, которые супрессируют и убивают гемопоэтические клетки-предшественники. Такое представление подкрепляется рядом наблюдений.
Исследование немногих сохраняющихся при апластической анемии стволовых клеток костного мозга показало, что у них повышена экспрессия генов, участвующих в апоптозе и активирующих пути клеточной гибели. Примечательно, что экспрессия тех же генов повышена у нормальных стволовых клеток, подвергнутых действию IFN-y.
Еще более убедительные (основанные на клиническом опыте) данные получены при изучении эффектов иммуносупрессивной терапии. Антитимоцитарный глобулин и другие иммуносупрессивные агенты, например циклоспорин, вызывают реакцию в 60-70% случаев. Предполагают, что действие этих лекарственных средств основано на супрессии или гибели клонов аутореактивных Т-клеток. Природа антигенов, распознаваемых аутореактивными Т-клетками, изучена недостаточно. В некоторых случаях мишенями могут быть связанные с GPI белки. Этим можно объяснить связь апластической анемии и пароксизмальной ночной гемоглобинурии.
Альтернативное предположение о том, что апластическая анемия возникает в результате фундаментальных дефектов стволовых клеток, подтверждается присутствием кариотипических аберраций, случайной трансформацией аплазии в миелоидную неоплазию (например, в миелодиспластический синдром либо острую миелоидную лейкемию) и связью с аномально короткими теломерами. Некоторые воздействия на костный мозг (или предрасположенность к повреждению ДНК), вероятно, влекут за собой нарушения, ограничивающие способность стволовых клеток к пролиферации и дифференцировке. Если повреждение значительное, развивается апластическая анемия.
Указанные механизмы не являются взаимоисключающими, поскольку генетически измененные стволовые клетки также могут экспрессировать неоантигены и тем самым служить мишенями для Т-клеток.
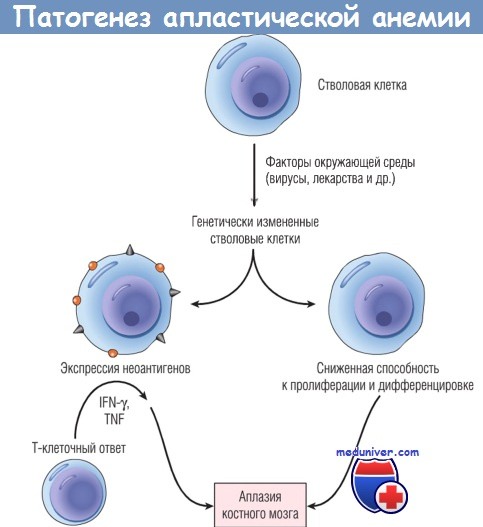
Патофизиология апластической анемии.
Поврежденные стволовые клетки могут продуцировать дочерние клетки, экспрессирующие неоантигены,
которые вызывают аутоиммунную реакцию, или же образуют клональную популяцию со сниженной пролиферативной активностью.
В обоих случаях возможна аплазия костного мозга.
IFN — интерферон; TNF — фактор некроза опухоли.
в) Морфология. Заметно обедненный клетками костный мозг в значительной степени лишен гемопоэтических клеток. Нередко остаются только жировые клетки, фиброзная строма, рассеянные лимфоциты и плазматические клетки. Аспирация костного мозга часто дает мало материала («сухой прокол»), поэтому для исследования лучше всего использовать биоптаты костного мозга. Другие неспецифические патологические изменения — гранулоцитопения и тромбоцитопения — обусловлены мукокутанными бактериальными инфекциями и аномальным кровотечением соответственно. Проведение множественных трансфузий при анемии индуцирует развитие системного гемосидероза.
г) Клинические признаки. Апластическая анемия наблюдается в любом возрасте и не зависит от пола. Обычно начало болезни бессимптомно. Первые проявления варьируют в зависимости от того, какая клеточная линия преимущественно поражена, однако в конечном итоге возникает панцитопения с ожидаемыми последствиями. Анемия вызывает прогрессирующую слабость, бледность и одышку. О тромбоцитопении свидетельствуют петехии и экхимозы. Нейтропения приводит к развитию частых и персистирующих минорных инфекций или внезапных озноба, лихорадки и общей слабости. Спленомегалия, как правило, отсутствует.
Если же она есть, то диагноз «апластическая анемия» должен быть подвергнут тщательной проверке. Со стороны эритроцитов обычно отмечается слабо выраженный нормохромный макроцитоз, а ретикуло-цитопения присутствует всегда.
Диагноз основывают данными исследований биоптатов костного мозга. Важно отличить апластическую анемию от других типов панцитопении, таких как алейкемическая лейкемия и МДС, которые могут иметь идентичные клинические проявления. При апластической анемии костный мозг обычно значительно обеднен клетками, тогда как миелоидные неоплазии ассоциируются с гиперклеточным костным мозгом, заполненным неопластическими клетками-предшественниками.
Прогноз вариабелен. Трансплантация костного мозга — терапия выбора, если есть подходящий донор, что обеспечивает 5-летнюю выживаемость в 75% случаев. Организм пожилых пациентов и тех больных, которым не смогли подобрать подходящего донора, часто хорошо отвечает на иммуносупрессивную терапию.
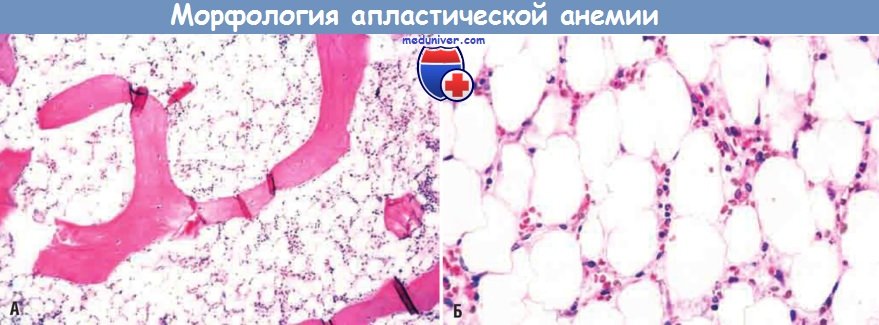
Апластическая анемия (биоптат костного мозга).
Заметное снижение количества клеток в костном мозге, содержащем в основном жировые клетки.
(А) Малое увеличение. (Б) Большое увеличение.
– Рекомендуем ознакомиться со следующей статьей “Механизмы развития (патогенез) эритроцитарной аплазии”
Оглавление темы “Патогенез анемий и кровотечений”:
- Механизмы развития (патогенез) апластической анемии
- Механизмы развития (патогенез) эритроцитарной аплазии
- Механизмы развития (патогенез) недостаточности костного мозга
- Механизмы развития (патогенез) полицитемий
- Классификация геморрагических заболеваний
- Механизмы развития (патогенез) геморрагии из-за патологии сосудистой стенки
- Механизмы развития (патогенез) кровотечения из-за тромбоцитопении
- Механизмы развития (патогенез) иммунной тромбоцитопенической пурпуры
- Механизмы развития (патогенез) лекарственной тромбоцитопении
- Механизмы развития (патогенез) тромбоцитопении при ВИЧ-инфекции
