Метаболизм железа при анемии

Дорогие друзья, здравствуйте!
От вас поступило сразу несколько писем с просьбой разобрать тему железосодержащих препаратов.
В связи с этим у меня к вам вопрос: в чем сложности?
Эти препараты — преимущественно рецептурные, в большинстве случаев вам протягивают листок бумаги с назначением или рецепт. Значит, покупатели задают какие-то вопросы?
Какие?
Напишите, пожалуйста.
А я, как всегда, начну с основ.
Сегодня мы разберем:
- Что такое анемия?
- Зачем нам железо?
- В каком виде оно находится в организме?
- Что с ним происходит, когда оно поступает в пищеварительный тракт?
- Какое бывает железо?
- Что ему мешает, а что помогает усваиваться?
- Почему возникает железодефицитная анемия?
- У кого она бывает чаще всего?
- По каким признакам можно заподозрить анемию у покупателя?
- Как подтверждают диагноз железодефицитной анемии?
- Основные принципы ее лечения.
Поехали!
Что такое анемия?
Анемия – это снижение концентрации гемоглобина часто с одновременным уменьшением числа эритроцитов.
Анемию в простонародье называют малокровием. Видимо, потому, что эритроциты составляют до 40% объема циркулирующей крови, и когда их количество уменьшается, крови тоже становится меньше.
Не путайте малокровие с белокровием, которое есть не что иное как лейкоз, т.е. рак крови.
А что такое эритроциты? Это красные кровяные тельца, напоминающие бублик без дырки, в которых находится гемоглобин.

Гемоглобин выполняет архиважную функцию: он переносит кислород от легких к каждой клеточке организма и забирает углекислый газ – конечный продукт метаболизма.
Эритроциты можно сравнить с грузовым судном, на котором в специальных «контейнерах» – молекулах гемоглобина – перевозится «груз»: ко всем тканям организма едет кислород, а обратно к легким — углекислый газ. И далее он удаляется с дыханием. А «контейнеры» вновь заполняются «грузом» – кислородом.
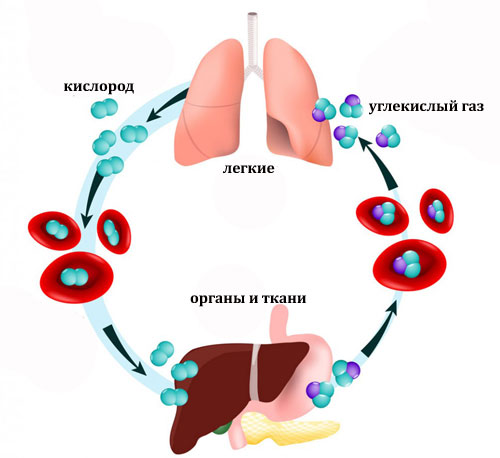
Зачем клеткам нужен кислород? Затем, что только в его присутствии клетка может производить необходимые для ее существования питательные вещества и энергию. Если мало кислорода, развивается кислородное голодание, или гипоксия. Человек ощущает слабость, быстро устает, нарушаются память, внимание, появляются другие симптомы, о которых мы еще поговорим.
Вывод: анемия – это не ерундовина какая-нибудь, это серьезное состояние, при котором страдает ВЕСЬ организм, КАЖДЫЙ орган, КАЖДАЯ клетка.
А при чем здесь железо?
А железо очень даже при чем, поскольку гемоглобин – это белок, имеющий две части: белковую – глобин и железосодержащую – гем. На одну молекулу глобина приходится 4 молекулы гема.
Откуда организм берет железо? Изначально – из пищи. Всасывание его начинается в 12-перстной кишке.
А дальше, всосавшись, железо идет или на образование каких-либо молекул — гемоглобина, миоглобина, некоторых ферментов и пр., или отправляется на «склад», т.е. в депо (печень, костный мозг, селезенку) и лежит там на «черный день».
Так что, в случае чего, организм знает, откуда взять железо для своих нужд.
В депо оно находится в двух формах: ферритина и гемосидерина.
Важно: в норме у каждого человека должен быть резервный запас железа.
Вывод: при лечении анемии нужно не только повысить гемоглобин крови, но и создать его запас, поэтому курс лечения анемии должен быть длительным (не менее 4-6 месяцев).
Гемовое и негемовое железо
Железо, которое поступает в организм, делится на 2 вида: гемовое и негемовое.
Гемовое – такое, которое входит в состав гемоглобина. Оно содержится в мясе, печени, птице, яичных желтках, т.е. продуктах животного происхождения.
Его биодоступность (всасываемость) – примерно 20%.
Негемовое железо входит в состав продуктов растительного происхождения. Это овощи, фрукты, гречка, фасоль, горох, орехи и пр. С биодоступностью здесь все намного печальнее. Она составляет всего 1-2%.
Часто можно услышать, что при анемии рекомендуют гранаты. Так вот, чтоб вы знали: гранаты – это продукт с низким содержанием железа. Причем, негемового, т.е. маловсасываемого.
Вывод 1. Только продуктами гемоглобин можно повышать до второго пришествия. При анемии назначение лекарственных препаратов обязательно!
Вывод 2. В комплексном лечении железодефицитной анемии, а также для ее профилактики нужно употреблять прежде всего продукты ЖИВОТНОГО происхождения: мясо, печень, птицу, язык, куриный желток.
Двухвалентное и трехвалентное железо
Помимо двух видов, которые я назвала выше, железо, поступающее в организм, бывает двухвалентным или трехвалентным. Если не помните из курса химии, что это такое, можете погуглить. Впрочем, необязательно. Главное поймите, что в кишечнике всасывается ДВУХВАЛЕНТНОЕ железо. А если в составе пищи или лекарственного средства поступило трехвалентное, специальные ферменты сначала превращают его в двухвалентное.
На это требуется время, поэтому препараты трехвалентного железа действуют медленнее.
Вывод: если нужно быстро поднять гемоглобин, начинают с препаратов двухвалентного железа (Тотема, Сорбифер Дурулес, Актиферрин, Ферретаб и др.).
При нетяжелой анемии или для профилактики железодефицитной анемии назначают препараты трехвалентного железа (Мальтофер, Ферлатум и др.), которые лучше переносятся, дают меньше побочных, и могут приниматься вместе с пищей.
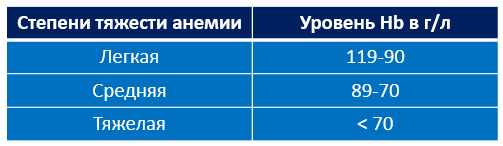
Для вашего понимания, что такое нетяжелая и тяжелая анемия по уровню гемоглобина:
Что помогает железу усваиваться?
- Аскорбиновая кислота. Именно она способствует превращению трехвалентного железа в двухвалентное, которое всасывается в кишечнике.
- Медь, марганец, молибден, кобальт. Метаболизм железа – штука непростая, в нем участвует масса различных ферментов и транспортных белков, которые «перевозят» железо в клетки кишечника. Для их полноценной работы как раз и нужны эти микроэлементы. Поэтому некоторые производители ввели их в состав своих препаратов. Например, Тотема содержит медь и марганец.
Что мешает железу усваиваться?
- Кальций. В связи с этим нужно развести во времени употребление продуктов, богатых кальцием (в первую очередь, это молочные продукты) с препаратами железа.
- Кофеин, танин. Содержащие их кофе, чай во время лечения железодефицитной анемии желательно исключить из рациона совсем или свести к минимуму.
- Пшеница, кукуруза, бобовые.
- Щавелевая кислота (шпинат, щавель, черника и пр.).
- Избыток жиров, пищевых волокон.
Почему развивается железодефицитная анемия?
Существует несколько видов анемий.
Самая распространенная и самая благодарная в плане лечения – железодефицитная анемия.
Почему она возникает?
Назову самые частые причины:
- Недостаток железа в рационе питания или употребление преимущественно растительной пищи (диеты, вегетарианство).
- Нарушение всасывания железа в кишечнике при заболеваниях ЖКТ (кишечные инфекции, гипоацидный гастрит, хронический энтерит, синдром мальабсорбции и пр.) или состояние после операции на органах ЖКТ (резекция, т.е. удаление части желудка, тонкой кишки).
- Нарушение транспорта железа из депо (например, при гепатитах, циррозах печени, т.к. печень – один из «складов» железа).
- Острая или хроническая кровопотеря. Острая – при травме, родах, хроническая – при обильных менструациях, гинекологических заболеваниях (миомы, полипы, эндометриоз и пр.), эрозиях/язвах желудка и кишечника, геморрое, анальных трещинах, заболеваниях крови (геморрагический диатез, гемофилия и пр.), онкологических заболеваниях.
- Повышенное расходование железа у детей, беременных, кормящих.
- Гельминтозы, при которых нарушается всасывание микро- и макроэлементов, необходимых для метаболизма железа.
- Прием некоторых лекарственных средств. Например, длительное и бесконтрольное применение препаратов из группы НПВС может привести к образованию эрозий и язв в пищеварительном тракте и хроническим внутренним кровотечениям.
Вывод: если не устранить причину анемии, принимать препараты железа бессмысленно!
Как можно заподозрить железодефицитную анемию у покупателя?
Большинство симптомов железодефицитной анемии могут встречаться при самых разных заболеваниях.
Судите сами:
- Быстрая утомляемость,
- Мышечная слабость,
- Сонливость,
- Головные боли,
- Снижение внимания,
- Расслоение и ломкость ногтей,
- Тусклость и выпадение волос,
- Головокружения,
- Одышка,
- Учащенное сердцебиение и пр.
Но есть довольно интересные симптомы, которые позволяют заподозрить именно железодефицитную анемию:
- Искажение вкуса: желание есть мел, глину, зубной порошок и пр.
- Пристрастие к резким запахам: бензина, ацетона и др.
- Поперечная исчерченность ногтей.
- Жжение, отечность языка, «географический” язык. Вы также можете услышать от покупателя, что язык стал каким-то странным: гладким, ярко-красным.
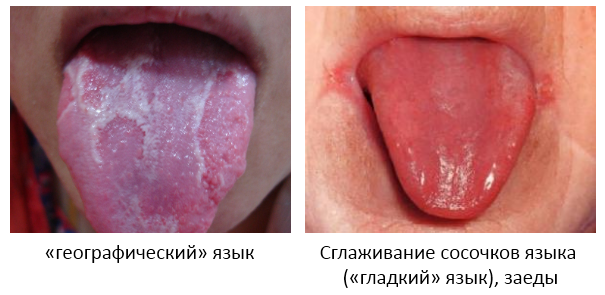
При тяжелой степени анемии обращает на себя внимание бледность кожи, шелушение, сухость, заеды в углах рта.
Для железодефицитной анемии характерны частые ОРВИ, т.к. напомню, что в результате нехватки кислорода страдают ВСЕ клетки организма, в том числе и клетки иммунной системы.
Как подтверждают диагноз анемии?
Чтобы поставить диагноз анемии, достаточно сдать общий анализ крови: в нем будут снижены показатели гемоглобина и эритроцитов. Ориентировочно: гемоглобина меньше 120 г/л, эритроцитов меньше 3,8 * 1012 степени.
Эти нормы несколько отличаются в зависимости от пола и возраста.
Но чтобы поставить диагноз ЖЕЛЕЗОДЕФИЦИТНОЙ анемии, нужно знать цветовой показатель, объем эритроцита, среднее содержание гемоглобина в эритроцитах, количество ретикулоцитов (предшественников эритроцитов), сывороточное железо (уровень железа в белках-переносчиках), ферритин сыворотки (уровень запасов железа), железосвязывающую способность сыворотки.
Вывод: гемоглобин снижается при ЛЮБОЙ анемии, но для уточнения ее ВИДА нужен еще (как минимум) биохимический анализ крови, поэтому без врача не обойтись.
Лечение разных видов анемий, как вы понимаете, разное. Например, при В12-дефицитной анемии основу лечения составляет цианокобаламин, т.е. витамин В12.
При фолиеводефицитной анемии – фолиевая кислота.
Принципы лечения железодефицитной анемии
- Выявление причины анемии и ее устранение, поэтому могут понадобиться консультация гинеколога, проктолога, гастроэнтеролога, фиброгастроскопия, колоноскопия и пр.
- Назначение железосодержащих препаратов обязательно!
- Лечение не должно прекращаться после нормализации гемоглобина, т.к. нужно создать запас железа в организме. Поэтому сначала проводится насыщающая терапия (1-3 мес.), потом поддерживающая в меньшей дозировке еще 1-2 месяца.
- Предпочтение пероральным формам, т.к. препараты железа для внутримышечного или внутривенного введения могут вызвать анафилактический шок, образование инфильтрата, абсцесса в месте введения, развитие флебита, т.е. воспаления венозной стенки. В связи с этим парентеральные формы препаратов железа назначаются в крайних случаях: при заболеваниях ЖКТ, когда нарушается всасывание железа, непереносимости препаратов для приема внутрь, необходимости быстрого насыщения железом, например, перед операцией.
На сегодня, пожалуй, все.
В следующий раз продолжим эту тему.
А пока я прошу вас подумать вот над чем:
- Зачем в некоторых препаратах двухвалентного железа присутствует аскорбиновая кислота? Ведь оно и так хорошо всасывается.
- Как вы думаете, почему у вегетарианцев может быть нормальный гемоглобин?
- Какие советы вы дадите покупателю при продаже препарата железа?
И большая просьба к вам:
Напишите, пожалуйста. какие препараты железа чаще всего назначают врачи, какие вы хотите разобрать, какие вопросы задают вам покупатели, и какие вопросы остались у вас по сегодняшней теме.
С любовью к вам, Марина Кузнецова
Железо является важным элементом в биологии, необходимым для многочисленных клеточных процессов. Избыток или недостаток железа может принести вред организму.
У млекопитающих нет контролируемых механизмов выведения избытка железа, следовательно, гомеостаз железа в организме регулируется в местах абсорбции и утилизации отходов. Печень стала основным местом системной регуляции железа, являясь местом, где вырабатывается железо-регуляторный гормон гепсидин.
Гепсидин является негативным регулятором поглощения и переработки железа. Он связывается с единственным известным клеточным экспортером железа ферропортином и вызывает его интернализацию и деградацию, тем самым уменьшая отток железа из клеток-мишеней и снижая уровень сывороточного железа. Большая часть исследований в области метаболизма железа сосредоточена на регуляции гепсидина и его взаимодействия с ферропортином.
Поглощение железа[править | править код]
Схематическое изображение основных молекул и путей регуляции экспрессии гена HAMP в гепатоцитах и функции HAMP в регуляции FPN. IL-6, интерлейкин 6; IL-6-R, рецептор IL-6; BMP6, костный морфогенетический белок 6; BMP-R, рецептор BMP; HJV, гемоювелин; МТ-2, матриптаза-2; HFE, белок гемохроматоза; GDF15, фактор дифференциации роста 15; ERFE, эритроферрон; DMT1, двухвалентный металлический транспортер 1; DcytB, дуоденальный цитохром B.
Приблизительно 2 мг железа всасывается ежедневно в двенадцатиперстной кишке и проксимальном отделе тонкой кишки. Это компенсируется потерями в результате шелушения кожи, отслоения эпителиальных клеток кишечника и кровопотери. Тело человека не имеет контролируемых механизмов выведения железа, поэтому уровень железа в организме балансируется путем регулирования поглощения железа. Железо в рационе находится в форме Fe3+, степень окисления сначала нужно уменьшить до Fe2+, прежде чем оно может быть поглощено; это достигается действием мембраносвязанной железоредуктазы двенадцатиперстной кишки.[1]
Для входа в системную циркуляцию железу необходимо пересечь базолатеральную мембрану кишечных энтероцитов. Это достигается единственным известным экспортером железа, ферропортином, белком трансмембранного домена, кодируемым SLC40A1 геном.[2][3][4]
Ферропортин является единственным известным белок-экспортёром клеточного железа. Это выражено наиболее высоко в макрофагах, дуоденальных энтероцитах и гепатоцитах, то есть в тех типах клеток, что участвуют в переработке железа, абсорбции и хранении.[4] Экспрессию ферропортина можно контролировать на транскрипционном, трансляционном и посттрансляционном уровне.
мРНК ферропортин содержит функциональный IRE (Iron response element) в его 5’UTR и, подобно H и L ферритину, его перевод подавляется в условиях дефицита железа, с результирующим сокращением экспорта клеточного железа.[4]
На системном уровне наиболее важный механизм, регулирующий ферропортин, включает печеночный железо-регуляторный гормон гепсидин. Гепсидин первоначально был идентифицирован в плазме и моче как маленький, состоящий из 25 аминокислот, печеночный антимикробный пептид. Гепсидин уменьшает клеточный экспорт железа путем связывания с ферропортином и вызывает его интернализацию и деградацию.[5][6]
Основные молекулы и пути, ответственные за железо, воспаление и эритропоэтическую регуляцию гепсидин в гепатоцитах изображены вверху рисунка. Роль гепсидина из гепатоцитов в регуляции всасывания железа у энтероцитов двенадцатиперстной кишки и рециклинг железа в макрофагах через его взаимодействие с FPN изображены в нижней части рисунка. Маленькие красные круги обозначают железо.
Ферроптоз[править | править код]
Ферроптоз – это форма регулированной гибели клеток, что происходит в результате железо-зависимого перекисного окисления липидов.
Впервые ферроптоз был описан в 2012 году при проведении высокопроизводительного скрининга молекул, которые избирательно убивают клетки с гиперэкспрессией онкогенного HRas.[7] Однако последующие работы показали, что клетки с активированной HRas не являются единственными мишенями. Ферроптоз также вовлечен в патологическую гибель клеток, связанную с дегенеративными заболеваниями (то есть заболеваниями Альцгеймера, Хантингтона и Паркинсона), канцерогенезом, инсультом, внутримозговым кровоизлиянием, черепно-мозговой травмой, ишемией-реперфузионным повреждением и дегенерацией почек у млекопитающих, а также участвует при тепловом стрессе у растений.[8]
Ферроптоз значительно отличается от таких процессов, как апоптоз, некроз и аутофагия.[7] Морфологически ферроптоз характеризуется уменьшенным размером митохондрий с увеличенной плотностью их мембран.[7][9] Для ферроптоза не характерно фрагментация ядра, маргинация хроматина, активации каспаз, а также истощение внутриклеточных запасов АТФ. Механистически ферроптоз вызывает гибель клеток путем накопления липидных ROS (активных форм кислорода), что нарушает целостность клеток, текучесть и проницаемость мембран.
Таким образом, образование ROS под действием ионов железа или же ферментов, кофактором которых выступают ионы ферума, является первопричиной ферроптотической гибели клеток.[10] Так увеличение внутриклеточной концентрации железа или активности трансферрина способствуют возрастанию чувствительности клеток к ферроптозу. И наоборот, хелатирования железа снижает ферроптоз.[11]
В ферроптозе также отыграют роль и другие источники ROS. В некоторых клетках ферменты семейства NOX вносят важный вклад в этот процесс, в особенности NOX1 (NAPDH -оксидаза 1), что способствует выработке NAPDH, и в последствии активных форм кислорода.[7] NAPDH продуцируется несколькими клеточными реакции, но пентозофосфатный путь особенно важен для ферроптоза в Ras-мутированных раковых клетках.
Модуляторы и ингибиторы ферроптоза[править | править код]
Модуляторы ферроптоза были определены путем изучения ферроптических механизмов. Так разделяют индукторы I и II классов.
Индукторы ферроптоза класса I косвенно снижают функцию GPX4 (глутатион-зависимой пероксидазы), истощая GSH (глутатион).
Индукторы ферроптоза класса I включают:
- Эрастин, производные эрастина (альдегид эрастин, морфолин эрастин II и пиперазин эрастин)
- Бутионинсульфоксимин
- DPI2
- Глутамат
- Ланперизон
- Сульфасалазин
- SRS13-45, SRS13-60
- Сорафениб
Индукторы ферроптоза класса II напрямую ингибируют функцию GPX4 и включают DPI7, DPI10, DPI12, DPI13, DPI17, DPI18, DPI19, ML162 и RSL3.[7]
Ингибиторы ферроптоза проявляют различные механизмы действия, что в основном нацелены на уменьшение концентрации ROS. К ним относятся:
- Антиоксиданты
- Ферростатин-1 и его производные (SRS8-72, SRS11-92, SRS12-45, SRS13-35, SRS13-37, SRS16-86)[11]
- β-меркаптоэтанол
- Хелаторы железа: десфероксамин, 2,2-бипиридил и циклопироксоламин
- Циклогексимид
- Феноксиуксусная кислота
- Эбселен
Патологии при метаболизме железа[править | править код]
Изучение заболеваний, связанных с дефицитом железа или избытка железа было ключом к улучшению понимания гомеостаза железа и его регуляции. Дефицит железа является наиболее часто встречающимся среди прочих необходимых элементов во всем мире. Согласно данным ВОЗ, примерно 25% населения страдает от железодефицитной анемии.[12] Причиной этой анемии может послужить как низкое потребление железа, так и инфекционные болезни и другие причины хронического воспаления, которые уменьшают поглощение и доступность железа. Избыток железа, в свою очередь, также может нанести вред здоровью. Избыток железа обычно наследуется и обусловлен первичными дефектами в молекулах, регулирующих гомеостаз железа и называются наследственными гемохроматозом. Избыточное накопление железа в тканях может привести к повреждению тканей и заболеваний, в том числе фиброзу печени, сахарному диабету, артропатии, дисфункции эндокринной системы и кардиомиопатии.[13]
Роль железа в канцерогенезе[править | править код]
Железо, из-за своей способности участвовать в окислительно –восстановительных процессах и образовании свободных радикалов, может стать косвенной причиной развития рака. Также известно, что железо играет определенную роль в микроокружении опухоли и в метастазе.
В популяционных исследованиях используются четыре основных подхода для изучения взаимосвязи между железом и риском развития рака. Один был нацелен на определение связанного с трансферрином (TF) ионов железа (Fe3 +). Второй аналитический подход исследовал связь между потреблением железа в рационе и риском развития рака. Так было показано повышения риска развития колоректального рака при более высоком потреблении железа. Также были подходы, что заключались в использовании генетически индуцированного накопления железа. В совокупности они подтверждают модель, в которой повышенные уровни железа в организме связаны с повышенным риском развития рака.[14]
Для злокачественных клеток замечена характерное повышение внутриклеточной концентрации железа, что стимулирует активность железо зависимых белков и способствует усилению пролиферации.
Внутриклеточные процессы с участием железа и их связь с раком[править | править код]
Накопление железа[править | править код]
Многие исследования показали, что раковые клетки имеют повышенную экспрессию трансферринового рецептора 1 (TFRC1), что связывает трансферрин и необходим для связывания железа и регуляции роста клеток. Особенно это проявляется при раке молочных желез, клеток почек и немиелиновых клеток легких.
Экспрессия TFRC1 регулируется на посттранскрипционном уровне IRP в ответ на внутриклеточные уровни железа. TFRC1 также является прямой транскрипционной мишенью онкопротеина c-Myc.
В дополнение к увеличению усвоения железа раковые клетки могут увеличивать концентрацию внутриклеточного железа за счет модулирования уровня ферритина, что выступает пулом железа. Ферритин накапливает избыточное железо, тем самым предотвращая образование ROS под действием ионов ферума. Гипо экспрессия ферритина наблюдается во многих раковых тканях, включая рак молочной железы, поджелудочной железы и гепатоцеллюлярный рак, лимфому Ходжкина и мультиформную глиобластому.
Отток железа[править | править код]
Отток железа, опосредованный FPN-1 (ferroportin-1) и контролируемый пептидным гормоном гепсидином, играет важную роль в росте опухоли и метастазировании. Изменение регуляции FPN-1 наблюдается при многих типах рака (молочной железы, простаты, гепатоцеллюлярного рака).
Экспрессия FPN-1 регулируется на транскрипционном, посттранскрипционном и посттрансляционном уровнях. В макрофагах FPN-1 транскрипционно регулируется гемом, который увеличивает транскрипцию FPN-1 путем модуляции связывания Bach1 (BTB domain and CNC homolog 1). Bach1 с элементом антиоксидантного ответа (ARE) присутствует в промоторной последовательности FPN-1 и репрессирует его транскрипцию.[15] Гем вызывает деградацию Bach1, что приводит к угнетению процесса транскрипции. Другим фактором, влияющим на транскрипцию FPN-1, является гипоксия; активация индуцируемого гипоксией фактора (HIF) в энтероцитах усиливает экспрессию FPN-1.
Посттранскрипция, FPN-1 регулируется IRP. Большинство типов клеток преимущественно экспрессируют мРНК изоформы 1a FPN-1, которая содержит 5′-IRE. В условиях дефицита железа IRP связываются с 5′-IRE, репрессируя трансляцию FPN-1 и снижая экспрессию FPN-1 на клеточной мембране.
FPN-1 также регулируется посттрансляционно пептидным гормоном гепсидином, который связывается с FPN-1, что приводит к его протеолизу в лизосомах.
Механизмы, лежащие в основе снижения экспрессии FPN-1 в раковых клетках, до конца не изучены.
Железо и микроокружение опухоли[править | править код]
Опухоли существуют в богатой микросреде, которая включает эндотелиальные клетки и макрофаги. Недавно было показано, что M2-поляризованные макрофаги вызывают такую экспрессию генов, что влияет на отток железа: увеличение ферропортина и уменьшение ферритина.[16] Таким образом кондиционированная среда из макрофагов М2 способствует накоплению избытка железа и пролиферации опухолевых клеток. Ферритин, который наиболее известен своей ролью пула внутриклеточного железа, также секретируется макрофагами. Он может способствовать ангиогенезу опухоли, связывая расщепленный высокомолекулярный кининоген (HMWK; также известный как кининоген 1), которая является эндогенным ангиогенезным ингибитором.[17]
Источники[править | править код]
- ↑ A. T. McKie. An Iron-Regulated Ferric Reductase Associated with the Absorption of Dietary Iron // Science. — 2001-03-02. — Т. 291, вып. 5509. — С. 1755–1759. — doi:10.1126/science.1057206.
- ↑ Adriana Donovan, Alison Brownlie, Yi Zhou, Jennifer Shepard, Stephen J. Pratt. Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter (англ.) // Nature. — 2000-2. — Vol. 403, iss. 6771. — P. 776–781. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/35001596.
- ↑ A. T. McKie, P. Marciani, A. Rolfs, K. Brennan, K. Wehr. A novel duodenal iron-regulated transporter, IREG1, implicated in the basolateral transfer of iron to the circulation // Molecular Cell. — 2000-2. — Т. 5, вып. 2. — С. 299–309. — ISSN 1097-2765.
- ↑ 1 2 3 Sherry Abboud, ¶, David J. Haile, ¶. A Novel Mammalian Iron-regulated Protein Involved in Intracellular Iron Metabolism (англ.) // Journal of Biological Chemistry. — 2000-06-30. — Vol. 275, iss. 26. — P. 19906–19912. — ISSN 1083-351X 0021-9258, 1083-351X. — doi:10.1074/jbc.M000713200.
- ↑ A. Krause, S. Neitz, H. J. Mägert, A. Schulz, W. G. Forssmann. LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity // FEBS letters. — 2000-09-01. — Т. 480, вып. 2-3. — С. 147–150. — ISSN 0014-5793.
- ↑ Christina H. Park, Erika V. Valore, Alan J. Waring, Tomas Ganz. Hepcidin, a Urinary Antimicrobial Peptide Synthesized in the Liver (англ.) // Journal of Biological Chemistry. — 2001-03-16. — Vol. 276, iss. 11. — P. 7806–7810. — ISSN 1083-351X 0021-9258, 1083-351X. — doi:10.1074/jbc.M008922200.
- ↑ 1 2 3 4 5 Scott J. Dixon, Kathryn M. Lemberg, Michael R. Lamprecht, Rachid Skouta, Eleina M. Zaitsev. Ferroptosis: An Iron-Dependent Form of Nonapoptotic Cell Death (англ.) // Cell. — 2012-5. — Vol. 149, iss. 5. — P. 1060–1072. — doi:10.1016/j.cell.2012.03.042.
- ↑ Brent R. Stockwell, José Pedro Friedmann Angeli, Hülya Bayir, Ashley I. Bush, Marcus Conrad. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease (англ.) // Cell. — 2017-10. — Vol. 171, iss. 2. — P. 273–285. — doi:10.1016/j.cell.2017.09.021.
- ↑ Andreas Linkermann, Rachid Skouta, Nina Himmerkus, Shrikant R. Mulay, Christin Dewitz. Synchronized renal tubular cell death involves ferroptosis // Proceedings of the National Academy of Sciences of the United States of America. — 2014-11-25. — Т. 111, вып. 47. — С. 16836–16841. — ISSN 1091-6490. — doi:10.1073/pnas.1415518111.
- ↑ Scott J. Dixon, Brent R. Stockwell. The role of iron and reactive oxygen species in cell death // Nature Chemical Biology. — 2014-1. — Т. 10, вып. 1. — С. 9–17. — ISSN 1552-4469. — doi:10.1038/nchembio.1416.
- ↑ 1 2 Wan Seok Yang, Brent R. Stockwell. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells // Chemistry & Biology. — 2008-3. — Т. 15, вып. 3. — С. 234–245. — ISSN 1074-5521. — doi:10.1016/j.chembiol.2008.02.010.
- ↑ Erin McLean, Mary Cogswell, Ines Egli, Daniel Wojdyla, Bruno de Benoist. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993–2005 (англ.) // Public Health Nutrition. — 2009-4. — Vol. 12, iss. 04. — P. 444. — ISSN 1475-2727 1368-9800, 1475-2727. — doi:10.1017/S1368980008002401.
- ↑ C. Niederau, R. Fischer, A. Pürschel, W. Stremmel, D. Häussinger. Long-term survival in patients with hereditary hemochromatosis // Gastroenterology. — 1996-4. — Т. 110, вып. 4. — С. 1107–1119. — ISSN 0016-5085.
- ↑ Suzy V. Torti, Frank M. Torti. Iron and cancer: more ore to be mined (англ.) // Nature Reviews Cancer. — 2013-5. — Vol. 13, iss. 5. — P. 342–355. — ISSN 1474-1768 1474-175X, 1474-1768. — doi:10.1038/nrc3495.
- ↑ Wenli Guo, Shuping Zhang, Yue Chen, Daoqiang Zhang, Lin Yuan. An important role of the hepcidin-ferroportin signaling in affecting tumor growth and metastasis // Acta Biochimica Et Biophysica Sinica. — 2015-9. — Т. 47, вып. 9. — С. 703–715. — ISSN 1745-7270. — doi:10.1093/abbs/gmv063.
- ↑ Stefania Recalcati, Massimo Locati, Agnese Marini, Paolo Santambrogio, Federica Zaninotto. Differential regulation of iron homeostasis during human macrophage polarized activation // European Journal of Immunology. — 2010-3. — Т. 40, вып. 3. — С. 824–835. — ISSN 1521-4141. — doi:10.1002/eji.200939889.
- ↑ David H. Manz, Nicole L. Blanchette, Bibbin T. Paul, Frank M. Torti, Suzy V. Torti. Iron and cancer: recent insights: Iron and cancer (англ.) // Annals of the New York Academy of Sciences. — 2016-3. — Vol. 1368, iss. 1. — P. 149–161. — doi:10.1111/nyas.13008.
