Миелограмма при в 12 дефицитной анемии
Медицина / Патология / Патология (статья)
B9- и B12-дефицитные анемии
Статья |
21-10-2018, 18:11
|
 АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
АнемияМегалобластная анемия – одна из форм анемии, представляющая большую группу заболеваний, которые возникают в результате нарушения синтеза ДНК в эритроидных клетках; характеризуется мегалобластным типом кроветворения. Нарушение синтеза ДНК происходит при дефиците витаминов B9 (фолиевая кислота) и B12 (цианокобаламин), некоторых генетических нарушениях (наследственных патологиях, сопровождающихся нарушением активности ферментов, принимающих участи в синтезе коферментов фолиевой кислоты или утилизации оротовой кислоты (оротовая ацидурия)).
При мегалобластной анемии в костном мозге определяются клетки с характерными морфологическими признаками: крупные, незрелые по внешнему виду ядра, окруженные относительно более зрелой цитоплазмой. С точки зрения биохимии основной причиной этого состояния является нарушение синтеза ДНК: в S-фазе клеточного цикла клетки прекращают развиваться (при частичной репликации ДНК клетка не может завершить процесс деления). При этом синтез РНК не нарушен. Происходит нарушение дифференцировки ядра. Учитывая, что синтез цитоплазматических компонентов очень интенсивный (особенно гемоглобина), площадь клеток-эритроидных предшественников очень расширена – это способствует образованию макроцитов (гиперхромных эритроцитов крупных размеров) или мегалоцитов. Такие изменения также характерны для гранулоцитарных предшественников и мегакароцитов.
Впервые мегалобласная анемия была описана английским ученым Аддисоном (Addison) в 1849 году. Аддисон обозначил ее как злокачественную (пернициозную). Врач Фенвик (Fenwick) из Лондона в 1870 году при вскрытии больного с пернициозной анемией обнаружил атрофию слизистой оболочки желудка. Немецкий врач Биермер (Biermer, Цюрих) в 1872 году в отношении этой патологии применил термин «прогрессирующая пернициозная анемия». А в 1880 ученый Эрлих (Ehrich) в костном мозге больных пернициозной анемией обнаружил крупные клетки со специфической структурой – мегалобласты. В начале XX века пернициозная анемия была одной из самых распространенных патологий крови и считалась неизлечимой.
Специалистам, которые изучали эту патологию и методы ее лечения, было присвоено пять Нобелевских премий. В 1930 году Касл (Castle) предполагал, что в мясе животных содержится «внешний фактор», который связывается с «внутренним фактором», в результате чего образуется так называемое гемопоэтическое вещество, способное усваиваться и депонироваться в печени. Ученые Минот (Minot), Марфи (Murphy) и Випл (Whipple) получили Нобелевскую премию в области медицины и физиологии за новый метод лечения пернициозной анемии сырой печенью. В 1948 году сразу две группы ученых (в США под руководством Фолкерса (Folkers) и в Великобритании под руководством Лестера-Смита (Lester-Smith)) выделили внешний фактор, витамин B12. Также Нобелевскую премию получила Дороти Кроуфут-Хоткин (Dorothy Crowfoot-Hodgkin) за изучение структуры пенициллина и витамина B12.
Витамин B12 (цианокобаламин) обладает структурой корриноида, в основе которой находится углеродная структура коррина, схожего по строению с порфирином. Цианокобаламин – сложная по структуре молекула с центральным атомом кобальта, который связан с четырьмя пиррольными кольцами и нуклеотидом. Витамин B12 имеет две коферментные формы – аденозилкобаламин и метилкобаламин. В крови человека основная форма витамина B12 – метилкобаламин.
Витамин B12 содержится только в продуктах животного происхождения (печень, почки, мясо, молоке и молочных продуктах). Небольшое количество этого витамина синтезируется в кишечнике человека. Цианокобаламин практически не содержится в продуктах растительного происхождения. У травоядных животных синтез витамина B12 происходит в желудке благодаря микроорганизмам, обитателям бобовых и корнеплодов, затем витамин попадает в паренхиматозные ткани и мышцы этих животных. Максимальная концентрация цианокобаламина в печени и почках животных (примерно 100 мкг/100 г продукта). В мясе содержание цианокобаламина гораздо ниже (примерно 0,5-2,0 мкг/100 г). Содержание витамина B12 в молоке и яйцах еще ниже, кроме этого, из-за прочной связи с протеином кобалафилином, содержащийся в этих продуктах витамин плохо усваивается. Цианокобаламин под действием протеолитических ферментов высвобождается в желудке и при кулинарной обработке продуктов.
Через стенки кишечника цианокобаламин попадает в кровь, где вступает в связь с транскобаламином II (транспортным протеином) и через воротную вену распределяется по кровеносной системе, откуда попадает в ткани-мишени.
Содержание цианокобаламина в организме взрослого человека составляет от 2 до 5 мг. Основной запас витамина B12, которого хватает на несколько лет (3-6), находится в печени. Экскреция (выведение из организма) цианокобаламина осуществляется через кишечник (с калом) и почки (с мочой), и составляет примерно 2-5 мкг в сутки. Суточная потребность организма взрослого человека в витамине B12 составляет 3-7 мкг.
Коферменты витамина B12 принимают участие в процессе синтеза ДНК, а также в регуляции функции системы гемопоэза и нервной системы. В крови содержится в большей степени активная форма витамина – метилкобаламин, который участвует в синтезе тетрагидрофолиевой кислоты, необходимой для образования тимидина.
Дефицит витамина B12 приводит к нарушению метаболизма фолатов и синтеза ДНК, в результате чего пролиферирующие кроветворные клетки не способны полностью созревать и нормально делиться. При этом в костном мозге развивается мегалобластический тип кроветворения, что приводит к появлению гигантских клеток миелопоэза и мегакариоцитопоэза. Из-за дефицита витамина B12 или B9 образуется недостаточное количество тетрагидрофолата, что вызывает развитие мегалобластной анемии по причине снижения синтеза нуклеиновых кислот.
Клиническая картина
Классическая картина B12-дефицитной анемии состоит из трех основных синдромов:
- Анемический синдром (см статью «Анемия. Общие положения. Классификация»)
- Желудочно-кишечный
- Неврологический
B12-дефицитная анемия, как правило, манифестирует в возрасте 50-60 лет (при этом такие пациенты часто выглядят старше своего возраста). Этот вид анемии наиболее широко распространен в Скандинавских странах, что обусловлено предрасположенностью к этой патологии голубоглазых блондинов.
B12-дефицитная анемия имеет три степени тяжести:
I степень: Легкая – концентрация гемоглобина в крови > 90 г/л
II степень: Средняя – концентрация гемоглобина в крови 70-90 г/л
III степень: Тяжелая – концентрация гемоглобина в крови < 70 г/л
Как правило больные обращаются к врачу при средней и тяжелой степени анемии. Часто от появления первых симптомов анемии до постановки диагноза проходит более года.
B12-дефицитная анемия обычно дебютирует анемическим синдромом (больного беспокоит слабость, повышенная утомляемость, тахикардия, одышка при незначительной физической нагрузке). По причине относительно медленного развития патологии выраженность анемии по данным лабораторных анализов часто оказывается большей, чем врачи ожидают при анализе клинических данных. Исключением являются больные, у которых неврологическая симптоматика усиливается быстрее, чем анемический синдром. Бывают случаи, когда характерное при глоссите жжение зыка возникает раньше, чем проявления анемии. У больных могут наблюдаться парестезии. При тяжелых случаях развивается фуникулярный миелоз, характеризующийся нарушениями чувствительности и походки. В случае дальнейшего прогрессирования патологии у больного возникают нарушения зрения, расстройства мочеиспускания. Нарушения функций желудочно-кишечного тракта наблюдаются примерно у 40-50% пациентов, страдающих B12-дефицитной анемией.
Объективное обследование пациента с B12-дефицитной анемией позволяет обнаружить характерную бледность кожи (с лимонно-желтым оттенком), субиктеричность кожи и склер. У ряда больных обнаруживаются объективные признаки глоссита (язык приобретает алый цвет с участками воспаления; сосочки языка сглаженные, иногда атрофированные – «лакированный» язык; отметим, что эти симптомы встречаются очень редко, как и глубокая мегалобластная анемия). Незначительное увеличение печени и селезенки при B12-дефицитной анемии наблюдается у 10-20% пациентов. Но у большинства пациентов патология сопровождается только анемическим синдромом, который часто является единственным клиническим признаком даже при тяжелой степени анемии.
Диагностика анемии основана на анамнезе, клинической картине, морфологическом исследовании клеток крови и костного мозга, анализа крови на содержание цианокобаламина и фолиевой кислоты.
Диагностика B12-дефицитной анемии
При B12-дефицитной анемии происходят характерные изменения гемограммы, включающие лейкопению, макроцитарную анемию, тромбоцитопению, а также гиперсегментированные нейтрофилы в мазке крови.
Мегалобластные анемии характеризуются преимущественным снижением уровня эритроцитов и в меньшей степени гемоглобина. Гиперхромия в этом случае проявляется повышением величины гемоглобина > 35 пг или цветового показателя > 1,1. Также увеличивается средний объем эритроцитов (> 100 фл и даже > 120 фл). В случаях, когда B12-дефицитная анемия сочетается с железодефицитной анемией или анемией хронического воспаления, средний объем эритроцитов может оставаться в пределах нормы. Выраженное повышение уровня ретикулоцитов (200-300% и выше) развивается на 5-8 день лечение витамином B12 – это повышение является подтверждением диагноза. Кроме этого, у многих пациентов наблюдается лейкопения (выраженность лейкопении часто коррелирует со степенью тяжести анемии). В некоторых случаях может наблюдаться снижение уровня тромбоцитов.
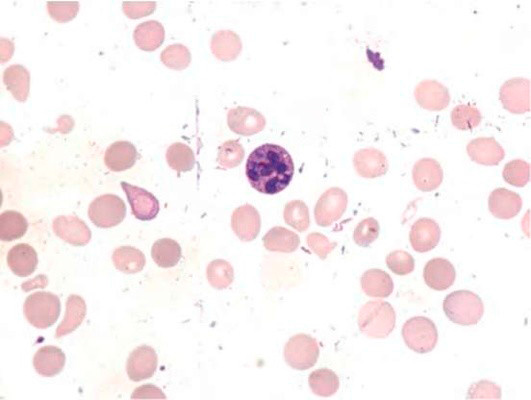
Большое диагностическое значение среди биохимических анализов крови имеет исследование уровня цианокобаламина. В миелограмме при нормальном или повышенном уровне миелокариоцитов обнаруживается выраженная гиперплазия эритроидного ростка и мегалобластический тип кроветворения (см рис. 1-7).
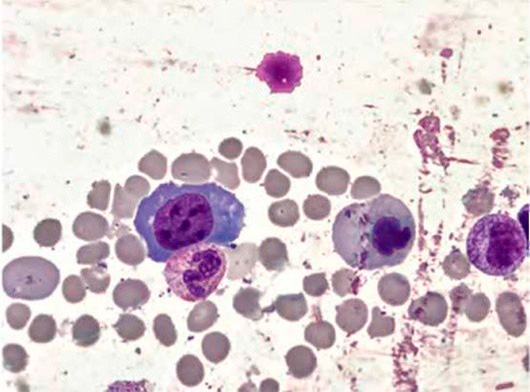
Рисунок 1. B12-дефицитная анемия. Костный мозг. Мегалобласты (окр. по Романовскому-Гимзе; ув. ×100)
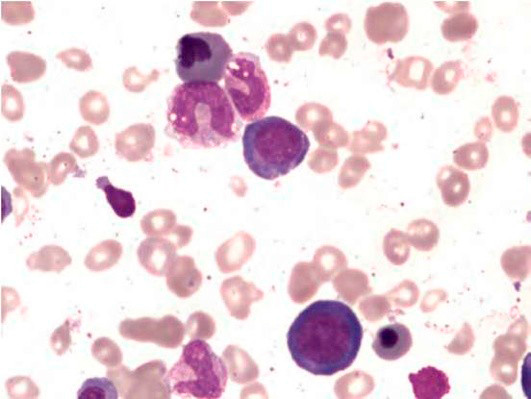
Рисунок 2. B12-дефицитная анемия. Костный мозг. Мегалобласты. Гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
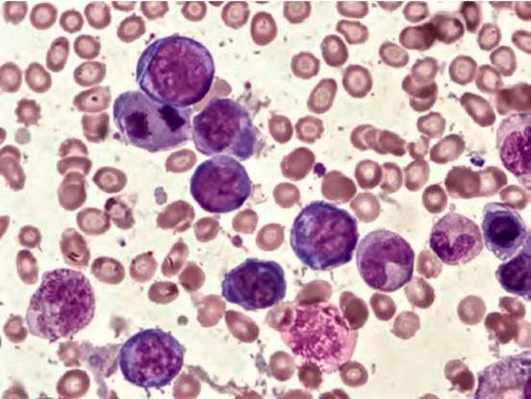
Рисунок 3. B12-дефицитная анемия. Костный мозг. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
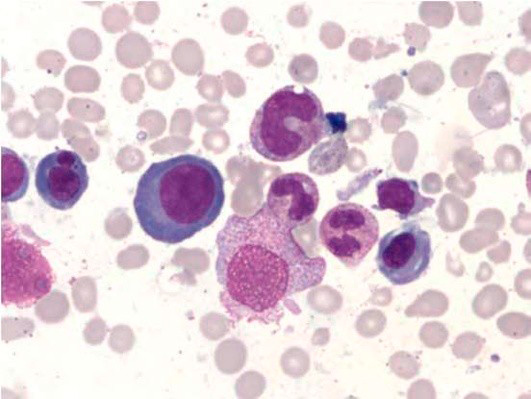
Рисунок 4. B12-дефицитная анемия. Препарат костного мозга. Мегалобластный тип кроветворения (окр. по Романовскому-Гимзе; ув. ×100)
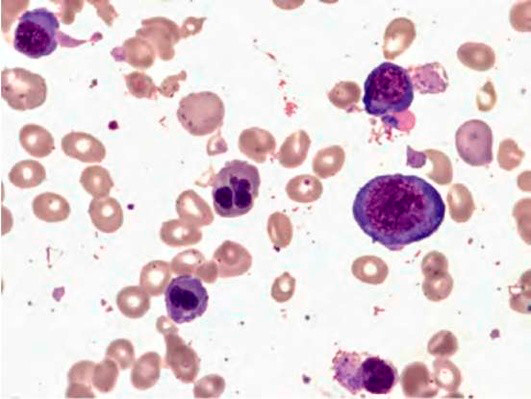
Рисунок 5. B12-дефицитная анемия. Препарат костного мозга. Множественные базофильные мегалобласты – «синий костный мозг» (окр. по Романовскому-Гимзе; ув. ×100)
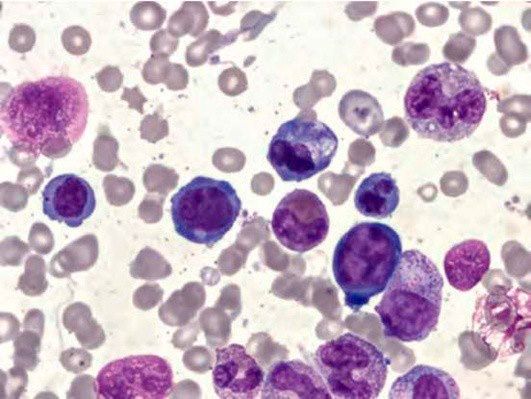
Рисунок 6. B12-дефицитная анемия. Препарат костного мозга. Мегалобласты, гигантские палочкоядерные нейтрофилы (окр. по Романовскому-Гимзе; ув. ×100)
Такие изменения миелограммы можно наблюдать только до начала терапии витамином B12. В аспирате костного мозга, полученного даже после однократной инъекции препарата, мегалобласты исчезают, а мегалобластический тип кроветворения сменяется нормобластическим. Отметим, что очень важным диагностическим критерием является высокий уровень лактатдегидрогеназы в крови.
Основа диагностики B12-дефицитной анемии в гематологии – анализ костного мозга на предмет наличия мегалобластов и миелоцитов с метамиелоцитами (гигантских клеток-предшественников гранулоцитопоэза). Но на практике эти клетки обнаруживаются не во всех случаях (даже если у больного явная форма анемии). Предположительно это происходит из-за того, что какое-то количество цианокобаламина больной все-таки как-то получил, что послужило причиной временного изменения гемопоэза, но не позволило полностью улучшить состояние. Но точные причины такого парадокса неизвестны. Поэтому с целью диагностики типичного случая B12-дефицитной анемии достаточно провести анализ периферической крови, с помощью которого можно определить гиперхромную макроцитарную анемию (при дифференциальной диагностике только патологий из группы миелодиспластических синдромов!). При этом могут обнаруживаться гиперсегментированные нейтрофилы (см рис. 7, 8), иногда метамиелоциты.
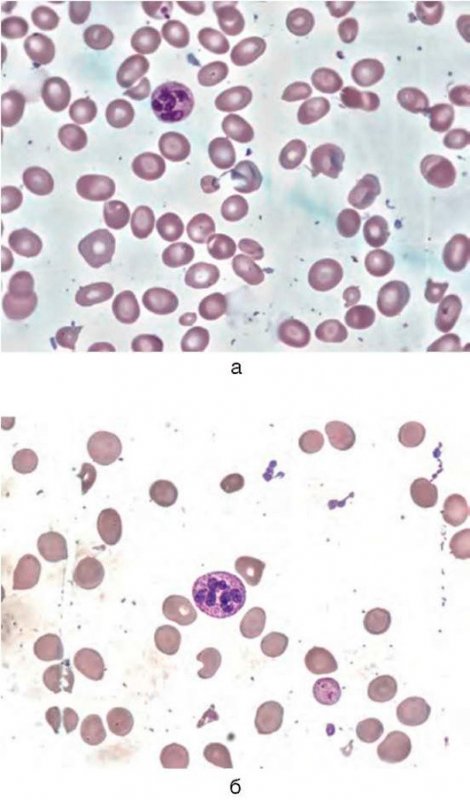 B12-дефицитная анемия
B12-дефицитная анемия
Рисунок 7. B12-дефицитная анемия. Препарат костного мозга. Множественные мегалобласты (окр. по Романовскому-Гимзе; ув. ×100) (а, б)

Рисунок 8. B12-дефицитная анемия. Костный мозг. (окр. по Романовскому-Гимзе; ув. ×100)
Если лабораторные исследования демонстрируют умеренную тромбоцитопению, незначительное повышение уровня непрямого билирубина и значительное повышение концентрации лактатдегидрогеназы, диагноз можно считать подтвержденным (в этом случае проведение дополнительных пункций – лишняя процедура).
При диагностике B12-дефицитной анемии важное значение играет фиброгастроскопия, с помощью которой можно подтвердить диагноз «атрофический гастрит» – главная причина дефицита цианокобаламина. Кроме этого, гастроскопия позволяет исключить злокачественную патологию желудка.
После назначения лечения витаминами B9 и B12 наблюдается следующая динамика изменения показателей лабораторных исследований:
– значительное повышение уровня эритроцитов и гемоглобина в течение 14 дней, показатель которых, в зависимости от выраженности дефицита, нормализуется через 8-12 недель с момента начала лечения; отметим, что уровень гемоглобина повышается медленнее, поэтому его показатель в периферической крови возвращается в норму через 1-2 месяца лечения;
– на 2-4-й день терапии начинает увеличиваться уровень ретикулоцитов, достигает максимума на 8-9-й день, и нормализуется к 14-му дню лечения; при этом повышается уровень тромбоцитов и лейкоцитов;
– на 10-14-й день терапии гиперсегментация ядер нейтрофилов сохраняется;
– в течение 24-48 часов после первого введения препарата в костном мозге исчезают мегалобласты; изменения морфологии ядер гранулоцитов сохраняется еще несколько суток;
– биохимический анализ крови показывает повышение уровня мочевой кислоты и холестерина (максимум достигается на пике ретикулоцитоза); концентрация лактатдегидрогеназы, щелочной фосфотазы и билирубина возвращаются в норму; может наблюдаться незначительное снижение концентрации калия в крови.
Лечение
Пока врачи не могли использовать в терапии препараты цианокобаламина, B12-дефицитная анемия считалось фатальным заболеванием. В те времена ремиссию можно было получить с помощью эмпирического подбора рациона питания, трансфузионной терапии или спленэктомии, но после этого следовал очередные рецидивы, которые приводили к смерти пациента (как правило это происходило через 1-3 года с момента диагностирования патологии).
С целью профилактики развития B12-дефицитной анемии рацион питания должен содержать животный белок (печень, сердце, мясо, рыба, молочные продукты и др). Во время манифестации патологии нужно назначать цианокобаламин. Если у больного диагностированы глистные инвазии, дополнительно назначается противогельминтная терапия.
Сегодня для лечения B12-дефицитной анемии широко применяются два препарата: Цианокобаламин и Оксикобаламин. В нашей стране принято назначать Цианокобаламин: подкожно или внутримышечно 200-400 мкг 1 раз в день на протяжении 4-5 недель. В тяжелых случаях и при развитии фуникулярного миелоза суточная дозировка цианокобаламина повышают до 1000 мкг.
При условии назначения адекватного лечения явное улучшение состояния пациента и нормализацию картины костного мозга можно наблюдать уже на 3-4-е сутки лечения. Повышение уровня ретикулоцитов в периферической крови в среднем на 20-30% (ретикулоцитарный криз) развивается через 1-2 недели. Концентрация билирубина в крови возвращается в норму на протяжении 3-4 недель, лактатдегидрогеназы – через 7-14 дней.
При назначении цианокобаламина ремиссия наступает у всех больных B12-дефицитной анемией.
При отсутствии эффекта от терапии на протяжении нескольких недель, следует предполагать неверную трактовку генеза анемии. В этом случае пациенту необходимо провести дополнительную диагностику, чтобы уточнить причину анемического синдрома.
ФОЛИЕВО-ДЕФИЦИТНАЯ АНЕМИЯ
Эта патология относится к группе мегалобластных анемий. Дефицит фолиевой кислоты приводит к нарушению влияния цианокобаламина на процесс синтеза ДНК, что приводит к развитию мегалобластного типа кроветворения.
Дефицит витамина B9 может возникать из-за недостаточного поступления в организм фолиевой кислоты с пищей, патологий желудочно-кишечного тракта (нарушений усвоения фолиевой кислоты), а также при повышенной потребности организма в этом витамине.
Характерные жалобы пациентов с фолиево-дефицитной анемией – общая слабость и головокружения. Глоссит у таких больных, в отличие от больных B12-дефицитной анемией, развивается очень редко. Также при B9-дефицитной анемии не обнаруживаются признаки фуникулярного миелоза.
Как и при дефиците цианокобалавина, при дефиците фолиевой кислоты в периферической крови обнаруживается макроцитоз, повышается среднее содержание гемоглобина в эритроците и средний объем эритроцитов. В костном мозге появляются мегалобласты. Повышается уровень непрямого билирубина в крови, увеличивается активность лактатдегидрогеназы.
Дефицит фолиевой кислоты в организме приводит к повышению уровня гомоцистеина, что является фактором риска для образования венозных тромбов (из-за чрезмерного влияния гомоцистеина на эндотелий кровеносных сосудов). Гетерозиготное носительство мутации метилтетрагидрофолатредуктазы также является причиной высокого уровня гомоцистеина, однако риск образования тромбов при этом ниже.
Лечение фолиево-дефицитной анемии подразумевает применение препаратов фолиевой кислоты.
– группа заболеваний, характеризующихся дефицитом поступления цианокобаламина (витамина В12) или нарушением его метаболизма.
Основные сведения о метаболизме витамина В12
Суточная потребность в витамине В12 составляет 1-5 мкг. Он содержится в мясе, печени, почках, яичном желтке, сыре, молоке. Поступая в организм, витамин В12 (внешний фактор Касла) соединяется с гастромукопротеином (внутренний фактор Касла), вырабатываемым париетальными клетками желудка. Всасывание витамина В12 происходит в кишечнике. Витамин В12 депонируется преимущественно в печени. При прекращении всасывания в кишечнике витамина В12 его запасов в печени хватает на 3-5 лет. Свою биологическую роль витамин В12 выполняет в виде двух коферментов – метилкобаламина и дезоксиаденозилкобаламина. Метилкобаламин необходим для нормального синтеза ДНК, дезоксиаденозилкобаламин – для нормального метаболизма миелина нервных волокон.
Распространенность.Развитие заболевания характерно преимущественно для возраста 60-70 лет. По данным Herbert (1985) заболевание встречается с частотой 1 случай на 200 человек в возрасте 60-70 лет.
Этиология ЖДА
I. Нарушение секреции желудком гастромукопротеина.
1. Атрофический аутоиммунный гастрит.
2. Тотальная гастрэктомия.
3. Врожденное нарушение секреции гастромукопротеина.
4. Рак желудка.
5. Полипоз желудка.
6. Токсическое действие высоких доз алкоголя на слизистую оболочку желудка.
II. Нарушение всасывания витамина В12 в тонком кишечнике:
1. Резекция участка подвздошной кишки.
2. Синдром мальабсорбции различного генеза.
3. Рак тонкого кишечника.
4. Хронический панкреатит с нарушением секреции трипсина.
5. Нарушение всасывания витамина В12, вызванное лекарственными средствами (колхицин, циметидин, ПАСК и др.)
III. Конкурентное расходование витамина В12:
1. Инвазия широким лентецом.
2. Инвазия власоглавом.
3. Дивертикулез тонкого кишечника.
4. Операции на тонкой кишке с образованием «слепых петель».
IV. Повышенный расход витамина В12:
1. Беременность
2. Злокачественные новообразования
3. Тиреотоксикоз
V. Нарушение поступления витамина В12 с пищей:
Строгое вегетарианство.
Патогенез.
| Дефицит витамина В12 | ||||||||
| Недостаток кофермента метилкобаламина | Недостаток кофермента дезоксиаденозилкобаламина | |||||||
| Атрофия слизистой оболочки ЖКТ (атрофический глоссит, гастрит, энтерит) | Нарушение системы кроветворения – анемия, лейкопения, тромбоцитопения | Нарушение обмена жирных кислот Накопление токсичных метилмалоновой и пропионовой кислот Поражение нервной системы (фуникулярный миелоз) | ||||||
При дефиците витамина В12 нарушается синтез тимидина, что приводит к нарушениям синтеза ДНК и клеточной пролиферации. Наиболее чувствительными к этому оказываются активно делящиеся клетки. В костном мозге нарушается процесс созревания предшественников всех трех ростков кроветворения, что ведет к развитию мегалобластной анемии, лейкопении, тромбоцитопении. Происходит нарушение созревания эпителиальных клеток ЖКТ, обусловливающее развитие атрофии слизистой оболочки желудка и кишечника.
Дефицит витамина В12 приводит к нарушению обмена жирных кислот и накоплению в большом количестве токсичных для нервной системы метилмалоновой и пропионовой кислот, способствующие развитию фуникулярного миелоза.
Клиническая картина.Клиническая картина В12-дефицитной анемии характеризуется поражением трех систем: ЖКТ, кроветворной и нервной.
Характерны жалобы на слабость, одышку, сердцебиение, головокружение, шум в ушах, потемнение в глазах и мелькание мушек перед глазами (анемический синдром); снижение или отсутствие аппетита, отвращение к мясу, боль и жжение в языке, в области десен, ощущение тяжести в подложечной области после еды, отрыжку съеденной пищей и воздухом (синдром поражения ЖКТ); слабость в ногах, ощущение ползания мурашек по ногам, онемение ног (неврологический синдром).
При объективном исследовании: кожа бледная с желтушным оттенком (в связи с гипербилирубинемией, обусловленной гемолизом). Лицо несколько одутловато. Со стороны сердечно-сосудистой системы наблюдаются тахикардия, небольшое расширение границ сердца влево, приглушенность тонов сердца, негромкий систолический шум на верхушке. При осмотре полости рта характерен гладкий «лакированный» язык с атрофированными сосочками. При пальпации живота может определяться умеренная болезненность в эпигастрии, нередко наблюдается увеличение печени и селезенки. Неврологические изменения проявляются снижением вибрационной чувствительности, атрофией мышц, полиневритом, появлением патологических рефлексов. Могут быть изменения психики (депрессия, психозы, галлюцинации).
Диагностика.В общем анализе крови– гиперхромная (ЦП>1,1) макроцитарная (MCV >95) анемия. Обнаруживаются тельца Жолли, кольца Кебота (остатки ядра). Количество ретикулоцитов снижено или нормально. Количество лейкоцитов снижено, относительный лимфоцитоз, появляются гиперсегментированные нейтрофилы. Характерна незначительная тромбоцитопения. Может наблюдаться незначительное увеличение СОЭ.
При подозрении на В12-дефицитную анемию необходимо делать стернальную пункцию до назначения витамина В12!
В миелограмме характерно появление мегалобластного типа кроветворения (крупных гигантских клеток с эксцентричным расположением ядра, цитоплазма окрашивается в синий цвет – «синий костный мозг»).
Биохимический анализ крови – специфических изменений нет, но может быть гипербилирубинемия.
ФГДС – атрофические изменения слизистой ЖКТ, снижение желудочной секреции, ахлоргидрия.
Дифференциальная диагностикапроводится с другими видами анемий.
Фолиеводефицитная анемия. Клиническая картина и патоморфология костного мозга при фолиеводефицитной анемии и при В12 –дефицитной анемии сходны, но глоссита и фуникулярного миелоза не бывает. Заболевание исключают путем определения содержания фолиевой кислоты в эритроцитах и сыворотке крови.
Гемолитические анемии. В анамнезе выявляют гемолитические кризы, переливание препаратов крови, применение лекарственных средств, укусы насекомых или наследственный характер. В клинической картине на фоне общих симптомов анемии отсутствуют признаки фуникулярного миелоза, размеры селезенки обычно увеличены. В анализах крови характерен высокий ретикулоцитоз, повышение непрямого билирубина.
Лечение.К лечению В12 -дефицитной анемии препаратом витамина В12 можно приступать только после установления и верификации диагноза с помощью миелограммы. Даже 1-2 инъекции витамина В12, не устраняя синдром анемии, могут трансформировать мегалобластическое кроветворение в нормобластическое и сделать стернальную пункцию неинформативной.
Назначается цианокобаламин (витамин В12) внутримышечно в дозе 1000 мкг в день постановки диагноза, затем ежедневно в дозе 200-500 мкг 1 раз в день в течение месяца. При фуникулярном миелозе в течение месяца – 1000 мкг/сут. На 5-7 день лечения при его эффективности наступает ретикулоцитарный криз – резкое повышение ретикулоцитов в периферической крови. Затем больной в течение месяца получает 200 мкг/сут. препарата и далее пожизненно 2 раза в месяц по 400-500 мкг.
Трансфузии эритроцитарной массы производят только по жизненным показаниям при угрозе анемической комы.
Течение и прогноз.
Благоприятны при своевременном и адекватном лечении.
ЛЕЙКОЗЫ
Лейкозы – это опухоли кроветворной системы с первичным поражением кроветворных клеток костного мозга, с последующей диссеминацией в периферической крови, селезенке, лимфатических узлах и других тканях.
Лейкозы подразделяют на две основные группы: острые и хронические.
Острые лейкозы (ОЛ) – быстро прогрессирующие формы лейкозов, клеточным субстратом которых являются бластные клетки.
Распространенность. Частота ОЛ 13,2 на 100 000 среди мужчин и 7,7 на 100 000 среди женщин. Острым лимфобластным лейкозом болеют чаще дети и молодые, острым миелоидным лейкозом чаще болеют лица более старшего возраста.
Этиология
Этиология лейкозов неизвестна. К возможным этиологическим факторам в настоящее время относят:
· Ионизирующее излучение – доказательством являются: опыт японских городов Хиросимы и Нагасаки, подвергшихся атомной бомбардировке; увеличение заболеваемости лейкозом среди пациентов, получавших лучевую терапию; зависимая от дозы частота лейкозов среди лиц, профессионально связанных с воздействием ионизирующей радиации.
· Химические вещества – бензол и др. ароматические углеводороды, пестициды и гербициды, цитостатики, применяемые в лечении злокачественных новообразований и ряда других заболеваний.
· Вирусная инфекция – доказана роль вируса Эпштейна-Барра и ретровируса HTLV (human T-cell lymphotropic virus)
· Генетические факторы – при различных хромосомных аномалиях (болезни Дауна, синдроме Клайнфельтера и др.) частота заболеваемости лейкозами выше.
Патогенез
В настоящее время общепризнанной является клоновая теория патогенеза гемобластозов, согласно которой лейкозные клетки являются потомством одной мутировавшей гемопоэтической клетки-предшественницы. Основными свойствами лейкозных клеток являются их неспособность к дифференциации и способность к чрезмерной пролиферации и накоплению в большом количестве в костном мозге. Лейкозы в своем развитии проходят 2 этапа: 1) образование моноклоновой опухоли; 2) формирование злокачественной опухоли с поликлоновой трансформацией, в результате чего опухолевый клон развивается по законам опухолевой прогрессии. При этом имеют место:
· Угнетение нормальных ростков кроветворения в костном мозге
· Появление способности лейкозных клеток расти и размножаться вне органов кроветворения (метастазирование гемобластозов)
· Уход лейкозных клеток из-под контроля цитостатической терапии.
Большую роль в патогенезе лейкозов играет нарушение апоптоза (генетически запрограммированной клеточной смерти). Подавление апоптоза лежит в основе формирования опухолевого клона и метастазирования опухоли.
Классификация
В 1976 году группа гематологов Франции, Америки и Великобритании предложила классификацию ОЛ (FAB-классификация), основанную на морфологических и цитохимических признаках бластных клеток.
Миелоидные лейкозы
М0 – с недифференцированными бластными клетками
М1 – ОМЛ без признаков созревания бластов
М2 – ОМЛ с признаками созревания бластов
М3 – промиелоцитарный лейкоз
М4 – миеломонобластный лейкоз
М5 – монобластный лейкоз
М6 – острый эритромиелоз
М7 – острый мегакариобластный лейкоз
Лимфобластные лейкозы
С-ОЛЛ (ОЛЛ с общим лимфобластным антигеном) (45-55%)
Пре-В-ОЛЛ (20%)
0-ОЛЛ (нуль-лимфобластный лейкоз) (около 10%)
В-ОЛЛ (4-5%)
Т-ОЛЛ (20-31%)
Клиническая картина
Клиническая картина ОЛ очень разнообразна. Абсолютно патогномоничных симптомов ОЛ не существует, что особенно относится к начальному периоду заболевания. Может быть:
· Острое начало заболевания – наблюдается у ½ больных и характеризуется высокой температурой тела, выраженной слабостью, интоксикацией, болями в суставах, в горле, в животе. Как правило, трактуют как грипп, ангину, ОРВИ.
· Начало заболевания с выраженными геморрагическими явлениями – у 10% больных кровотечения различных локализаций (носовые, желудочно-кишечные, церебральные и др.)
· Медленное начало – нарастающая слабость, усталость, боли в костях, мышцах, суставах, появление небольших геморрагий на коже в виде «синяков»
· Бессимптомное (скрытое) начало – у 5% пациентов, общее состояние больных не нарушается, заболевание выявляется случайно при исследовании периферической крови (при заполнении санаторно-курортной карты, прохождении медицинских осмотров и т.д.).
Стадия развернутой клинической картины ОЛ – развивается вследствие интенсивной пролиферации, накопления злокачественных лейкозных клеток и выраженных внекостномозговых проявлений. Можно выделить 5 основных синдромов:
· Гиперпластический
· Геморрагический
· Анемический
· Интоксикационный
· Иммунодефицитный.
Гиперпластический синдром обусловлен лейкозной инфильтрацией тканей. Происходит увеличение лимфатических узлов, печени, селезенки, миндалин. Могут увеличиваться лимфатические узлы в средостении, что приводит к развитию синдрома верхней полой вены (одышка, цианоз, набухание шейных вен). Характерны также гиперплазия десен и развитие тяжелого язвенно-некротического стоматита. На коже появляются лейкозные инфильтраты в виде лейкемидов. Тяжелым проявлением этого синдрома являются лейкозная инфильтрация яичек и поражение нервной системы – нейролейкемия.
Геморрагический синдром выявляется у 50-60% больных; обусловлен тромбоцитопенией, нарушением коагуляционной активности крови в связи с дефицитом свертывающих факторов. Проявляется обширными внутрикожными кровоизлияниями, носовыми, желудочно-кишечными, легочными, маточными, внутрицеребральными кровотечениями.
Анемический синдром обусловлен угнетением красного кроветворного ростка в костном мозге, интоксикацией и кровотечениями. Проявляется бледностью, одышкой, сердцебиением, сонливостью.
Интоксикационный синдром характеризуется выраженной общей слабостью, высокой температурой тела, потливостью, отсутствием аппетита, снижением массы тела, тошнотой, рвотой.
Иммунодефицитный синдром – вследствие угнетения клеточного и гуморального иммунитета возможно развитие различных инфекционно-воспалительных процессов, вплоть до септического состояния.
