Микроангиопатическая гемолитическая анемия симптомы
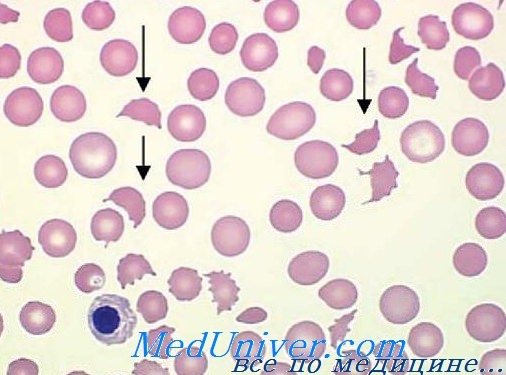
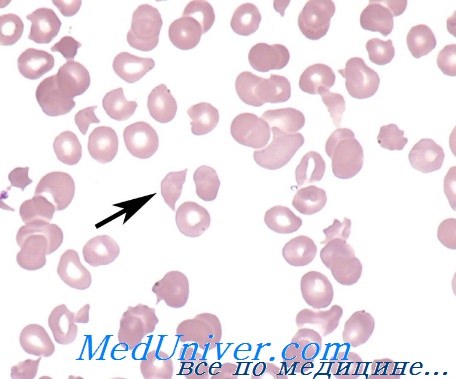
Микроангиопатическая гемолитическая анемия – история изучения, причиныМикроангиопатическая гемолитическая анемия (МГА) относится к группе приобретенных гемолитических анемий по внеэритоцитным причинам, точнее — к подгруппе механических гемолитических анемий. Микроангиопатическая гемолитическая анемия представляет собой частную форму гемолитической анемии, характеризующуся наличием раздробленных эритроцитов («шлемообразные », треугольные, зубчатые, микросфероциты) на мазках крови и признаками внутрисосудистого расплавления крови. Часто тромбоцитопения и расстройство свертывания (Brain) сопровождают микроангиопатическую гемолитическую анемию. Подобно иным видам анемии, микроангиопатическая гемолитическая анемия не составляет самостоятельную единицу, а лишь синдром, развивающийся при ином заболевании или синдроме. Болезни, при которых была описана микроангиопатическая гемолитическая анемия носят общий характер — патологическое изменение небольших сосудов, артериол и капилляров (микроаигиопатия). В 1891 г. Ehrlich впервые отметил наличие раздробленных эритроцитов («шистоциты») на мазке страдающего анемией. В 1949 Schwartz и Motto описали присутствие 0,1—0,5% «надрезанных» (“burr cells”) эритроцитов в мазках крови больных уремией, раком желудка и пептической геморрагической язвой. В 1954 г. Monroe и Strauss сообщили о выявлении раздробленных эритроцитов на срезах отдельных кровеносных сосудов больного, погибшего от тромботической тромбогемолитической пурпуры. Они выдвинули гипотезу, по которой раздробление эритроцитов якобы происходит в ненормальных кровеносных сосудах. В 1962 Brain, Dacie и Hourihane впервые использовали термин «микроангионатическая гемолитическая анемия». В период с 1962 по 1972 гг. Brain и Dacie, в сотрудничестве с другими исследователями, поставили эксперимент микроангиопатической гемолитической анемии на животных, изучили механизм дробления эритроцитов в пробирке, описали процесс внутрисосудистого свертывания у страдающих микроангиопатической гемолитической анемией, реакцию на лечение гепарином и сочетание микроангиопатической гемолитической анемии с метастатическим раком. Понятие микроангиопатической гемолитической анемии общепринято и подтверждено другими авторами. С 1961 г. в литературе был опубликован ряд сообщений о гемолитической анемии, в условиях которой, после хирургического вмешательства на сердце по поводу клапанопластики, протезирования синтетическими клапанами и исправления внутрисердечных дефектов. Гемолитическая анемия с дроблением эритроцитов описана у больных, страдающих тяжелой недостаточностью клапанов (в частности сужение аорты) и коарктацией аорты.
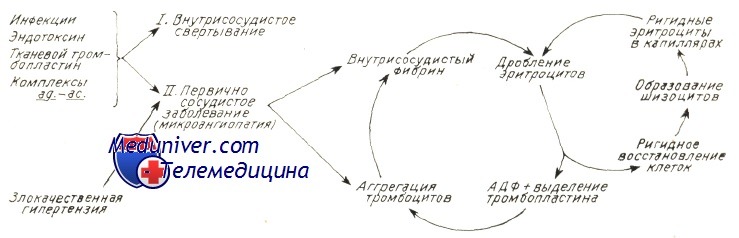
Причины (этиология) микроангиопатической гемолитической анемииМикроангиопатическая гемолитическая анемия описана в сочетании с рядом иных заболеваний. Наличие процесса расплавления крови с последующим дроблением эритроцитов предполагает следующие патогенетические механизмы: В патологии человека микроангиопатическая гемолитическая анемия описана в сочетании с сосудистыми заболеваниями, обусловленными обоими механизмами. В случае первичного сосудистого нарушения или вызванного процессом внутрисосудистого свертывания тромбы фибрина и тромбоциты частично закупоривают просвет мелких сосудов. Волоски фибрина действуют на движущиеся эритроциты подобно «гильотине » и тем самым обусловливают их дробление. Те фрагменты эритроцитов, у которых поверхностная оболочка меньше соответствующего объема, быстро захватываются макрофагами селезенки. Другие же, у которых отношение площадь/ объем превышает норму (за счет перехода гемоглобина в плазму или в результате дробления) подвергаются процессу рубцевания («повторному запечатыванию») оболочки и остаются в кровообращении, представляя собой «ключ» к постановке диагноза основного заболевания. В результате этого процесса рубцевания оболочки появляются жесткие эритроциты — сфероциты, “шлемообразные” эритроциты, которые подвергаются повторному дроблению при переходе через капилляры. Дробление эритроцитов сопровождается выделением АДФ и фосфолипидного прокоагулянта, что снова ведет к аггрегации тромбоцитов и отложению фибрина в мелких сосудах, тем самым усиливая процесс внутрисосудистого свертывания. На рисунке приводится модель патогенеза микроангиопатической гемолитической анемии. Необходимо отметить, что не у всех больных с рассеянным внутрисосудистым свертыванием наблюдается микроангиопатическая гемолитическая анемия. Для ее развития важно, чтобы фибрин удержался в кровообращении достаточный период времени. Сохранение запасов фибрина в мелких сосудах зависит от ритма дефибринизации, клиренса макрофаговой системы и местного фибринолиза.
Болезни, сопутствующие микроангиопатической гемолитической анемии (МГА)1. Тромбогемолитическая тромботическая пурпура (РТТ) 2. Уремический гемолитический синдром При микроангиопатической гемолитической анемии, встречающейся в заболеваниях метастазом рака, эритроциты разрушаются механическим путем в малых сосудах, измененных: – Также рекомендуем “Диагностика микроангиопатической гемолитической анемии – дифференциация” Оглавление темы “Гемолитические анемии”:
|
- Холодовая агглютининовая болезнь
- Медикаментозная ферментдефицитная анемия
- Гемолитико-уремический синдром
- Пароксизмальная ночная гемоглобинурия Маркиафавы-Микели
- Микроангиопатическая (механическая) гемолитическая анемия
- Токсическая гемолитическая анемия
Холодовая агглютининовая болезнь
Холодовая агглютининовая болезнь — это редкое заболевание крови, которое является одним из видов аутоиммунной гемолитической анемии. Агглютининовые антитела вырабатываются в костном мозге, а их избыток наблюдается, когда иммунная система дает сбои. Организм ошибочно воспринимает их как инородные антитела и устанавливает иммунный ответ так, что эритроциты преждевременно погибают (происходит процесс гемолиза).
Антитела, называемые холодовыми агглютининами, активируются при низких температурах и реагируют, вызывая склеивание кровяных клеток, к которым они присоединены. Температура, при которой происходит агглютинация (склеивание), зависит от особенностей пациента. Чтобы определить уровень этих антител, необходим тепловой анализ.
Когда скорость разрушения превышает способность костного мозга продуцировать достаточное количество кислорода для переноса его эритроцитами, возникает анемия. Чем интенсивнее гемолиз, тем тяжелее анемия, поскольку организм компенсирует этот процесс своими силами. Для устранения такого состояния используют препараты Ритуксан, Мабтера, Прокрит, фолиевую кислоту.
Нормальные эритроциты живут около 120 дней и уменьшаются, когда приближаются к завершению жизненного цикла.
Холодовая агглютининовая болезнь вызывается основным инфекционным заболеванием (микоплазменной пневмонией, эпидемическим паротитом, мононуклеозом, лимфопролиферативными заболеваниями, например, лимфомой, хроническим лимфоцитарным лейкозом или волчанкой). Один пациент может одновременно страдать от тепловой и холодовой агглютининовой болезни. Тепловую форму проще лечить. Воздействие холода может существенно усугубить анемию, в том числе и обычное мытье рук холодной водой. Осложнение этого заболевания является акроцианоз Рейно или синдром Рейно. Феномен Рейно появляется, когда холод сужает мелкие артерии, как правило, в пальцах рук и ног, но может также проявиться на носу, ушах, лице и руках.
Конечности становятся бледными, голубоватыми, может появиться онемение, покалывание, жжение. Когда организм нагревается до необходимой температуры, цианоз уменьшается. Это заболевание довольно безобидно и безболезненно. Людей с таким заболеванием легко узнать по опухшим, плотным, голубоватым пальцам на руках и ногах.
Холодовая агглютининовая болезнь может наступить внезапно, средний возраст появления от 50 до 70 лет. Женщины болеют чаще из-за того, что общая численность старшего населения женского пола превышает мужскую.
Симптомы холодовой агглютининовой болезни
Утомляемость, головная боль, недостаток энергии и выносливости, желтизна кожи или бледность, пожелтение белков глаз, темная моча, раздражительность, спутанность сознания, увеличение селезенки. При ишемической болезни сердца (ИБС) некоторые больные могут не иметь явных симптомов, тогда как другим даже может потребоваться переливание крови.
Медикаментозная ферментдефицитная анемия
Для качественного выполнения своих функции эритроцитам необходимо выполнить определенное количество циклов кровообращения. Этот процесс требует АТФ и окислительно-восстановительных компонентов для постоянного производства энергии и оксилительно-восстановительного метаболизма. Эритроцитам необходимо поддерживать двояковогнутую форму клеток, специфические внутриклеточные концентрации катионов, восстановительное состояние гемоглобина с двухвалентным железом и сульфгидрильными группами ферментов, глютатиона и мембранных компонентов.
Если какой-либо фермент находится в дефиците, нарушается производство АТФ, и мембраны эритроцитов меняют свою форму. Основные виды ферментных нарушений это: несфероцитарная гемолитическая анемия, дефицит глюкозо-6-фосфат дегидрогеназы, овалоцитарная или сфероцитарная анемия, дефицит пируваткиназы.
Отношения между степенью дефицита фермента и степенью метаболизма эритроцитов зависят от: важности фермента, его скорости восстановления, стабильности мутантного фермента при протеолитической деградации и функциональных нарушениях; возможности компенсировать дефицит путем сверхэкспрессии соответствующего изофермента или с использованием альтернативного пути метаболизма. Трудности в оценке количественной степени тяжелых случаев расстройства связаны с тем, что ферментные анемии способствуют появлению большого количества ретикулоцитов.
Основные причины медикаментозной анемии: токсическое угнетение активности костного мозга, например, при опасных инфекциях, таких как волчанка, злокачественных опухолях с необходимостью химиотерапии и облучения, а также при употреблении сульфаниломидных препаратов, амидопирина и цитостатических средств.
Симптомы:слабость, нарушение аппетита, желтуха, тошнота, увеличение селезенки, сонливость, боли в животе, сердечные боли, одышка.
Гемолитико-уремический синдром
Гемолитико-уремический синдром (ГУС) — это состояние аномально преждевременного разрушения эритроцитов. После того, как данный процесс начался, поврежденные эритроциты начинают засорять систему фильтрации почек, что в конечном итоге вызывает почечную недостаточность.
В большинстве случаев гемолитико-уремический синдром развивается у детей после 2-14 дней диареи, часто кровавой. Причиной тому могут быть инфекции с определенным штаммом кишечной палочки (E.coli). Взрослые так же могут страдать от гемолитико-уремического синдрома под воздействием кишечной палочки, приема лекарств, различных инфекций, а также в период беременности. Несмотря на серьезность состояния, современные методы лечения эффективно побеждают ГУС, особенно у маленьких детей.
Симптомы гемолитико-уремического синдрома: кровавый понос, рвота, боль в животе, бледность кожи, усталость, высокая температуры, кровь в моче, маленькие синяки или кровотечение из носа и рта, уменьшение количества мочи, отек лица, рук, ног и всего тела.
Лечение гемолитико-уремического синдрома
Необходимо пополнение количества жидкости и электролитов, возможно переливание эритроцитов и тромбоцитов, а также процедура плазмафереза. В тяжелых случаях необходимо подключение к аппарату диализа почек, и даже пересадка почки.
Профилактика
- мытье рук, посуды и пищевых поверхностей;
- хранение сырых продуктов отдельно от готовых;
- размораживание мяса в микроволновке или холодильнике (не стоит оставлять мясо на рабочей поверхности в кухне);
- соблюдение температурного режима приготовления пищи;
- мытье овощей и фруктов под проточной водой;
- отказ от непастеризованного молока, сока и сидра;
- отказ от купания в грязной воде и плавания в бассейнах при расстройстве желудка и поносе
Пароксизмальная ночная гемоглобинурия Маркиафавы-Микели
Пароксизмальная ночная гемоглобинурия (ПНГ) является редким и опасным для жизни заболеванием крови. Заболевание характеризуется разрушением эритроцитов (гемолитическая анемия), образованием сгустков крови (тромбоз), нарушением функции костного мозга и 5%-ным риском развития лейкемии.
НПГ болеют только 1-2 человека на миллион населения, и преимущественно это заболевание поражает людей молодого возраста (средний возраст диагностики 35-40 лет), изредка диагностируется у детей или подростков. Около 30% вновь диагностированных случаев заболевания вызваны апластической анемией. Медиана выживаемости после постановки диагноза составляет 10 лет. Однако, некоторые пациенты могут жить в течение десятилетий после диагностики ПНГ с проявлением незначительных симптомов.
Микроангиопатическая (механическая) гемолитическая анемия
Вид гемолитической анемии, при которой эритроциты разрываются при попытке пройти через сосуды, перегруженные нитями фибрина. Иногда разрыв эритроцитов происходит по другой причине, в частности, при работе искусственного клапана сердца.
Токсическая гемолитическая анемия
Вид анемии, вызванный воздействием лекарственных препаратов или химических веществ. Возможные вещества, которые вызывают этот вид анемии: противомалярийные препараты (с хинином), мышьяк, Дапсон, внутривенное ведение жидкости, металлы, нитриты, Нитрофурантоин, Рибавирин, змеиный яд, сульфаниламиды, сульфоны.
Источники статьи:
https://coldagglutinindisease.org
https://emedicine.medscape.com
https://www.mayoclinic.org
https://www.hopkinsmedicine.org
https://www.pathologystudent.com
По материалам:
Salman Abdullah Aljubran, MD; Richard F Lockey, MD
Dr. Michael A. Schwartz, Dr. Mary Sarko
© 1998-2015 Mayo Foundation for Medical Education and Research.
© The Johns Hopkins University, The Johns Hopkins Hospital, and Johns Hopkins Health System
© 2012 Pathology Student
Смотрите также:
У нас также читают:
Диагностика микроангиопатической гемолитической анемии – дифференциация
Микроангиопатическая гемолитическая анемия представляется как осложнение уже известной или легко диагностируемой болезни. Однако бывают случаи, когда этот синдром составляет исходное проявление скрытой, подлежащей уточнению болезни.
Подозрение на микроангиопатическую гемолитическую анемию возникает, когда у страдающего тяжелой острой анемией, желтухой и гемороагическими синдромом обнаруживаются на мазке крови дробленные эритроциты в превышающем норму количестве (1%). При сокращении численности эритроцитов в крови в условиях микроангиопатической гемолитической анемии наблюдается чрезвычайная костномозговая реакция.
Триада ретикулоцитоз, лейкоцитоз, тромбоцитоз преобразовывается в триаду ретикулоцитоз, лейкоцитоз и тромбоцитопения за счет расхода. Лейкоэритробластическая картина в сочетании с дробленными эритроцитами характерна осложняющей метастаз рака микроангиопатическая гемолитическая анемия (Колицэ и сотр.). При острой промиелоцитной лейкемии ежедневная проверка мазка крови составляет «сигнал» появления внутрисосудистых отложений фибрина в рамках ВДК (Колицэ и сотр.).
Исследование костного мозга составляет этап исключительной важности. Костный мозг обильный и отличается выраженной гиперплазией эритроидного и мегакариоцитного рядов. В отдельных случаях исследование костного мозга и выявление в нем гнезд метастазированных клеток способствует определению диагноза основного заболевания.

О наличии процесса внутри- или внесосудистого расплавления крови свидетельствуют рост показателя гемоглобинемии, лактикодегидрогеназы, гемоглобинурии, гемосидеринурии, косвенного билирубина, уробилиногена в моче и понижение показателя гаптоглсбина. Об этом говорит также сокращение продолжительности жизни меченных Cr51 эритроцитов.
Для диагностирования микроангиопатической гемолитической анемии необходимо выявить нарушающий микроциркуляцию патологический процесс в том числе рассеянное внутрисосудистое свертывание (РВС) или первичное сосудистое заболевание. У отдельных больных нарушение теста гемостаза подсказывает мысль о наличии РВС. Иногда расход факторов выявляется лишь посредством специальных исследований, таких как интенсивность и скорость метаболизма, меченного I131 фибриногена или меченных Cr51 тромбоцитов.
Сведения о состоянии мелких сосудов получаем рядом исследований, в том числе глазного дна, биопсии кожи, мышц, почек, костного мозга. Иногда почки составляют единственное место развития микроангиопатии. В отдельных случаях изменения мелких сосудов и диагностирование основного заболевания уточнюятся при вскрытии.
Дифференциальная диагностика микроангиопатической гемолитической анемии. Дробление эритроцитов наблюдается и при других видах анемии, в которых микроциркуляция не нарушается но существуют недостатки собственно эритроцитов, как, например, при талассемии, сиклемии, гемолитической анемии с тельцами Гейнца, фавизме. Дробленные эритроциты обнаруживаются также на мазках крови страдающих железодефицитной и макромегалобластической анемиями.
Микроангиопатическая гемолитическая анемия отличается от всех остальных видов анемии совершенно необычайным сочетанием гемолитической анемии, дробления эритроцитов, лейкоцитоза и тромбоцитопении.
Течение и прогноз микроангиопатической гемолитической анемии. Микроангиопатическая гемолитическая анемия – это осложнение первичного сосудистого заболевания или процесса локализованного или рассеянного внутрисосудистого свертывания. Когда внутрисосудистое свертывание играет ведущую роль, то своевременное назначение противосвертывающей терапии спасает больного. Если же существует первичное сосудистое поражение, то течение зависит от этиологии сосудистой болезни.
– Также рекомендуем “Лечение микроангиопатической гемолитической анемии”
Оглавление темы “Гемолитические анемии”:
- Аутоиммунные гемолитические анемии – история изучения, классификация
- Аутоиммунная гемолитическая анемия с тепловыми антителами – причины, клиника
- Аутоиммунная гемолитическая анемия с холодовыми антителами – причины, клиника
- Серологическая диагностика аутоиммунной гемолитической анемии
- Механизмы развития аутоиммунной гемолитической анемии – патогенез
- Лечение аутоиммунной гемолитической анемии – схема
- Пароксизмальная гемолитическая анемия в условиях холода – клиника, диагостика, лечение
- Гемолитическая анемия из-за сенсибилизации к лекарствам – клиника, диагостика, лечение
- Микроангиопатическая гемолитическая анемия – история изучения, причины
- Диагностика микроангиопатической гемолитической анемии – дифференциация
- Лечение микроангиопатической гемолитической анемии