Молекула гемоглобина имеет формулу
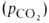
Молекула гемоглобина: 4 субъединицы окрашены в разные цвета
Структура гемоглобина человека. Железосодержащие гем-группы показаны зелёным. Красным и синим показаны альфа- и бета- субъединицы.
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1.34 мл. O2
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[2][3]
Большой вклад в исследование структуры и функционирования гемоглобина внёс Макс Фердинанд Перуц, получивший за это в 1962 году Нобелевскую премию[4].
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[5].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемодилюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[6].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких.
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[7]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение[править | править код]
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология[править | править код]
Изменение состояний окси- и дезоксигемоглобина
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4-х субъединиц влияет на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[8].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин[en], специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов, или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
Экспрессия генов гемоглобина до и после рождения.
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[9]
Гемоглобин при заболеваниях крови[править | править код]
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии.
Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также[править | править код]
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный Гемоглобин (эмбриональный)
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Эффект Вериго — Бора
Примечания[править | править код]
- ↑ Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- ↑ Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- ↑ Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- ↑ Лауреаты нобелевской премии. Макс Перуц.
- ↑ Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- ↑ Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- ↑ Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 1120. — ISBN 978-1416045748.
- ↑ Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- ↑ Айала Ф., . Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, . Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
Литература[править | править код]
- Mathews, CK; van Holde, KE & Ahern, KG (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & Chothia, C (1976), Structural patterns in globular proteins, Nature
Ссылки[править | править код]
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.
Анонимный вопрос
6 марта 2019 · 21,2 K
Гемоглобин (Hb) — сложный железосодержащий белок, содержащийся в эритроцитах (красных кровяных тельцах) крови и частично присутствующий в свободном виде в плазме. Именно он осуществляет перенос кислорода от легких к клеткам и углекислого газа — в обратном направлении. Если говорить образно, то эритроцит — это своеобразное грузовое судно, курсирующее по кровяному руслу, а молекулы гемоглобина — контейнеры, в которых транспортируется кислород и углекислый газ. В норме один эритроцит вмещает порядка 400 млн молекул гемоглобина.
- Это если технически отвечать на Ваш вопрос. Что же касается его функций, уровня в организме, способов изменения и воздействия, если интересно, развернуто можете ТУТ почитать.
Гемоглобин — Гем (железо) + глобин (белок) составляющая эритроцитов, с помощью белков происходит транспортировка питательных веществ в крови к тканям.
Основная часть всего железа находится именно в эритроцитах.
Для оценки состояния насыщенности эритроцитов железом необходимо согласовать результаты анализов и клинических данных.
Для детей норма… Читать далее
Какими способами можно увеличить гемоглобин?
Как лечить анемию?
Врач терапевт. Врач общей практики. Закончила Первый Московский Государственный… · health.yandex.ru
Анемия – это патологическое состояние, которое характеризуется снижением гемоглобина и эритроцитов в единице объема крови. Существуют различные виды анемии – железодефицитная, В-12 дефицитная, фолиеводефицитная, апластическая, гемолитическая, постгеморрагическая. Соответственно, тактика лечения зависит от вида анемии.
Наиболее часто встречающий вид анемии – это железодефицитная анемия. Основной принцип лечения данного вида анемии – это восполнение дефицита железа. Для этого обычно рекомендуется добавить в рацион продукту богатые железом (например, печень, красное мясо, гречка, яблоки). Также может назначаться медикаментозное лечение препаратами железа, например сорбифер, феррум лек, мальтофер.
Обычно лечением анемий занимается терапевт, гематолог. Точная тактика лечения назначается после очного осмотра с учетом результатов анализов.
Прочитать ещё 2 ответа
Повышен гематокрит в крови, что это значит?
Коммерческий писатель, блогер. Про кино, музыку и книги: https://vk.com/griverwa…
Гематокрит – это показатель объема красных кровянх клеток в крови человека. Повышение этого показатяля может быть симптомом:
- Сильного обезвоживания организма.
- Середечно-сосудистых заболеваний.
- Дефицита кислорода в тканях.
- Новообразования в почках или гидронефроз.
- Лейкоз.
- Порок сердца.
- Легочная недостаточность.
- Непроходимость кишечника.
- Поликистоз.
- Ишемия сердца.
- Артериальный тромбоз.
Прочитать ещё 2 ответа
Какие пить препараты железа при низком гемоглобине?
Люблю моду, путешествия, детективы, английский язык.
Распространенными и популярными являются следующие препараты повышающие гемоглобин в крови: Гемобин, Тотема, Ферретаб, Феррум лек, Ферро-фольгамма, Сорбифер Дурулес, Гемофер капли, Мальтофер.
Прочитать ещё 1 ответ
Какие симптомы при нехватке железа?
Усталость, сонливость, головокружение, одышка и раздражительность, из внешних сухая и бледная кожа, ломкие слоистые ногти. Советую поддерживать железо в норме, это один из самых главных минералов, который необходим нашему организму. На рынке представлено много вариантов добавок и прочего для поддержания железа, из личного опыта могу посоветовать эваларовский железо хелат, очень даже неплохой, побочек никаких нет. Следите за своим здоровьем и будьте здоровы!
Прочитать ещё 2 ответа
Как увеличить уровень гемоглобина,если не очень любишь мясо?
Здесь, чтобы ответить на интересные вопросы.
У меня тоже была эта проблема, из-за нехватки гемоглобина в крови очень плохо себя чувствовала, голова зачастую кружилась, в транспорте и 20 минут спокойно ездить не могла, так как начинало укачивать и сразу возникали боли в голове. Сходила к врачу, она прописала мне месячный курс Сорбифер Дурулеса (сульфат железа) для повышения уровня гемоглобина, и уже после первого месяца я начала чувствовать себя гораздо лучше, но и сейчас с перерывами в несколько месяцев принимаю Сорбифер Дурулес. Поэтому советую вам именно этот метод, помогает 🙂
Прочитать ещё 3 ответа
ГЕМОГЛОБИН (от греч. haima- кровь и лат. globus-шар), осн. белок
дыхат. цикла, участвующий в переносе О2 от органов дыхания к
тканям, а в обратном направлении – СО2. Содержится в эритроцитах
крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных.
Гемоглобин позвоночных (мол. м. 6,4*104-6,6*104) состоят
из четырех попарно идентичных субъединиц (их обозначают греч. буквами;
теми же буквами обозначают входящие в состав субъединиц полипептидные цепи,
а также гены, кодирующие эти цепи). Каждая субъединица имеет белковую глобиновую
часть, состоящую из 140-160 аминокислотных остатков, с к-рой нековалентно
связан гем-ферропрото-порфирин (см. ф-лу).
Ф-цию переноса О2 у нек-рых видов беспозвоночных выполняют
крупные гемсодержащие белки-эритрокруорины (мол. м. 0,4*106-6,7*106),
состоящие из 30-400 субъединиц, и хлоркруорины (мол. м. 3,4*106),
состоящие из 190 субъединиц. Эти белки способны обратимо связывать одну
молекулу О2 на группу гема, т.е. на субъединицу. Переносчиком
О2 у др. видов беспозвоночных служат негемовые белки, состоящие
из 8-10 субъединиц,— медьсодержащие гемоцианины (мол. м. 0,05*107*107)
и железосодержащие гемэритрины (мол. м. 1*105). Каждая субъединица
таких белков содержит два атома металла (соотв. Сu + и Fe2+), способных связать одну молекулу О2.
Гемоглобин взрослого человека (НbА) имеет мол. м. 6,49*104 и принадлежит
к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с
осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из
двух и двух
и двух субъединиц,
субъединиц,
их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков.
Известны первичная структура обеих цепей, а также пространств. структура
оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной
формы (содержит Fe3+) НbА. Пространств. структура
субъединиц (рис. 1) характеризуется наличием восьми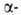 спиральных
спиральных
участков, включающих около 80% аминокислотных остатков, и внутр. полости
-гемового кармана. Фиксирование гема в субъединице осуществляется в результате
гидрофобных взаимод. пиррольных и винильных групп гема с алифатич. и ароматич.
боковыми радикалами аминокислот, выстилающими полость кармана, а также
благодаря координационной связи (направлена перпендикулярно к плоскости
кольца гема) Fe2+ с аксиальным лигандом-имидазольной группой
гистидина (т. наз. проксимальный гистидин). При оксигенации молекула О2
занимает шестое вакантное место в координационной сфере Fe2+.
Связывание происходит обратимо, без окисления железа, с образованием стабильного
оксигенированного комплекса НbО2. Одна молекула гемоглобина способна
присоединить 4 молекулы О2-по одной на группу гема.
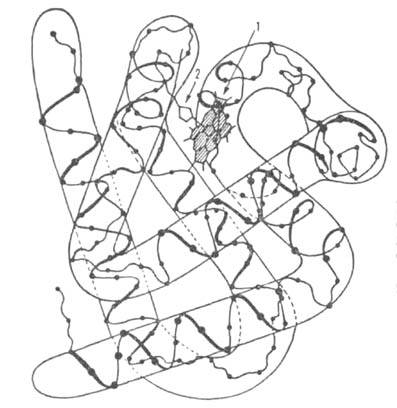
Рис. 1. Схема упаковки полипептидной цепи 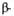 субъединицы
субъединицы
гемоглобина. Точками обозначены положения 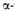 С
С
атомов аминокислотных остатков; 1 -гем; 2-проксимальный остаток гистидина.
Субъединицы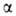
и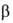 прочно
прочно
удерживаются в составе тетрамера гемоглобина множественными ван-дер-ваальсовыми
взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована
кроме того неск. ионными связями внутри и между субъединицами. Тетрамер
гемоглобина-кооперативная структура, в к-рой существует взаимод. пространственно
разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется
в облегчении присоединения к тетрамеру последующих молекул О2
по мере протекания оксигенирования, что значительно увеличивает эффективность
переноса О2 при физиол. условиях по сравнению с мономерными
гемоглобином и миоглобином (белок, депонирующий О2 в мышцах). Присоединение
О2 к молекуле гемоглобина сопровождается значит. конформационными перестройками
пространств. структуры субъединиц и тетрамера в целом.
Сродство гемоглобина к О2 является основным физ.-хим. показателем
функциональных св-в гемоглобина; его принято характеризовать зависимостью степени
оксигенирования гемоглобина от парциального давления кислорода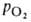
(кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной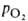 ,
,
при к-рой достигается оксигенирование 50% гемоглобина (р50)- Нормальная
величина р50 НbА в крови при физиол. условиях [37 °С, парциальное
давление СО2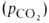
40 мм рт. ст., рН 7,4] составляет 26-28 мм рт. ст. Сигмоидный характер
КДК отражает кооперативный характер оксигенирования. При существующем у
человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±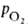
2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92-98% гемоглобина находится
в форме НbО2), отдает в тканях ок. 45 мл О2, при
этом содержание НbО2 в венозной крови составляет 70-75%.
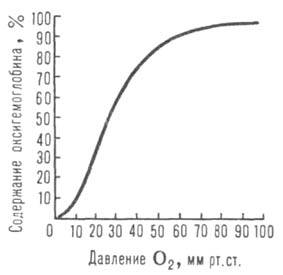
Рис. 2. Зависимость содержания оксигемоглобина от парциального давления
кислорода.
Из клеток тканей СО2 диффундирует через плазму крови в эритроциты,
где гидратируется в р-ции, катализируемой ферментом карбоангидразой:
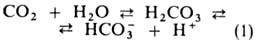
Гидрокарбонат-ионы в эритроцитах замещаются далее на ионы Cl-
из плазмы, сами переходят в плазму и переносятся ею к легким. Определенная
часть СО2 связывается в эритроцитах с N-концевыми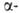 аминогруппами
аминогруппами
гемоглобина с образованием остатка карбаминовой к-ты, уменьшая сродство гемоглобина к О2.
Увеличение РСО2 т-ры, ионной силы р-ра и уменьшение рН снижают
сродство гемоглобина к О2. Важнейший внутриэритроцитарный регулятор сродства
– анионы 2,3-дифосфоглицериновой к-ты. Увеличение их концентрации также
уменьшает сродство гемоглобина к О2. Снижение сродства при уменьшении
рН в интервале 9-6 наз. щелочным эффектом Бора, к-рый обусловлен существованием
равновесия:
Этот эффект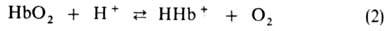
вносит значит. вклад в поддержание постоянного значения рН крови и освобождение
О2 в тканях соотв. уровню обмена в-в [увеличение концентрации
СО2 сдвигает равновесие р-ций (1) и (2) вправо]. В легких, где
рСО2 составляет 40 мм рт. ст., процессы, описываемые р-циями
(1) и (2), идут в обратном направлении, в результате чего СО2,
находящийся в растворенном и связанном с гемоглобином состоянии, освобождается, гемоглобин
оксигенируется и дыхат. цикл завершается.
У человека на разных этапах развития организма обнаружено несколько
гемоглобинов, различающихся составляющими их субъединицами. На ранних стадиях эмбрионального
развития у зародыша обнаруживаются гемоглобины строения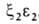 ,
,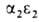 ,
,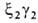
. На более поздних стадиях появляется и доминирует к моменту рождения HbF
(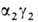 ; т. наз.
; т. наз.
фетальный гемоглобин). Св-ва эмбриональных гемоглобинов обеспечивают выполнение кисло-родтранспортной
ф-ции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого
человека содержится в норме 95-97% НЬА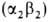
, начинающего преобладать через 2-3 месяца после рождения, и 2-3% НbА2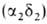
Первичные структуры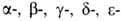
и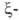 полипептидных
полипептидных
цепей гемоглобина человека, а также мн. др. глобиновых цепей разл. происхождения
известны. Гены, кодирующие глобиновые
глобиновые
цепи гемоглобина человека, сцеплены и расположены в последовательности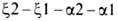
на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих
др. полипептидные цепи, также непосредственно примыкающие один к другому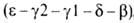 ,
,
локализована на хромосоме 11. Первичная структура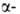 и
и
не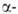 глобиновых
глобиновых
генов человека известна. Для каждого из них установлено наличие двух нитронов
(отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих
участков, находящихся на флангах генов. Биосинтез гема,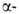
и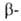 глобиновых
глобиновых
цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках
эритроцитарного ряда и практически завершается к моменту выхода зрелых
эритроцитов (их продолжительность жизни у человека составляет 120-130 дней)
из костного мозга в кровяное русло.
Точковые мутации в экзонах глобиновых генов могут вести к появлению
мутантных гемоглобинов с единичной аминокислотной заменой. Это м. б. причиной молекулярных
болезней — наследств. гемоглобинопатий. наиб. известный пример мутантного
гемоглобина- HbS, в к-ром шестой от N-конца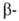 глобиновой
глобиновой
цепи остаток глутаминовой к-ты заменен на остаток валина. Такой гемоглобин содержится
в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция
(выпадение участка ДНК) или другой дефект глобинового гена, локализованный
вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах,
нарушить сбалансированный биосинтез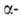 и
и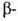 цепей
цепей
и привести к др. распространенной разновидности гемоглобинопатий-талассемии.
===
Исп. литература для статьи «ГЕМОГЛОБИН»: Уайт А., Хендлер Ф., Смит Э., Основы биохимии, пер. с англ.,
т. 3, М, 1981, с. 1218-66; Bunn Н. F., Forget В. G., Ranney Н. М, Нетоglobinopathies,
Phil.- L.- Toronto, 1977; Human hemoglobins and hemoglobinopathies, “Texas
Reports on Biology and Medicine”, 1980-1981, v. 40; Atlas of molecular
structures in bioldgy, ed. by D.C. Philips, P.M. Richards, v. 2, Haemoglobin
and myoglobin, ed. by G. Fermi and M.F. Perutz, Oxf., 1981; Methods in
enzymology, v. 76-Hemoglobins, N. Y.- L.- [a. o.], 1981. B.A. Спивак.
Страница «ГЕМОГЛОБИН» подготовлена по материалам химической энциклопедии.
Еще по теме:
- ГЕМОГЛОБИН – химическая энциклопедия
- Гемоглобин – биохимический справочник
- Гемоглобин – Наглядная биохимия
