Молекулярная масса гена гемоглобина
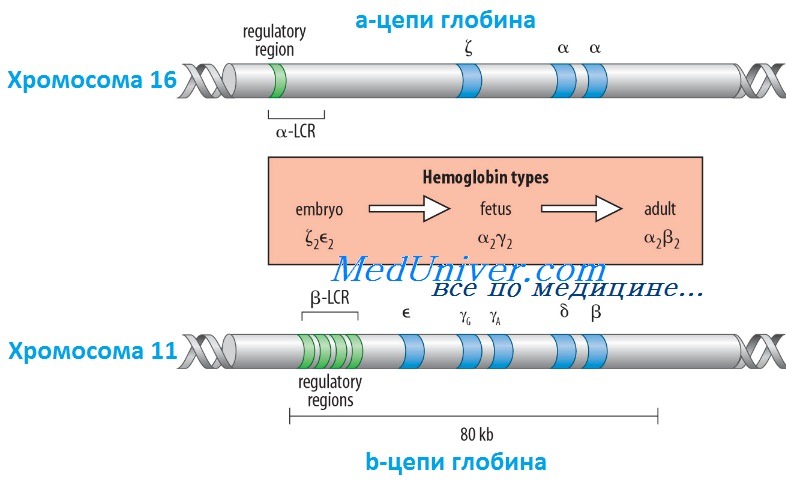
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Цифры напротив символа Hb, или гемоглобина, в бланке с результатами общего анализа крови могут раскрыть врачу причины низкого давления, головокружения, судорог ног пациента, а также оповестить о надвигающихся серьезных угрозах. Своевременное выявление отклонений и приведение концентрации гемоглобина в норму позволит избежать серьезных проблем со здоровьем. Речь идет о снижении рисков инфарктов и инсультов у людей в возрасте, патологий развития детей, ухудшения состояния матери и плода во время беременности.
Что такое гемоглобин и каковы его функции
Гемоглобин (Hb) — сложный железосодержащий белок, содержащийся в эритроцитах (красных кровяных тельцах) крови и частично присутствующий в свободном виде в плазме. Именно он осуществляет перенос кислорода от легких к клеткам и углекислого газа — в обратном направлении. Если говорить образно, то эритроцит — это своеобразное грузовое судно, курсирующее по кровяному руслу, а молекулы гемоглобина — контейнеры, в которых транспортируется кислород и углекислый газ. В норме один эритроцит вмещает порядка 400 млн молекул гемоглобина.
Участие в газообмене — важнейшая, но не единственная функция «кровяных шаров» (от греч. haima — «кровь» + лат. globus — «шар»). Благодаря своим уникальным химическим свойствам гемоглобин является ключевым элементом буферной системы крови, поддерживающим кислотно-щелочной баланс в организме. Hb связывает и выводит на клеточном уровне кислые соединения (препятствует ацидозу — закислению тканей и крови). А в легких, куда он поступает в форме карбгемоглобина (HbCO2), за счет синтеза углекислоты предотвращает противоположный процесс — защелачивание крови, или алкалоз[1].
Производная Hb — метгемоглобин (HbOH) — обладает еще одним полезным свойством: прочно связывать синильную кислоту и другие токсичные вещества. Таким образом, железосодержащий белок принимает удар на себя и снижает степень отравления организма[2].
Итак, гемоглобин крайне важный элемент жизнедеятельности и патологическое уменьшение его концентрации (анемия или малокровие) может спровоцировать в лучшем случае ломкость ногтей и волос, сухость и шелушение кожи, мышечные судороги, тошноту и рвоту, головокружение. Острая же форма анемии вызывает кислородное голодание клеток, приводящее к обморокам, галлюцинациям и фатальным последствиям — гипоксии мозга, атрофии нервных клеток, параличу дыхательной системы.
Как должно быть в норме
Уровень гемоглобина в нашей крови может несколько увеличиваться и уменьшаться по естественным причинам. Обновление гемоглобина связано с жизненным циклом эритроцита, к которому он прикреплен. Так, примерно каждые 120 дней часть молекул гемоглобина вместе с эритроцитами отправляется в печень — на расщепление и после вновь синтезируется, присоединяясь к свободному эритроциту[3].
Количество гемоглобина зависит от возраста и пола, меняется в процессе вынашивания и рождения ребенка[4].
На гемоглобин также оказывают влияние специфические условия труда или проживания (например, повышенные показатели бывают у пилотов и жителей гористой местности), приверженность вегетарианству и донорство (эти факторы, напротив, снижают гемоглобин)[5].
Согласно рекомендациям ВОЗ[6], нормой гемоглобина считается:
- для детей от полугода до 5 лет — 110 г/л и выше;
- для детей 5–11 лет — 115 г/л и больше;
- для детей 12–14 лет, а также девушек и женщин (15 лет и старше) — 120 г/л и выше;
- для мужчин (15 лет и старше) — 130–160 г/л.
Беременным женщинам, обеспечивающим минералами (в том числе железом) себя и малыша, важно следить, чтобы уровень гемоглобина не падал ниже 110 г/л. Отметим, что, по данным ВОЗ, железодефицитная анемия (ЖДА) диагностируется у 38,2% беременных на планете[7]. Дефицит молекул гемоглобина может возникнуть после 20-й недели «интересного положения»: из-за увеличения объема циркулирующей крови, растущих потребностей плода, уменьшения поступления и всасывания железа вследствие токсикоза и расстройств ЖКТ. В это время женщину может мучить слабость, головокружение, одышка даже при непродолжительной ходьбе, судороги нижних конечностей. Опасное следствие острых форм ЖДА — преждевременные роды, задержки в развитии плода.
Кстати, необычные вкусовые запросы беременных (вплоть до анекдотичных, таких как салат из жареной клубники и селедки) порой тоже связаны с потребностью в железе для синтеза гемоглобина. Роды, сопровождающиеся потерей крови, ведут к дополнительному понижению гемоглобина. В целом от зачатия до появления ребенка на свет организм женщины утрачивает порядка 700 мг железа, еще 200 мг — за период лактации[8]. На восстановление запасов требуется не менее трех лет.
Виды анализов на гемоглобин
Подсчет числа молекул гемоглобина производится при общем анализе крови. Помимо количества белка (строка Hb), в бланке анализа могут указать MCH/MCHC, что соответствует среднему содержанию/концентрации гемоглобина в эритроците. Это уточнение позволяет подсчитать полезный железопротеин и исключить из расчета аномальные, нестабильные формы гемоглобина, не способные переносить кислород.
Для измерения гемоглобина во внелабораторных условиях — в машинах скорой помощи или при проведении профилактических выездных осмотров — применяются специальные гемоглобинометры. Это портативные приборы, в которые помещается кровь с реагентом для фотометрического автоматического определения количества гемоглобина.
Для массового тестирования на анемию в странах третьего мира ВОЗ разработала малозатратный колорометрический метод исследования. При колориметрии каплю крови наносят на специальную хроматографическую бумагу и сопоставляют ее со шкалой цветов, соответствующих разным показателям гемоглобина с шагом 20 г/л[9].
Уровень гликированного гемоглобина определяется и при биохимическом анализе венозной крови. Цель исследования в данном случае — определение глюкозы в крови, которая образует прочное соединение с гемоглобином и лишает его возможности транспортировать кислород. Показатель важен для диагностики сахарного диабета и оценки эффективности его лечения.
Чем опасен повышенный гемоглобин в крови
Высокий гемоглобин может быть вызван объективной нехваткой кислорода, стимулирующей организм на увеличенное производство этого белка крови. Подобная патология часто фиксируется у экипажей воздушных судов и часто летающих пассажиров, жителей высокогорья, альпинистов, горнолыжников. В силу большей потребности в кислороде повышенный уровень гемоглобина свойственен профессиональным спортсменам, преимущественно лыжникам, легкоатлетам, борцам, тяжелоатлетам. Это физиологический механизм компенсации, не вызывающий никаких медицинских опасений (кавказское долголетие — яркий тому пример).
Повысить гемоглобин может и пагубная привычка: во время курения человек вдыхает меньше кислорода, чем требуется, и организм реагирует на это выработкой дополнительного гемоглобина.
К сожалению, повышенный гемоглобин может указывать и на патологии системы кроветворения: эритроцитоз, рак крови, обезвоживание организма, порок сердца и легочно-сердечную недостаточность, а также на непроходимость кишечника[10].
Увеличенное количество гликированного гемоглобина отмечается при сахарном диабете: часть молекул Hb «перетягивает» на себя глюкозу, и для нормального дыхания требуются добавочные кислородные «контейнеры»[11].
Повышенный свободный гемоглобин в плазме фиксируется и при ожоговых поражениях вследствие разрушения эритроцитов с высвобождением из них гемоглобина[12].
Опасность высокого гемоглобина (+20 г/л от нормы и более) заключается в сгущении и увеличении вязкости крови, приводящему к образованию тромбов. Тромбы, в свою очередь, могут вызвать инсульт, инфаркт, кровотечение в ЖКТ или венозный тромбоз[13].
Гемоглобин ниже нормы: что это значит и к чему приводит
Железо — один из самых распространенных и легко добываемых химических элементов на Земле. При этом, как ни парадоксально, от дефицита железа в организме страдает больше людей, чем от какого-либо другого нарушения здоровья[14]. В группе риска население из низких социальных слоев, не получающее достаточного количества железа из продуктов питания, женщины репродуктивного возраста и дети, то есть люди, у которых «приход» элемента меньше «расхода».
Причиной низкого уровня гемоглобина (минус 20 г/л от нормы и более) зачастую являются скудное или несбалансированное питание — недостаточное поступление железа и меди, витаминов A, С и группы B или употребление железосодержащей пищи совместно с цинком, магнием, хромом или кальцием, которые не позволяют Fe усваиваться[15].
Низкие показатели могут наблюдаться у вегетарианцев, т.к. негемовое железо из растительной пищи усваивается намного хуже, чем гемовое, источником которого служат продукты животного происхождения[16].
Смежная причина — наличие кишечных паразитов, которые перехватывают поступающие микроэлементы и витамины. Усвоению железа могут также мешать проблемы с желудочно-кишечным трактом.
Заметное снижение уровня гемоглобина сопровождает кровопотери, вызванные ранениями, оперативным вмешательством, менструацией, кровотечениями, возникающими во время родов и абортов, а также при донации крови и ее компонентов.
На уровень гемоглобина влияют и скрытые кровопотери при патологии ЖКТ (язвы желудка и ДКП), варикозе, миомах и кистах органов женской половой системы, кровоточивость десен.
Причины снижения гемоглобина, возникающие во время беременности и лактации, а также осложнения, к которым они могут привести, мы рассмотрели выше. Длительный железодефицит у мужчин, детей и небеременных женщин имеют сходную симптоматику: ухудшение состояния кожи, ногтей и волос, головокружение, обмороки, онемение рук и ног, беспричинная слабость.
Кислородное голодание вследствие недостатка гемоглобина может привести к ухудшению памяти, замедлению нервных реакций, в запущенной форме — к атрофии клеток мозга и других органов и систем организма.
Усиленное кровообращение (более частый прогон гемоглобина от легких к тканям и обратно) чревато проблемами с сердцем и сосудами: кардиомиопатией и развитием сердечной недостаточности.
Низкий гемоглобин негативно отражается на буферной функции: это значит, что закисление крови подрывает иммунную защиту организма, снижает сопротивляемость простудным и инфекционным заболеваниям.
Наиболее уязвимы перед анемией дети и подростки. Острый дефицит жизненно важного минерала может сказаться на их умственном и физическом развитии[17].
Гемоглобин — незаменимый участник жизнедеятельности, на который возложены важнейшие функции: перенос кислорода и углекислого газа, сохранение кислотно-щелочного баланса, противостояние ядам. Еще одна функция — сигнальная — помогает по отклонению уровня гемоглобина от нормы выявить риски развития патологий и принять контрмеры. Таким образом, контроль и оперативная коррекция уровня гемоглобина — не прихоть врачей, а действенный способ сохранить здоровье.
274-275
Òêàíè è îðãàíû. Êðîâü
Ãåìîãëîáèí
 Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
(ñì. ñ. 268)
òðàíñïîðò êèñëîðîäà îò ëåãêèõ â òêàíè è ÑÎ2 îò òêàíåé
îáðàòíî â ëåãêèå. Âûñøèå îðãàíèçìû íóæäàþòñÿ äëÿ ýòîãî â ñïåöèàëüíîé
òðàíñïîðòíîé ñèñòåìå, òàê êàê ìîëåêóëÿðíûé êèñëîðîä ïëîõî ðàñòâîðèì â âîäå:
â 1 ë ïëàçìû êðîâè ðàñòâîðèìî òîëüêî îêîëî 3,2 ìë Î2.
Ñîäåðæàùèéñÿ â ýðèòðîöèòàõ áåëîê ãåìîãëîáèí (Hb) ñïîñîáåí ñâÿçàòü
â 70 ðàç áîëüøå 220 ìë Î2/ë. Ñîäåðæàíèå Hb â êðîâè ñîñòàâëÿåò
140-180 ã/ë ó ìóæ÷èí è 120-160 ã/ë ó æåíùèí, ò. å. âäâîå âûøå ïî ñðàâíåíèþ ñ
áåëêàìè ïëàçìû (50-80 ã/ë). Ïîýòîìó Hb âíîñèò íàèáîëüøèé âêëàä â îáðàçîâàíèå
ðÍ-áóôåðíîé åìêîñòè êðîâè (ñì. ñ. 280).
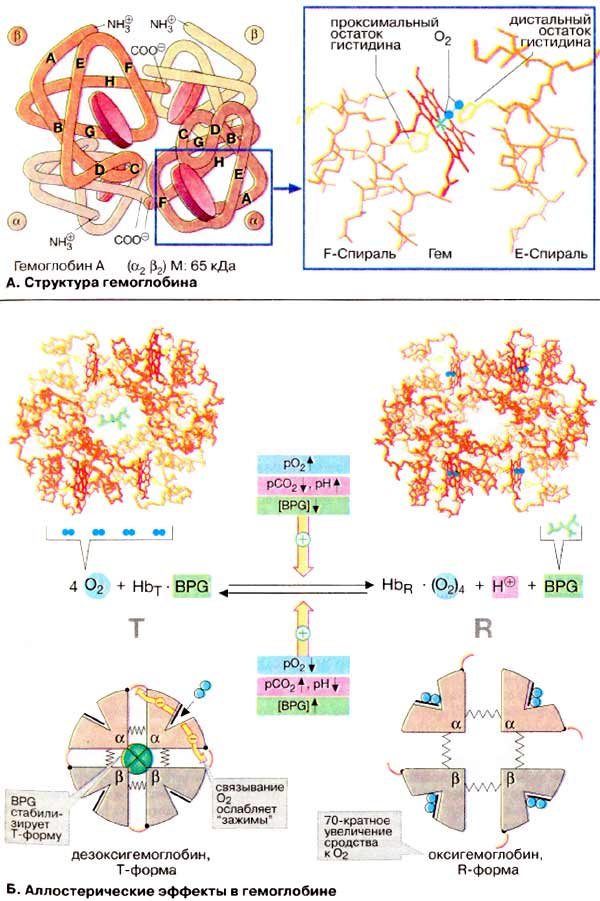
À. Ñòðóêòóðà
ãåìîãëîáèíà
Ãåìîãëîáèí âçðîñëîãî îðãàíèçìà
(HbA, ñì. íèæå) ÿâëÿåòñÿ òåòðàìåðîì, ñîñòîÿùèì èç äâóõ α- è äâóõ
β-ñóáüåäèíèö ñ ìîëåêóëÿðíûìè ìàññàìè ïðèìåðíî 16 êÄà. α- è β-öåïè îòëè÷àþòñÿ
àìèíîêèñëîòíîé ïîñëåäîâàòåëüíîñòüþ, íî èìåþò ñõîäíóþ êîíôîðìàöèþ. Ïðèìåðíî 80%
àìèíîêèñëîòíûõ îñòàòêîâ ãëîáèíà îáðàçóþò α-ñïèðàëè, îáîçíà÷åííûå áóêâàìè
À-Í (ñì. ñõåìó). Êàæäàÿ ñóáúåäèíèöà íåñåò ãðóïïó ãåìà (ôîðìóëó ñì. íà ðèñ.
197) ñ èîíîì äâóõâàëåíòíîãî æåëåçà â öåíòðå. Ïðè ñâÿçûâàíèè
O2ñ àòîìîì æåëåçà â ãåìå (îêñèãåíàöèÿ Hb) è îòùåïëåíèè
O2 (äåçîêñèãåíàöèÿ) ñòåïåíü îêèñëåíèÿ àòîìà æåëåçà íå
ìåíÿåòñÿ. Îêèñëåíèå Fe2+ äî Fe3+ â ãåìå íîñèò ñëó÷àéíûé
õàðàêòåð. Îêèñëåííàÿ ôîðìà ãåìîãëîáèíà, ìåòãåìîãëîáèí, íå ñïîñîáíà
ïåðåíîñèòü O2. Äîëÿ ìåòãåìîãëîáèíà ïîääåðæèâàåòñÿ ôåðìåíòàìè íà
íèçêîì óðîâíå è ñîñòàâëÿåò ïîýòîìó îáû÷íî òîëüêî 1-2%.
×åòûðå èç øåñòè êîîðäèíàöèîííûõ ñâÿçåé
àòîìà æåëåçà â ãåìîãëîáèíå çàíÿòû àòîìàìè àçîòà ïèððîëüíûõ êîëåö, ïÿòàÿ
îñòàòêîì ãèñòèäèíà ãëîáèíà (ïðîêñèìàëüíûé îñòàòîê ãèñòèäèíà), à øåñòàÿ
ìîëåêóëîé êèñëîðîäà â îêñèãåìîãëîáèíå è, ñîîòâåòñòâåííî, Í2Î â
äåçîêñèãåìîãëîáèíå.
Á. Àëëîñòåðè÷åñêèå ýôôåêòû â
ãåìîãëîáèíå
Àíàëîãè÷íî àñïàðòàò-êàðáàìîèëòðàíñôåðàçå
(ñì. ñ. 118) Hb ìîæåò íàõîäèòüñÿ â äâóõ ñîñòîÿíèÿõ (êîíôîðìàöèÿõ):
îáîçíà÷àåìûõ êàê Ò- è R-ôîðìû ñîîòâåòñòâåííî. Ò-Ôîðìà (íàïðÿæåííàÿ îò
àíãë. tense) îáëàäàåò ñóùåñòâåííî áîëåå íèçêèì ñðîäñòâîì ê O2
ïî ñðàâíåíèþ ñ R-ôîðìîé (íà ñõåìå ñïðàâà). Ñâÿçûâàíèå O2 ñ îäíîé èç
ñóáúåäèíèö Ò-ôîðìû ïðèâîäèò ê ëîêàëüíûì êîíôîðìàöèîííûì èçìåíåíèÿì, êîòîðûå
îñëàáëÿþò ñâÿçü ìåæäó ñóáúåäèíèöàìè. Ñ âîçðàñòàíèåì ïàðöèàëüíîãî äàâëåíèÿ
O2 óâåëè÷èâàåòñÿ äîëÿ ìîëåêóë Hb â âûñîêîàôôèííîé R-ôîðìå (îò àíãë.
relaxed). Áëàãîäàðÿ êîîïåðàòèâíûì âçàèìîäåéñòâèÿì ìåæäó ñóáúåäèíèöàìè ñ
ðîñòîì êîíöåíòðàöèè êèñëîðîäà ïîâûøàåòñÿ ñðîäñòâî Hb ê O2, â
ðåçóëüòàòå ÷åãî êðèâàÿ íàñûùåíèÿ èìååò ñèãìîèäàëüíûé âèä (ñì. ñ
276).
Íà ðàâíîâåñèå ìåæäó Ò- è R-ôîðìàìè
âëèÿþò ðàçëè÷íûå àëëîñòåðè÷åñêèå ýôôåêòîðû, ðåãóëèðóþùèå ñâÿçûâàíèå
O2 ãåìîãëîáèíîì (æåëòûå ñòðåëêè). Ê íàèáîëåå âàæíûì ýôôåêòîðàì
îòíîñÿòñÿ CO2, Í+ è 2,3-äèôîñôîãëèöåðàò [ÄÔÃ (BPG)]
(ñì. ñ. 276).
Äîïîëíèòåëüíàÿ
èíôîðìàöèÿ
Hb âçðîñëîãî îðãàíèçìà ñîñòîèò, êàê
óïîìÿíóòî âûøå, èç äâóõ α- è äâóõ β-öåïåé (α2β2). Íàðÿäó ñ
ýòîé îñíîâíîé ôîðìîé (HbA1) â êðîâè ïðèñóòñòâóþò
íåçíà÷èòåëüíûå êîëè÷åñòâà âòîðîé ôîðìû ñ áîëåå âûñîêèì ñðîäñòâîì ê
O2, ó âòîðîé β-öåïè çàìåíåíû δ-öåïÿ-ìè (HbA2,
α2δ2). Äâå äðóãèå ôîðìû Hb âñòðå÷àþòñÿ òîëüêî â
ýìáðèîíàëüíîì ïåðèîäå ðàçâèòèÿ. Â ïåðâûå òðè ìåñÿöà îáðàçóþòñÿ ýìáðèîíàëüíûå
ãåìîãëîáèíû ñîñòàâà ξ2ε2 è α2γ2.
Çàòåì âïëîòü äî ðîæäåíèÿ äîìèíèðóåò ôåòàëüíûé ãåìîãëîáèí (HbF,
α2δ2), êîòîðûé ïîñòåïåííî çàìåíÿåòñÿ íà ïåðâîì ìåñÿöå
æèçíè íà HbÀ. Ýìáðèîíàëüíûé è ôåòàëüíûé ãåìîãëîáèíû îáëàäàþò áîëåå âûñîêèì
ñðîäñòâîì ê Î2 ïî ñðàâíåíèþ ñ HbÀ, òàê êàê îíè äîëæíû ïåðåíîñèòü
êèñëîðîä èç ñèñòåìû ìàòåðèíñêîãî êðîâîîáðàùåíèÿ.