Мутация в гене гемоглобина
Талассеми́я (анемия Кули) — заболевание, наследуемое по рецессивному типу (двухаллельная система), в основе которого лежит снижение синтеза полипептидных цепей, входящих в структуру нормального гемоглобина. В норме основным вариантом (97 %) гемоглобина взрослого человека является гемоглобин А. Это тетрамер, состоящий из двух мономеров α-цепей и двух мономеров β-цепей. 3 % гемоглобина взрослых представлено гемоглобином А2, состоящим из двух альфа- и двух дельта-цепей.
Существуют два гена HBA1 и HBA2, кодирующих мономер альфа, и один HBB-ген, кодирующий мономер бета.
Наличие мутации в генах гемоглобина может привести к нарушению синтеза цепей определённого вида.
Классификация[править | править код]
В зависимости от того, синтез какого из мономеров нарушен, разделяют альфа-, бета- и дельта-талассемию.
По тяжести клинических проявлений выделяют тяжёлую, среднюю и лёгкую формы заболевания.
Альфа-талассемия[править | править код]
Связана с мутациями в генах HBA1 и HBA2. Есть всего 4 локуса, кодирующего α-цепи. Наличие мутации в одном из локусов приводит к минимальным клиническим проявлениям. Нарушения в двух локусах выражаются лёгкой формой анемии. При мутациях в трёх локусах возникает значительное уменьшение продукции α-глобина. При этом избыточные цепи β-глобина образуют тетрамеры — гемоглобин Н. Эта форма носит также название гемоглобинопатии Н. Характер заболевания может варьироваться от лёгкой до тяжёлой картины гипохромной микроцитарной анемии. Присутствие мутаций во всех четырёх аллелях альфа-глобина не совместимо с жизнью. Ребёнок с такой патологией погибает внутриутробно или вскоре после рождения. Из пуповинной крови таких детей можно выделить гемоглобин Барта.
Бета-талассемия[править | править код]
Существует два варианта бета-талассемии — большая талассемия CD8(-AA) и малая талассемия (minor), из которых большая талассемия — наиболее тяжёлая форма заболевания. Возникает при наличии мутаций в обоих аллелях гена бета-глобина. В отсутствие или при резком уменьшении производства бета-цепей гемоглобин А вытесняется гемоглобином F, в норме вырабатывающимся у плода и сменяющимся на гемоглобин А после родов.
Малая талассемия связана с наличием мутации в одном из аллелей гена бета-глобина. Как правило, протекает легко и не требует лечения.
Этиология[править | править код]
Талассемию вызывают точечные мутации или делеции в генах гемоглобина, ведущие к нарушению синтеза РНК, что приводит к уменьшению или полному прекращению синтеза одного из видов полипептидных цепей. Синтез цепей другого вида продолжается. Это приводит к образованию нестабильных полипептидных агрегатов из избыточных цепей, нарушающих нормальное функционирование эритроцитов, и их разрушению. Повышенный гемолиз эритроцитов вызывает анемию.
Эпидемиология[править | править код]
Альфа-талассемия распространена в Западной Африке и Южной Азии. Бета-талассемия часто встречается в странах Средиземноморья, Западной Азии и Северной Африки. Это регионы, где распространена малярия. Гетерозиготные носители мутаций в генах альфа- и бета цепей гемоглобина являются более устойчивыми к малярийному плазмодию. Имеются очаги талассемии в Азербайджане, в равнинных районах которого гетерозиготная бета-талассемия наблюдается у 7—10 % населения.
Клиническая картина[править | править код]
При талассемии характерны гипохромная анемия, анизоцитоз эритроцитов, наличие мишеневидных форм эритроцитов (пятно гемоглобина в центре клетки, напоминающее мишень). При этом содержание сывороточного железа нормальное или повышенное. Компенсаторная гиперплазия костного мозга ведёт к нарушениям в строении лицевого черепа. Череп может стать квадратным, башенным; нос приобретает седловидную форму; нарушается прикус и расположение зубов. Отмечается желтушность кожи и слизистых оболочек. Селезёнка и печень увеличены. Больные подвержены инфекционным заболеваниям. Рано начавшаяся анемия обуславливает физическое и умственное недоразвитие ребёнка.
Примечания[править | править код]
Ссылки[править | править код]
- Талассемия
- Фонд анемии Кули
- «Зинтегло»: генная терапия бета-талассемии
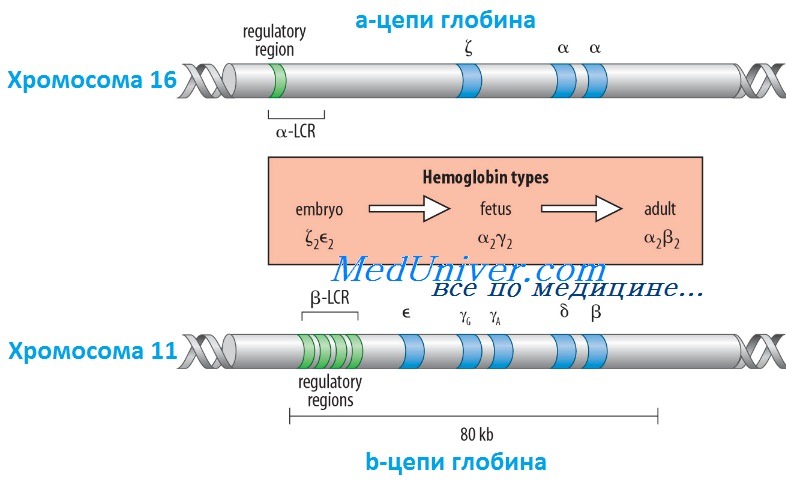
Гены гемоглобина человекаКроме НbА, у человека есть еще пять других нормальных гемоглобинов, которые имеют тетрамерные структуры, сравнимые с НbА и состоящие из двух а- или а-подобных цепей и двух не-b-цепей. Гены а- и а-подобных цепей расположены тандемно в хромосоме 16, а для b- и b-подобных — в хромосоме 11. В каждой копии хромосомы 16 есть два идентичных гена а-глобина, названные а1 и а2. В пределах комплекса генов b-глобина существует тесная гомология между разными генами. Например, b- и q-глобины отличаются только 10 из 146 аминокислот. Все гены глобина, несомненно, возникли из общего гена-предшественнника. Изменение экспрессии различных генов глобина в ходе развития иногда называют переключением глобинов. Это классический пример упорядоченного регулирования экспрессии генов в ходе развития. Гены в а- и b-группах размещаются в одной и той же транскрипционной ориентации и, что замечательно, гены внутри каждой группы расположены в той же последовательности, в которой они экспрессируются в процессе развития. Существует эквимолярное соответствие синтеза а- и b-подобных цепей глобина. Интересно, что переключение синтеза глобинов по времени сопровождается изменениями в основном месте эритропоэза. Эмбриональный синтез глобина происходит в желточном мешке с 3 по 8 нед гестации, но приблизительно около 5 нед гестации основное место кроветворения начинает перемещаться из желточного мешка в печень плода. HbF (а2у2) — преобладающий гемоглобин в внутриутробном периоде — составляет приблизительно 70% общего гемоглобина при рождении, но во взрослой жизни HbF составляет менее 1% общего гемоглобина. Хотя b-цепи могут обнаруживаться на ранних сроках гестации, их синтез становится значимым только ближе к сроку родов; к 3-месячному возрасту почти весь гемоглобин становится гемоглобином взрослого типа — HbА. Синтез 8-цепи также продолжается после рождения, но НbА2 (а2q2) никогда не составляет более примерно 2% гемоглобина взрослых. К несчастью, небольших количеств q-глобина (и, следовательно, HbA2) и у-глобина (и, следовательно, HbF), обнаруживаемых в норме в крови взрослого человека, недостаточно для компенсации сниженного количества b-глобина (и, следовательно, НbА), образующегося при болезнях типа b-талассемии. Следовательно, знание механизмов, регулирующих производство цепей глобина, потенциально имеет терапевтическое значение. Обнаружено множество факторов транскрипции, управляющих экспрессией генов глобина, что дает надежду на разработку лечения, направленного на увеличение синтеза q- и у-глобинов.
Регулирование экспрессии генов b-глобина: управляющий регион локусаКак и во многих других областях медицинской генетики, изучение механизмов, регулирующих экспрессию генов глобина, дало понимание как нормальных, так и патологических биологических процессов. Экспрессия гена b-глобина, как оказалось, только частично контролируется промотором и двумя энхансерами в фланговой ДНК, расположенной непосредственно рядом с геном. Необходимость дополнительных регулятор-ных элементов была заподозрена после идентификации уникальной группы пациентов, не имевших экспрессии ни одного гена в группе b-глобина, даже если сами гены (включая их индивидуальные регуляторные элементы) были неповрежденными. Оказалось, что такие пациенты имеют большие делеции выше комплекса b-глобина, удаляющие область приблизительно в 20 килобаз, названную локус-контролирующей областью (LCR, от англ. locus control region), которая начинается приблизительно в 6 килобазах выше гена е-глобина. Развивающаяся при этом болезнь, еу5р-талассемия, описана ниже. Данные пациенты показали, что LCR необходим для экспрессии всех генов в группе b-глобина в хромосоме 11. LCR определяется пятью сверхчувствительными к ДНКазе 1 участками, необходимыми для поддержки открытой конфигурации хроматина в данном локусе, что обеспечивает доступ факторам транскрипции к элементам, регулирующим экспрессию каждого гена в комплексе b-глобина. LCR вместе с ассоциированными связанными с ДНК белками, взаимодействует с генами локуса, формируя часть ядра, названную «транскрипционным узлом» (англ. active chromatin hub), в котором происходит экспрессия генов b-глобина. Последовательное переключение экспрессии генов, происходящее между пятью участниками комплекса гена b-глобина в ходе развития, вызвано последовательной ассоциацией транскрипционного узла с разными генами в группе, так как узел перемещается от 5′-конца комплекса (от экспрессирующегося в эмбриональном периоде гена e-глобина) через ген q до гена b-глобина у взрослых. Клиническое значение LCR разнообразно. Во-первых, пациенты с делециями LCR не экспрессируют гены группы b-глобина. Во-вторых, компоненты LCR, вероятно, окажутся существенными для генотерапии болезней группы b-глобина. В-третьих, знание молекулярных механизмов, лежащих в основе переключения глобинов, может сделать выполнимой, например, регуляцию экспрессии гена у-глобина у пациентов с b-талассемией (с мутациями в гене р-глобина), для стимуляции синтеза HbF (a2y2), — эффективного переносчика кислорода у взрослых с дефицитом НbА (а2b2). Для понимания патогенеза большинства гемоглобинопатий важны различия в дозе генов (четыре гена а-глобина и два гена b-глобина на диплоидный геном) и онтогенез а- и b-глобинов. Мутации в генах b-глобина более вероятно вызывают болезнь, чем мутации а-цепи, поскольку мутация единственного гена b-глобина влияет на 50% р-цепей, тогда как мутация одного гена а-цепи влияет только на 25% a-цепей. С другой стороны, мутации в гене b-глобина не имеют последствий во внутриутробном периоде, поскольку у-глобин является основным глобином до рождения, и к моменту родов HbF составляет три четверти общего гемоглобина. Поскольку а-цепи — единственный а-подобный компонент всех гемоглобинов, начиная с 6 нед после зачатия, мутации а-глобина вызывают тяжелую патологию как плода, так и послеродовой жизни. – Вернуться в содержание раздела “генетика” на нашем сайте Оглавление темы “Выявление генов болезни”:
|
Аномальные виды гемоглобинов
Аномальные гемоглобины возникают в результате мутации генов, кодирующих a и b цепи. Известно несколько сотен мутантных гемоглобинов человека (в большинстве случаев функционально активных).
Таблица №1 замена аминокислот в a и b пептидных цепях гемоглобина
| тип гемоглобина | нормальный остаток и его положение в цепи | замена |
| С | глу 6 в b – цепи | лиз |
| Дb | лей 28 в b – цепи | глу |
| Е | глу 26 в b – цепи | лиз |
| G | глу 43 в b – цепи | ала |
| GpH | асл 68 в a – цепи | лиз |
| J | лиз 16 в a- цепи | асл |
| М | вал 67 в b – цепи | глу |
| О | глу 116 в a – цепи | лиз |
| S | глу 6 в b – цепи | вал |
Болезни гемоглобинов называют гемоглобинозами, их насчитывают более 200.
Гемоглобинозы делятся на гемоглобинопатии и таласемии.
Гемоглобинопатии, возникают в результате точечных мутаций в структурных генах, кодирующих полипептидные цепи гемоглобина. Поэтому в крови появляется аномальный гемоглобин.
Серповидноклеточная анемия – классический пример наследственной гемоглобинопатии. В норме в b-субъединицах гемоглобина в шестом положении находится гидрофильная глутаминовая кислота. В гемоглобине S глутаминовая кислота заменена на гидрофобный валин. Такая замена приводит к появлению на поверхности b-субъединицы гидрофобного («липкого») участка, который соединяется с гидрофобным карманом другой молекулы гемоглобина S. Происходит полимеризация гемоглобина S и его осаждение в виде длинных волокон. Длинная волокнистая структура нарушает нормальную форму эритроцитов, превращая её из двояковогнутого диска в серповидную, которая имеет тенденцию блокировать капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. Если поражены обе гомологичные хромосомы, заболевание может оказаться смертельным. Заболевание широко распространено в географических зонах, где наиболее часто встречается злокачественная форма малярии. Высокий показатель заболеваемости можно объяснить положительной селекцией генома носителей аномальных генов. Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия.
Существенное ухудшение состояния больных наблюдается в условиях высокогорья при низких давлениях кислорода. Это связано с тем, что полимеризоваться способна только дезоксиформа S гемоглобина. Так как в молекуле оксиформы S-гемоглобина нет гидрофобного кармана («липкого участка»), и она не способна к полимеризации.
Талассемия – генетическое заболевание, обусловленное отсутствием или снижением синтеза одной из цепей гемоглобина. При данном заболевании отсутствуют дефекты в структурных генах, кодирующих a, b, g,d -цепи.
Причиной талассемий являются мутации генов-операторов, контролирующих транскрипцию структурных генов a, b, g,d -цепей гемоглобина.
В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров.
В зависимости от того, формирование какой глобиновой цепи нарушается, выделяют a, b, g, e – талассемии.
Талассемии делятся так же на гомозиготные и гетерозиготные.
Гомозиготная b-талассемия – формирование b-цепи полностью подавляется. Симптомы заболевания появляются приблизительно через полгода после рождения, когда происходит полное переключение синтеза g-цепи гемоглобина F на b-цепь. У ребенка прогрессирует анемия. Увеличиваются селезенка и печень. Лицо приобретает монголоидные черты (из-за чрезмерного разрастания костного мозга скулы выдаются вперед, нос приплюснут), при рентгенологическом исследовании черепа наблюдается феномен «игл ежа» («hair – standing –on –end»). В попытке восполнить эритроциты, утраченные в результате не эффективного эритропоэза и увеличении гемолиза, ткани черепа, чрезмерно разрастаясь и гипертрофируясь, порождают такое изменение медуллярной пластинки.
α-талассемия – недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НbН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Для всех этих заболеваний характерны некоторые общие закономерности:
1). нарушаются пропорции в составе гемоглобина крови. Например, при b- талассемии в крови появляется 15% гемоглобина А2, 15 – 60% гемоглобина F;
2). эритроциты приобретают не нормальную форму (мишеневидную, каплевидную). Такие эритроциты в пределах 1 дня захватываются ретикулярной соединительной тканью (например, селезенкой) и подвергаются распаду (по этой причине селезёнка оказывается гипертрофированной), что приводит к развитию гемолитической анемии.
Понятие «талассемия» объединяет ряд генетических заболеваний крови. Чтобы понять, что представляет собой талассемия, необходимо понять, как устроена кровь. Гемоглобин является компонентом, переносящим кислород в эритроциты. Он состоит из двух различных белков — альфа и бета. Если организм человека не производит достаточное количество какого-либо из этих белков, красные кровяные клетки не формируются должным образом и не могут переносить достаточное количество кислорода. В результате у человека развивается анемия, которая может начаться в раннем возрасте и продолжается в течение всей жизни.
- Альфа-талассемия, типы альфа-талассемии
- Бета-талассемия, типы бета-талассемии
- Другие формы талассемии
- Симптомы талассемии
- Гемоглобинопатия
- Наследственное персистирование фетального гемоглобина (НПФГ)
Талассемия — это группа родственных расстройств, которые имеют ряд общих и ряд отличительных признаков. Различия между типами талассемии обусловливают те симптомы, которые испытывает человек при развитии этого заболевания.
Из-за преимущественного распространения заболевания среди средиземноморского контингента, талассемию, а точнее различные её виды, называют средиземноморской анемией.
Альфа-талассемия
Люди, чей гемоглобин не производит в достаточном количестве альфа-белок, страдают от альфа-талассемии.
Существует несколько типов альфа-талассемии:
1. Бессимптомный.
Это состояние, как правило, не вызывает никаких проблем со здоровьем, поскольку уровень отсутствия альфа-белка очень мал. Функция гемоглобина при этом не нарушается. Человек, больной таким заболеванием, называется «молчаливым носителем». У таких людей могут родиться дети с признаками альфа-талассемии.
2. Мутация альфа-гемоглобина.
Наблюдается, в основном, на территории Ямайки, где впервые было обнаружено это состояние крови. Проблем со здоровьем у таких пациентов обычно нет.
3. Мягкая форма альфа-талассемии.
В этом состоянии уровень отсутствия альфа-белка несколько выше. Пациенты с такими симптомами имеют умеренную форму альфа-талассемии, ошибочно принимаемую многими врачами за железодефицитную анемию.
4. Синдром Н-гемоглобина.
В этом состоянии у пациентов наблюдаются серьезные проблемы со здоровьем, например, увеличение селезенки, вирусные инфекции. Эта форма заболевания названа в честь аномального гемоглобина Н, который разрушает красные кровяные клетки.
5. Хронический Н-гемоглобин.
Более опасный для здоровья человека синдром, приводящий к появлению серьезной анемии, проблемам с внутренними органами.
6. Гомозиготный Н-гемоглобин.
Этот симптом наблюдается у детей, чьи родители являются носителями хронической формы Н-гемоглобина.
Еще одна форма альфа-талассемии называется водянкой плода. При этом состоянии у новорожденного отсутствуют в ДНК альфа-гены, которые трансформируют гамма-глобины, произведенные организмом, в гемоглобин Барта.
Большинство детей с таким состоянием умирают до или сразу после рождения. В некоторых, крайне редких случаях, внутриутробное переливание крови позволяют ребенку с водянкой родиться живым, однако таким детям требуется пожизненное переливание крови и медицинская помощь.
Бета-талассемия
Люди, чей гемоглобин не производит достаточное количество бета-белка, болеют бета-талассемией. Заболевание чаще встречается у людей средиземноморского происхождения, например, итальянцев, греков, а также обитателей Аравийского полуострова, Ирана, Африки, Юго-Восточной Азии и южной части Китая.
Существует три типа бета-талассемии, которые варьируются от легкой до тяжелой степени, в зависимости от их воздействия на организм.
Типы бета-талассемии
1. Малая бета-талассемия.
Отсутствие бета-белка недостаточно велико, чтобы вызвать проблемы с нормальной функцией гемоглобина. Человек с этим состоянием просто является генетическим носителем признаков талассемии, и с точки зрения врачей практически здоров. Возможна умеренная степень железодефицитной анемии.
Как и при мягкой форме альфа-талассемии, врачи часто ошибочно принимают небольшие эритроциты с бета-талассемией за проявление железодефицитной анемии и назначают препараты железа.
2. Промежуточная талассемия.
Достаточно большой уровень отсутствия бета-белка в гемоглобине, что вызывает анемию умеренной степени, деформацию костей, увеличение селезенки.
3. Бета-талассемия третьей степени (анемия Кули).
Самая тяжелая форма бета-талассемии, при которой в гемоглобине полностью отсутствует бета-белок. Такая форма заболевания является условием для регулярных переливаний крови. Такие обширные переливания крови приводят к перенасыщению железом. Это является условием для хелатотерапии, целью которой является предотвращение ранней смерти от полиорганной недостаточности.
Другие формы талассемии
1. Дельта-бета-талассемия — еще одна форма бета-талассемии, характеризующаяся полным отсутствием или понижением уровня синтеза дельта и бета-цепей глобина с компенсаторным увеличением экспрессии синтеза гамма-цепей. Распространенность этой формы заболевания неизвестна, однако чаще всего она встречается в Греции и Италии.
Гетерозиготная форма заболевания протекает клинически бессимптомно, с мягким микроцитозом и повышением уровня гемоглобина HbA2. При гетерозиготной наследственной бета-талассемии у больных производится только гамма-глобин с образованием HbF.
2. E-бета-талассемия.
Гемоглобин Е является одним из наиболее распространенных аномальных гемоглобинов. Заболевание проявляется у жителей Юго-Восточной Азии, например, камбоджийцев, вьетнамцев и тайцев. В сочетании с бета-талассемией, гемоглобин Е вызывает умеренно-тяжелую анемию, которая схожа с симптомами промежуточной бета-талассемии.
3. Серповидная-бета-талассемия.
Обусловлена сочетанием бета-талассемии и гемоглобина S, аномального гемоглобина, свойственного людям, больным серповидно-клеточной анемией. Это заболевание характерно для греков, турков, итальянцев. Чем больше бета-глобина производит бета-ген, тем тяжелее заболевание и его симптомы.
Симптомы талассемии
Талассемия в слабой степени обычно не вызывает никаких симптомов. Если всё же симптомы и есть, они напоминают мягкую форму анемии.
Наиболее выражены симптомы анемии Кули. Они проявляются на второй год жизни ребенка. Кроме проявлений железодефицитной анемии, возможны такие симптомы:
- частые вирусные инфекции;
- бледность;
- плохой аппетит;
- желтуха;
- увеличение внутренних органов.
Гемоглобинопатия
Гемоглобин производится генами, которые контролируют экспрессию этого белка. Дефекты в этих генах могут производить аномальные типы гемоглобина и приводят к анемии, которую называют гемоглобинопатия. Аномальные типы белка-гемоглобина появляются в таких случаях:
1. Структурные дефекты в молекуле гемоглобина.
Случается так, что мутации изменяют одну из аминокислот. Чаще всего такое изменение безобидно и не нарушает ни структуру, ни функцию молекул гемоглобина. Однако случается и так, что изменение одной аминокислоты резко нарушает поведение молекулы гемоглобина и приводит к болезням.
2. Уменьшение производства одной из двух субъединиц молекул гемоглобина.
Равные количества гемоглобина альфа- и бета-цепей являются необходимыми для нормальной функции крови. Дисбаланс в цепи гемоглобина повреждает и разрушает эритроциты, тем самым приводя к анемии.
3. Аномальные соединения нормальных субъединиц.
Одна субъединица альфа-цепи и одна субъединица бета-цепи объединяются, чтобы произвести нормальный гемоглобин. В тяжелых случаях субъединицы глобина начинают объединяться в группы по четверо. Они неактивны функционально и не транспортируют кислород. При этом альфа-субъединицы быстро деградируют при отсутствии партнера типа бета.
Наследственное персистирование фетального гемоглобина (НПФГ)
Персистенция (персистирование) фетального гемоглобина (HPFH, НПФГ) является состоянием, при котором производство фетального гемоглобина (гемоглобина F), продолжается и в зрелом возрасте.
Фетальный гемоглобин — это основной вид гемоглобина, который вырабатывается у плода во время нахождения в утробе матери. Наличие такого элемента в организме позволяет при достаточно малом количестве крови в организме плода выполнять кислородоснабжающую функцию.
Когда ребенок рождается, гемоглобин-Ф заменяется гемоглобином-А, его более «взрослой» формой. Если же замена происходит не полностью, это свидетельствует от талассемии.
Причины
НПФГ вызвана мутациями в генах β-глобина. Процент таких мутаций обычно равен 10-15%. В основном это состояние бессимптомно и обнаруживается во время скрининга, причиной которого является другое расстройство крови.
Источники статьи:
https://www.nhlbi.nih.gov
https://www.thalassemia.org
https://www.healthline.com
https://www.orpha.net
https://en.wikipedia.org
По материалам:
1.Pr Renzo GALANELLO, Dr Raffaella ORIGA
2.Gretchen Holm, George Krucik, MD
3.The Cooley’s Anemia Foundation
4.National Institutes of Health, Department of Health and Human Services
5.wikipedia.org
Смотрите также:
У нас также читают:
