Нарушение диссоциации гемоглобина что это
Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
а) Факторы, сдвигающие кривую диссоциации оксигемоглобина. Их значение для транспорта кислорода. Кривые диссоциации оксигемоглобина (для облегчения понимания просим вас изучить рисунки ниже) справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.

Влияние PO2 крови на количество связанного гемоглобина на 100 мл крови
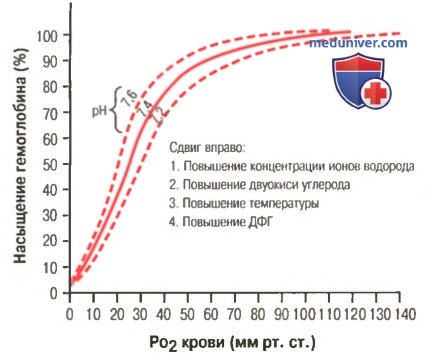
Сдвиг кривой диссоциации оксигемоглобина вправо в результате повышения концентрации ионов водорода (снижения pH). ДФГ — 2,3-дифосфоглицерат
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
б) Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается PO2, а затем концентрации угольной кислоты (H2CO3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз (для облегчения понимания просим вас изучить рисунок выше), уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются PCO2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного PO2, что увеличивает транспорт кислорода к тканям.
в) Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при PO2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
г) Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне PO2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
– Также рекомендуем “Участие кислорода в метаболизме. Метаболическое потребление кислорода”
Оглавление темы “Кислород и его доставка в организме”:
1. Диффузия газов через дыхательную мембрану. Дыхательная мембрана
2. Емкость дыхательной мембраны. Диффузионная емкость для кислорода
3. Вентиляционно-перфузионный коэффициент. Парциальное давление кислорода и двуокиси углерода
4. Концепция физиологического шунта. Концепция физиологического мертвого пространства
5. Обмен кислорода в организме. Транспорт кислорода из легких в ткани
6. Транспорт кислорода артериальной кровью. Диффузия кислорода
7. Гемоглобин. Роль гемоглобина в транспорте кислорода
8. Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях
9. Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
10. Участие кислорода в метаболизме. Метаболическое потребление кислорода
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Значение положения кривой диссоциации оксигемоглобина (КДО). Механизм формирования КДО
Положение кривой диссоциации оксигемоглобина определяется не одной какой-либо причиной, а всем комплексом взаимовлияющих друг на друга факторов. Примерная схема этого комплекса представляется следующим образом.
Суммируя приведенные выше факты и наши комментарии относительно роли кривой диссоциации оксигемоглобина в обеспечении транспорта кислорода, можно констатировать следующее.
При нормально функционирующих основных системах жизнеобеспечения человека притекающая к легким венозная кровь, с повышенным содержанием углекислоты и сниженным содержанием кислорода, а также более высокой температурой, сдвигает КДО в правое положение.
В результате газообмена на уровне альвеол в течение 750 мс, из крови удаляется углекислота, гипокапния приводит к ощелачиванию среды и уменьшению содержания в ней 2,3-ДФГ. Из-за разности температур крови и альвеолярного газа температура крови снижается, что усиливает влияние 2,3-ДФГ. Все это обусловливает смещение КДО влево, сродство гемоглобина к кислороду повышается и ускоряется окси-генация крови.
По окончанию «газообменного цикла» гемоглобин насыщается кислородом, выравнивается напряжение углекислоты, увеличивается концентрация 2,3-ДФГ, и кривая диссоциации гемоглобина занимает некое среднее положение.
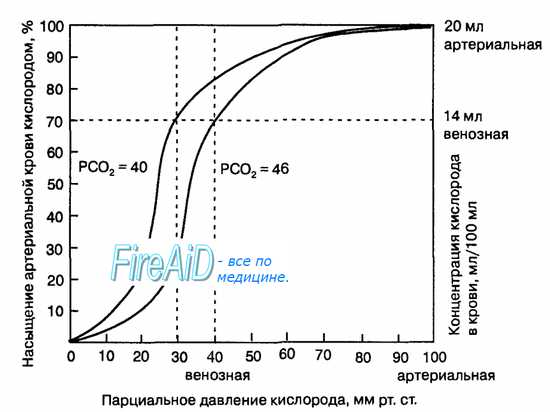
В крови, притекающей к тканям, происходит обратный процесс. Накопившаяся в тканях углекислота, окисляя реакцию крови, способствует увеличению содержания 2,3-ДФГ, а повышенная температура крови усиливает влияние фосфоглицерата. КДО смещается вправо, снижается аффинитет гемоглобина к кислороду, что облегчает диссоциацию оксигемоглобина и транспорт кислорода к клеткам тканей.
Таким образом, только на протяжении одного сердечного цикла кривая диссоциации оксигемоглобина трижды меняет свое положение. Однако при отсутствии выраженных изменений в основных функциональных системах организма, сдвиги в положении КДО столь незначительны, что могут быть зафиксированы только при специальных весьма тонких исследованиях.
Иная картина наблюдается при критических состояниях. При серьезных нарушениях газообмена и гемодинамики изменения нормального положения КДО становятся отчетливыми при обычном исследовании стандартными методами. А это уже позволяет использовать ее для углубленной диагностики патогенеза расстройств кислородтранспортной функции крови.
В заключение следует подчеркнуть, что описанные механизмы транспорта кислорода, выработанные в процессе эволюции человека, сориентированы на коррекцию резких сдвигов в кислородном балансе и предупреждение критических расстройств метаболизма.
– Также рекомендуем “Гемодинамические параметры. Кислородный поток и потребление кислорода”
Оглавление темы “Параметры потребления кислорода и гемодинамики”:
1. Кривая диссоциации оксигемоглобина (КДО). Физиологический смысл КДО
2. Кислородтранспортная функция крови. Нормальная кривая диссоциации оксигемоглобина (КДО)
3. Факторы влияющие на КДО. Влияние температуры на кривую диссоциации оксигемоглобина (КДО)
4. Значение положения кривой диссоциации оксигемоглобина (КДО). Механизм формирования КДО
5. Гемодинамические параметры. Кислородный поток и потребление кислорода
6. Факторы влияющие на потребление кислорода. Предупреждение критической тканевой гипоксии
7. Законы Старлинга. Сердечный выброс по Старлингу
8. Регуляция сердечного выброса по кислороду. Влияние венозного притока на сократимость миокарда
9. Современный взгляд на сердечный выброс. Взаимоотношение факторов влияющих на сократимость миокарда
10. Неконтролируемая внутривенная инфузия. Кривая венозного притока
© Автор: З. Нелли Владимировна, врач лабораторной диагностики НИИ трансфузиологии и медицинских биотехнологий, специально для СосудИнфо.ру (об авторах)
Красный пигмент крови человека, сложный железосодержащий белок (хромопротеин, состоящий из глобина и четырех гемов с двухвалентным железом в центре каждого) – гемоглобин (Hb), соединяясь с молекулярным кислородом (O2) в легких, образует оксигенированную форму – оксигемоглобин (HHbO2). Оксигемоглобин, приобретая уникальные свойства и обеспечивая дыхание, как одно из элементарных проявлений жизни, продолжает саму жизнь организма. Например, достаточно ввести окись углерода вместо кислорода или нарушить потребление О2 клетками при попадании цианидов (солей синильной кислоты), которые ингибируют ферментные системы тканевого дыхания, как тут же наступает гибель организма.
Дыхание, на первый взгляд, кажется совсем простым процессом. Между тем, оно основано на взаимодействии многих компонентов, составляющих гигантскую молекулу красного пигмента крови – хромопротеина гемоглобина, который, в свою очередь, отличается многообразием производных, где из их числа несомненный интерес вызывает оксигемоглобин. Итак, оксигемоглобин образуется в легких путем соединения сложного железосодержащего белка гемоглобина с кислородом, поступающим с вдыхаемым воздухом.
Образование и распад оксигемоглобина
В спокойном состоянии тканям человеческого тела достаточно около 0,2 л кислорода в одну минуту, но все меняется при физической нагрузке и чем она интенсивнее, тем больше необходимого для дыхания газа запрашивают ткани. Для удовлетворения их нужд потребность в кислороде может увеличиваться в 10 – 15 раз и составлять до 2, а то и 3 литров О2 в одну минуту. Однако газообразный кислород в данном количестве никак не сможет пробраться в ткани, поскольку он почти не растворим и в воде, и в плазме, то есть, этот элемент в ткани должен доставить какой-то белок, способный соединиться с ним и решить задачу транспорта.
Кровь, как биологическая среда, реализует свои функциональные обязанности по обеспечению дыхания за счет присутствия в ней сложного содержащего железо протеина – гемоглобина, физиологическая роль которого, как транспортного средства кислорода, базируется на способности Hb связывать и отдавать О2 в корреляции с концентрацией (парциальным давлением – P) данного газа в крови. Образование оксигемоглобина осуществляется в паренхиме легких, куда кислород прибывает при дыхании из воздуха окружающей среды.
Процесс образования HHbO2 происходит в доли секунды (0,01 с), поскольку кровь в легких задерживается всего-то на полсекунды. Схематично и коротко образование оксигемоглобина можно представить в следующем виде:
- Попадая в капиллярные сосуды легких, кровь обогащается кислородом, то есть, красный кровяной пигмент к своим 4 гемам присоединяет кислород – идет реакция окисления (оксигенации);
- Кислород связывается с гемами хромопротеина при помощи координационных связей феррума (железо – Fe) и, не изменяя в данном случае валентности последнего (в геме валентность железа всегда – II), переводит его (Hb) в несколько иное состояние;
- Гем железосодержащего протеина представляет собой активный центр, с его помощью хромопротеин в результате вышеуказанной реакции переходит в непрочный комплекс – оксигенированный гемоглобин (HHbO2), который, находясь в красных кровяных тельцах – эритроцитах, с током крови доставляется к клеткам тканей, чтобы через распад оксигемоглобина и выделения в процессе диссоциации кислорода, обеспечить их дыхание.
Таким образом, результатом реакции оксигенации становится образование оксигемоглобина, подкисление биологической жидкости, снижение ее щелочного резерва, то есть, ее умения связывать углекислоту (СО2), которое, разумеется, на тот момент снижается.
Железосодержащий протеин, насытившись в легочной паренхиме кислородом и приобретя оксигенированную форму, уносит О2 к тканям, в капиллярных сосудах которых его концентрация в крови резко понижена. Там происходит распад оксигемоглобина (диссоциация), кислород уходит на тканевое дыхание, гемоглобин забирает отработанный углекислый газ, превращаясь в другую физиологическую модель – карбогемоглобин (HHbCO2), и в этом качестве отправляется в главный орган дыхания, чтобы обменять CO2 на очередную порцию необходимого организму газа.
Кривая образования и распада (диссоциации) оксигемоглобина
Агентом, гарантирующим быстрое насыщение железосодержащего белка кислородом (образование оксигемоглобина), выступает высокое напряжение (парциальное давление) О2 в легочных альвеолах (порядка 100 мм рт. ст.).
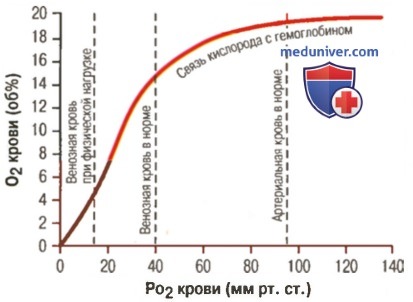
Корреляцию между степенью насыщения красного кровяного пигмента кислородом и парциальным давлением O2 (PO2) выражают в виде S-образной кривой (сигмоиды), которую называют кривой диссоциации оксигемоглобина.
Свойственная красному кровяному пигменту S-образная (сигмоида) кривая диссоциации оксигемоглобина свидетельствует о том, что контактирование первой молекулы О2 с одним из гемов Hb открывает путь присоединению других молекул элемента остальными тремя гемами. Кривой насыщения железосодержащего белка кислородом принадлежит немалая физиологическая значимость – S-образная конфигурация позволяет крови обогатиться данным газом при изменениях концентрации кислорода в биологической жидкости в довольно обширных интервалах. К примеру, не следует ожидать таких особенных расстройств дыхательной функции крови, как выраженное кислородное голодание (гипоксия), при подъеме на высоту до 3,5 км над уровнем моря или во время перелета на самолете. Хотя PO2 во вдыхаемом воздухе сильно понизится, концентрация кислорода в крови будет находиться на достаточно высоком уровне, чтобы обеспечить насыщение Hb данным газом. На это указывает и отлогий график формирования и распада оксигемоглобина на верхнем его отрезке (верхний отрезок кривой свидетельствует о течении процесса насыщения О2 красного пигмента крови в легочной паренхиме и находится в пределах 75 – 98%).
Кривая диссоциации оксигемоглобина может быть разделена на 4 отрезка, каждому их которых соответствует определенный период образования оксигемоглобина (зависимость скорости насыщения хромопротеина кислородом от парциального давления газа в крови):
- 0 – 10 мм рт. ст. – гемоглобин не спешит насыщаться;
- 10 – 40 мм рт. ст. – оксигенация резко ускоряется (стремительный подъем кривой), доходя до 75%;
- 40 – 60 мм рт. ст. – оксигенация заметно замедляется, потихоньку добираясь до 90%;
- Значения PO2 пересекают отметку 60 мм рт. ст. – насыщение идет слабо (линия лениво ползет вверх). Однако кривая медленно продолжает стремиться к отметке 100%, но, так и не достигнув ее, останавливается на уровне 96 – 98%. Кстати, и такие показатели насыщения Hb кислородом отмечаются только у молодых и здоровых людей (PO2 артериальной крови ≈ 95 мм рт. ст., легочных капилляров – ≈ 100 мм рт. ст.). С возрастом дыхательные способности крови снижаются.
Несовпадение парциального давления кислорода артериальной крови и смеси газов в альвеолах легких трактуется:
- Некоторыми разногласиями между интенсивностью тока крови и вентилированием разных отделов главного органа дыхания – легких;
- Притоком незначительного объема крови из бронхиальных вен в венозные сосуды легких (шунтирование), где, как известно, течет артериальная кровь;
- Прибытием доли крови из коронарных вен в левый желудочек сердца посредством тебезиевых вен (вены Тебезия-Вьессена), в которых проходимость возможна в обоих направлениях.
Между тем, причины, вследствие которых кривая образования и диссоциации оксигемоглобина приобрела сигмоидную форму, пока остаются не до конца выясненными.
Смещение кривой диссоциации оксигемоглобина
Но кривая диссоциации оксигемоглобина, о которой идет речь выше, справедлива, если в организме все нормально. В других ситуациях график может сдвигаться в ту или иную сторону.
В числовом выражении сродство гемоглобина к кислороду обозначается величиной P50 – напряжение полунасыщения красного пигмента крови кислородом или иными словами: парциальное напряжение О2, при котором 50% Hb пребывает в форме оксигемоглобина (оптимальные условия: рН – 7,4, tº – 37ºC). Нормальные значения этого показателя в артериальной крови приближаются к величине 34,67 гПа (26 мм рт. ст.). Смещение графика вправо указывает на то, что способность красного кровяного пигмента соединяться с кислородом снижается, что, естественно, увеличивает значения P50. И, наоборот – смещение кривой влево говорит об увеличении сродства этого хромопротеина к кислороду (↓P50.).
Ходу сигмоиды помогают некоторые факторы, повышающие обогащение крови кислородом и таким образом участвующие в тканевом дыхании, поэтому названные вспомогательными:
- Повышение водородного показателя (pH) крови (эффект Бора), поскольку способность гемоглобина присоединять кислород связана с водородным показателем (pH) данной биологической среды (гемоглобин представляет одну из четырех буферных систем и влияет на регуляцию кислотно-основного баланса, поддерживая pH на нужном уровне: 7,36 – 7,4). Следовательно, чем выше водородный показатель, тем активнее ведет себя гемоглобин в отношении кислорода и наоборот – снижение pH отнимает возможности хромопротеина присоединять кислород, например: ↓pH до 7,2 заставит график отклоняться вправо (≈ на 15%), ↑pH до 7,6 передвинет кривую диссоциации оксигемоглобина влево (≈ на 15%);
- Отделение углекислого газа от карбогемоглобина в легких и выход СО2 с выдыхаемым воздухом (эффект Бора-Вериго) на фоне повышения водородного показателя создает условия для жадного насыщения гемоглобина кислородом (образование оксигемоглобина в легких);
- Возрастание уровня значимого для обмена фосфата – 2,3-дифосфоглицерата (2,3-ДФГ), содержание которого в крови меняется в зависимости от условий протекания обменных процессов;
- Снижение температуры в легких (в тканях она выше, нежели в легких) и чем ниже упадет tº, тем больше способностей присоединять кислород появляется у железосодержащего белка (при повышении температуры идет обратный эффект).
Уровень красного пигмента в крови, а также его способность присоединять кислород (кривая диссоциации оксигемоглобина) в некоторой степени подвержены возрастным колебаниям. Так, у младенцев, только-только известившим мир о своем появлении первым криком, количество гемоглобина заметно выше, что объясняется присутствием фетального гемоглобина, который, как известно, обладает повышенным сродством к кислороду. Красный пигмент крови стариков, напротив, постепенно снижает способности связывать кислород.
В заключение хочется заметить, что гемоглобин не только имеет сродство к кислороду и довольно легко соединяется с углекислым газом. Кроме физиологических соединений красного кровяного пигмента при определенных условиях возникают связи с другими газами, в частности – с угарным газом (CO) и оксидом азота (NO), причем соединение происходит также непринужденно
Высокое сродство Hb к угарному газу влечет образование карбоксигемоглобина (HHbCO), который препятствует соединению хромопротеина с кислородом, а в результате этого ткани остаются без O2. К чему это может привести – всем известно: при отравлении угарным газом высок риск смертельного исхода, если вовремя не помочь человеку.
При отравлении оксидом азота или парами нитробензола гемоглобин переходит в метгемоглобин (HHbOH) с изменением валентности железа (II → III). Метгемоглобин также не позволяет кислороду соединиться с гемоглобином, в итоге – наступает кислородное голодание тканей, создается угроза жизни организма.
Видео: о транспорте кислорода и углекислого газа гемоглобином
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос в форму ниже ответит один из ведущих авторов сайта.
В данный момент на вопросы отвечает: А. Олеся Валерьевна, к.м.н., преподаватель медицинского вуза
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.