Назовите протомеры в молекуле гемоглобина
Гемоглобин (НЬ)– сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
В мышцах внутриклеточный транспорт и кратковременное депонирование кислорода осуществляет другой белок – миоглобин (Mb). Он не является олигомером, так как состоит только из одной полипептидной цепи, конформация которой очень похожа на пространственную структуру β-цепи гемоглобина (рис. 1.20). Большую часть молекулы
Рис. 1.20. Структура миоглобина иβ-цепи гемоглобина
А– миоглобин; Б– β-цепь гемоглобина
Mb и протомеров Hb составляют 8 α-спиральных участков, образующих глобулу с гидрофобным углублением, в котором находится центр связывания с кислородом (активный центр).При этом полипептидные цепи миоглобина и протомеров гемоглобина идентичны всего на 20%.
Оба белка являются холопротеинами, простетическая группа – гем, который находится в активном центре и участвует во взаимодействии с кислородом (рис. 1.21). Гем(ферропротопорфирин) представляет собой органическое соединение с плоской молекулой, включающей 4 пиррольных цикла и ион железа Fe2+. Он является окрашенным соединением и придает красный цвет гемоглобину, эритроцитам (красные кровяные тельца) и крови.
Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а также к радикалу гистидина с помощью атома Fe. Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема (рис. 1.22). В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Рис. 1.21. Строение гемоглобина и гема
А– гемоглобин– сложный белок, олигомер, состоит из 2 α- и 2 β-субъединиц глобина, каждая имеет центр связывания, где располагается небелковая часть молекулы – гем. Он участвует в присоединении молекулы кислорода. Между протомерами образуется аллостерический центр для присоединения регуляторного лиганда гемоглобина 2,3-бисфосфоглицерата;
Б– гем– простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. В центре молеку-
2+
лы расположен ион железа (Fe ), который образует 6 координационных связей: 4 – с атомами азота пиррольных колец гема, 1 – с азотом радикала гистидина цепей глобина, 1 – с молекулой кислорода. В присоединении О2к гему участвует еще один радикал гистидина цепи глобина
Рис. 1.22. Взаимодействие кислорода с гемом в миоглобине и гемоглобине
Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр:
Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода
ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих.
Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями.Они характерны для всех олигомерных белков и используются для регуляции их активности.
Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24).
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях.
График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию – обратимое связывание с
Рис. 1.23. Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом
А– при взаимодействии молекулы дезоксигемоглобина НЬ с О2 происходят кооперативные конформационные изменения, которые сопровождают присоединение каждой последующей молекулы кислорода; Б– в результате изменения конформации активного центра возрастает сродство НЬ к кислороду, 4-я молекула кислорода присоединяется к оксигенированному гемоглобину [НЬ(О2)3] в 300 раз легче, чем 1-я
Рис. 1.24. Кривые насыщения миоглобина и гемоглобина кислородом
кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Изменение сродства гемоглобина к О2 обеспечивает быстрое насыщение крови кислородом в легких, а также освобождение и передачу его в ткани. Миоглобин обладает более высоким сродством к О2, поэтому связывает и передает в митохондрии клеток кислород, транспортируемый НЬ в мышцы.
Гемоглобин доставляет в сутки до 600 л (850 г) О2 в ткани и способствует удалению из них ~ 500 л (1000 г) СО2. Движущей силой этих потоков является градиент концентраций О2 между альвеолярным воздухом и межклеточной жидкостью. Парциальное давление О2 в альвеолярном воздухе составляет 100 мм рт.ст. Парциальное давление О2
в тканях намного ниже (~ 40 мм рт.ст.), что обусловлено поступлением и использованием кислорода митохондриями клеток, где он превращается в Н2О. Таким образом О2 поглощается клетками.
Обмен О2 и СО2 происходит в капиллярах: в легких О2 переходит из альвеолярного воздуха в эритроциты, а СО2 – в обратном направлении; в капиллярах тканей О2 из эритроцитов перемещается в клетки тканей, а СО2 – в обратном направлении (рис. 1.25).
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией,а соединения-регуляторы –аллостерическими лигандами.Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Молекула гемоглобина способна связываться с несколькими лигандами: О2, Н+, СО2, 2,3-бис- фосфоглицератом (БФГ). Н+, СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра.
Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц.
Рис. 1.25. Перенос кислорода и диоксида углерода гемоглобином. Эффект Бора
БФГ образуется из глюкозы в эритроцитах и является одним из регуляторов работы гемоглобина. Его молярная концентрация в крови близка к молярной концентрации НЬ. В центре молекулы гемоглобина полипептидные цепи 4 протомеров образуют полость (аллостерический центр), причем величина ее увеличивается в дезоксигемоглобине и уменьшается в оксигемоглобине. БФГ поступает в полость дезоксигемоглобина, связываясь с положительно заряженными группами на β-протомере (рис. 1.26). При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2.
Рис. 1.26. Связывание БФГ с дезоксигемоглобином
Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию НЬ и освобождению БФГ.
Содержание БФГ в крови человека соответствует содержанию гемоглобина и повышается при понижении содержания кислорода в воздухе (гипоксии) или затруднении дыхания при заболеваниях легких. Понижение его концентрации ухудшает снабжение тканей кислородом.
Это важно учитывать при переливании крови и сохранять необходимую концентрацию БФГ при консервации. Переливание донорской крови с пониженным содержанием БФГ может привести к гипоксии и гибели больных.
В регуляции работы гемоглобина основная роль принадлежит протонам Н+. • В тканиНЬ поступает преимущественно в виде НЬ(О2)4. Но при низком парциальном давлении О2 происходит отщепление части кислорода. Увеличение содержания не полностью оксигенированных форм НЬ облегчает высвобождение О2.
В мышцах образуется много СО2, который под действием карбоангидразы превращается в угольную кислоту Н2СО3, диссоциирующую на Н+ и бикарбонат-ион:
СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Повышение концентрации Н+ вызывает протонирование ионогенных групп НЬ, что приводит к снижению его сродства к О2:
Н+ + НЬ О2 → Н+ НЬ + О2
Далее с дезоксигемоглобином взаимодействует
БФГ:
В легкиепоступает кровь с высоким содержанием дезоксигемоглобина, протонированного, связанного с БФГ или СО2. В такой форме гемоглобин имеет пониженное сродство к О2.
Из капилляров диффундирует СО2, освобождающийся в результате реакции:
Н+ + НСО-3 → Н2СО3 → СО2 + Н2О
Это стимулирует депротонирование гемоглобина:
Н+ НЬ → Н+ + НЬ
Высокое парциальное давление О2 приводит к оксигенированию НЬ, при этом вытесняется БФГ:
НЬ БФГ → НЬ + БФГ
Частичное оксигенирование гемоглобина повышает его сродство к кислороду, все реакции, приведенные выше, происходят в обратном порядке.
Зависимость сродства гемоглобина к кислороду от концентрации ионов водорода (Н+) получила названиеэффекта Борапо имени датского физиолога, изучавшего функционирование гемоглобина (см. рис. 1.25).
Таким образом, количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается.
СЛОЖНЫЕ БЕЛКИ
Сложные белки кроме полипептидных цепей содержат в своем составе небелковую (простетическую) часть, представленную различными веществами. В зависимости от химической природы небелковой части выделяют следующие группы сложных белков:
¨ хромопротеины
¨ углевод – белковые комплексы
¨ липид – белковые комплексы
¨ нуклеопротеины
¨ фосфопротеины
ХРОМОПРОТЕИНЫ
Хромопротеины – это сложные белки, простетическая часть которых представлена окрашенным компонентом (от греч. Chromos – краска). К ним относятся биологически важные белки гемоглобин, миоглобин, а также некоторые ферменты: каталаза, пероксидаза, цитохромы, все они являются гемпротеинами, так как простетическая часть их содержит гем.
Гемоглобин (Нв).
Гемоглобин имеет четвертичную структуру, молекулярная масса его 66-68 тыс.Да. Как следует из названия Нв представляет собой соединение гема с белком глобином. Это олигомерный белок, состоящий из 4 субъединиц (протомеров), соединенных нековалентными связями (гидрофобные, ионные взаимодействия, водородные связи).
Субъединицы Нв «узнают» друг друга благодаря присутствию на их поверхности комплементарных по форме участков. Каждая из субъединиц или полипептидных цепей обозначается буквами, их 4 у Нв взрослого человека (Нв А), эти цепи называются альфа (a) и бета (b) . Каждая молекула Нв А содержит по две a- и по две b-цепи. Они различаются первичной структурой и длиной полипептидной цепи: a – цепи содержат по 141 аминокислотному остатку, b – цепи по 146.
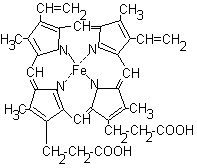
Каждый из протомеров гемоглобина представляет собой природный координационный комплекс. В нем комплексообразователем служит Fe 2+ . Его координационное число равно 6. Поэтому ион железа связан с 6 лигандами. 4 лиганда являются пиррольными кольцами протопорфирина. Пятая связь затрачивается на соединение с белком глобином через аминокислоту гистидин, а 6 координационная связь используется для связывания с кислородом или другими газообразными веществами (СО2, СО).
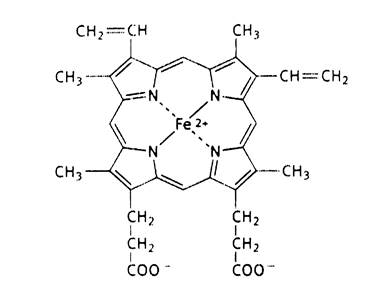
Рис.7. Строение гема.
Внутри каждого протомера имеется гидрофобный “карман”, в котором располагается гем, способный присоединять кислород.
Рис.8. Схема молекулы гемоглобина.
Основная функция гемоглобина – перенос кислорода из легких к периферическим тканям. Первая молекула кислорода изменяет конформацию протомера, к которому она присоединилась. Поскольку этот протомер соединен многими связями с другими протомерами, изменяется конформация и сродство других протомеров к лигандам. Это явление называют кооперативностью изменения конформации протомеров. Изменение конформации таковы, что сродство гемоглобина ко 2-й молекуле кислорода увеличивается. В свою очередь присоединение 2-ой, а затем и 3-ей молекулы кислорода, так же изменяет конформацию и облегчает присоединение следующих молекул кислорода. Сродство гемоглобина к 4-ой молекуле кислорода примерно в 300 раз больше чем к 1-ой.
Рис.9. Модель молекулы гемоглобина.
Кроме кислорода, молекула гемоглобина может быть связана с другими лигандами. Например, при соединении Hb с оксидом углерода (II) (угарный газ СО), образуется карбоксигемоглобин (НвСО). Причем гемоглобин имеет большее сродство к угарному газу чем к кислороду. Поэтому если в воздухе содержится угарный газ, гемоглобин легче с ним связывается и теряет способность связывать кислород. Наступает смерть от удушья, от недостаточного снабжения тканей кислородом.
Возможно образование еще одного производного гемоглобина – карбгемоглобина, когда гемоглобин связывается с СО2 . Однако СО2 связывается не с гемом, а присоединяется к NH2 – группам глобина. Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Билет
92
К группе гемопротеидов
относятся гемоглобин и его производные,
миоглобин и ферменты – цитохромная
система, каталаза и пероксидаза.
Все хромопротеиды
содержат различные по составу и структуре
белки. Небелковый компонент обладает
структурным сходством.
Строение
гемоглобина.
В молекуле гемоглобина
белковый компонент представлен белком
глобином, небелковый компонент – гем.
Глобин состоит из 4
субъединиц 2![]()
и 2![]() .
.
Каждая
![]() -цепь
-цепь
содержит по 141 аминокислотному остатку,
а
![]()
– по 146.
Внутри каждой
субъединицы имеется гидрофобный
«карман», в котором располагается гем.
Гем представляет
собой плоскую молекулу, содержащую 4
пиррольных цикла и соединенный с ними
атом железа:

Гем соединяется с
белковой частью (глобином) гидрофобными
связями между пиррольными циклами и
гидрофобными радикалами аминокислот.
Между атомом железа и имидазольным
кольцом одного из остатков гистидина
в глобине имеется координационная
связь. За счет еще одной координационной
связи к атому железа может присоединяться
молекула кислорода с образованием
оксигемоглобина.
Пиррольные кольца
гема расположены в одной плоскости, а
атом железа выступает из этой плоскости.
Присоединение кислорода «выпрямляет»
молекулу гема: железо перемещается в
плоскость пиррольных колец и это вызывает
изменение конформации белка. В молекуле
гемоглобина имеется 4 протомера, каждый
из которых содержит гем и может
присоединять кислород. Присоединение
первой молекулы кислорода изменяет
конформацию протомера. Изменение
конформации одного протомера изменяет
конформацию остальных протомеров.
Изменение конформации протомеров
облегчает присоединение остальных
молекул кислорода. Это явление называется
кооперативным действием. Сродство
гемоглобина к четвертой молекуле О2
примерно в 300 раз больше, чем к первой.
Функция
гемоглобина.
Состоит в связывании
и переносе кислорода от легких к тканям.
Гемоглобин, связанный кислородом,
называется оксигемоглобином.
Производные гемоглобина.
Молекула гемоглобина
имеет большое сродство к оксиду углерода
(II) СО. Это карбоксигемоглобин.
Сродство СО к гемоглобину примерно в
300 раз выше, чем к кислороду. Это
свидетельствует о высокой токсичности
угарного газа, поэтому при отравлении
СО необходимо, пострадавшего вынести
на воздух, чтобы увеличить поступление
кислорода.
Гемоглобин связывает
также СО2 с образованием
карбгемоглобина.
Типы гемоглобинов.
Различают физиологические
и аномальные гемоглобины.
Физиологические
гемоглобины образуются на разных этапах
нормального развития организма, а
аномальные – вседствие нарушений
последовательности аминокислот в
глобине.
Физиологические типы
гемоглобина.
Примитивный – HbP
(относятся гемоглобины, называемые
Говер 1 и Говер 2)Фетальный гемоглобин
HbF (гемоглобин плода).Гемоглобин взрослых:
HbА1, HbА2,
HbА3.
HbР
появляется на ранних стадиях развития
эмбриона. Примитивные гемоглобины
заменяются на HbF. На поздних
стадиях развития плода появляются
гемоглобины взрослых – HbА1,
HbА2.
В крови взрослого
человека примерно 95-96% HbА1,
2-3% HbА3, 0,1-0,2% HbF.
Гемоглобин А1
содержит по 2![]()
и
![]()
цепи. Гемоглобин А2 – по 2
![]()
и
![]() -цепи.
-цепи.
Гемоглобин F – по 2
![]()
и
![]() -цепи.
-цепи.
Гемоглобин Говер 1 содержит 4
![]()
цепи, Говер 2 – 2![]()
и 2
![]() цепи
цепи
по мере созревания плода
![]() -цепи
-цепи
заменяются
![]() -цепями.
-цепями.
Аномальные типы
гемоглобина
В крови человека
открыто около 150 типов мутантных
гемоглобинов. Аномальные гемоглобины
различаются по форме, химическому
составу, величине заряда. Выделены
аномальные гемоглобины при помощи
методов электрофореза и хроматографии.
Передающиеся по наследству изменения
– результат мутации единственного
триплета, который приводит к замене
одной аминокислоты на другую (с резко
отличающимися свойствами – пример
серповидноклеточная анемия – глу
заменен на вал).
Патология обмена
гемоглобина.
Болезни гемоглобинов
(их около 200) называют гемоглобинозами.
Гемоглобинозы делят
на:
Гемоглобинопатии
– в основе лежат наследственные
изменения структуры какой-либо цепи
нормального гемоглобина («молекулярные
болезни»).Талассемии –
нарушение синтеза какой-либо цепи
гемоглобина.Железодефицитные
анемии.
Классическим примером
наследственной гемоглобинпатии является
серповидноклеточная анемия. Глу в 6-м
положении в
![]() -цепи
-цепи
заменен на вал. Эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Такой гемоглобин
после отдачи кислорода превращается в
плохо растворимую форму и начинает
выпадать в осадок в виде веретенообразных
кристаллоидов, которые деформируют
клетку и вызывают массивный гемолиз.
Талассемии – генетически
обусловленной нарушение синтеза одной
из нормальных цепей гемоглобина.
Угнетение синтеза
![]() -цепей
-цепей
вызывает развитие
![]() -талассемии,
-талассемии,
угнетение синтеза
![]() -цепей
-цепей
–
![]() -талассемия.
-талассемия.
При
![]() -талассемии
-талассемии
появляется до 15% HbA2,
повышается до 15-60% содержание фетального
гемоглобина. Болезнь характеризуется
гиперплазией и разрушением костного
мозга, поражением печени, деформацией
черепа и тяжелой гемолитической анемией.
Эритроциты имеют мишеневидную форму.
Механизм изменения формы эритроцитов
не выяснен. Название связано с тем, что
возникает у людей, живущих на побережье
Средиземного моря.
Порфирии.
Порфирии – группа
заболеваний с наследственной
предрасположенностью, возникающих в
результате блокирования начальных
стадий синтеза гема и сопровождающихся
увеличением содержащихся порфиринов
в организме.
Г лицин Сукцинил-КоА
лицин Сукцинил-КоА
![]() -аминолевуленовая
-аминолевуленовая
кислота
![]()
порфобилиноген

![]()
уропорфириноген
![]()
копропорфириноген

![]()
протопорфирин
IX

![]()
феррохелатаза
Гем
Блок – 1 – острая
перемеживающая порфирия. Накапливается
![]() -АМК
-АМК
и порфобилиноген
Блок – 2 – приводит к
накоплению всех предшествующих продуктов.
Молекулярный механизм неизвестен.
Болк – 3 – эритропоэтическая
протопорфирия связана с отсутствием
фермента феррохелатазы, каторая
присоединяет к молекуле протопорфирина
IX Fe2+.
Распад гема
За сутки в организме
распадается около 9 г гемопротеидов.
Период жизни эритроцитов 120 дней,
разрушаются они в кровеносном русле
или в селезенке. Гемоглобин связывается
с гаптоглобином и в виде комплекса
гаптоглобин-гемоглобин поступает в
клетки ретикулоэндотелиальной системы
селезенки. Комплекс гаптоглобин-гемоглобин
распадается и гаптоглобин переходит в
кровь, а гемоглобин окисляется в
метгемоглобин (Fe3+).
В РЭС селезенки
гемоглобин под действием гемоксигеназы
превращается в вердоглобин. Вердоглобин
теряет Fe, которое связывается
трансферином и доставляется кровью в
костный мозг. Вердоглобин отдает белок
глобин и превращается в биливердин. При
восстановлении биливердина НАДФ Н2
образуется билирубин.
Билирубин – плохо
растворимое соединение и в крови
связывается с альбумином. В виде комплекса
альбумин-билирубин идет транспорт
билирубина кровью в клетки печени. В
печени билирубин соединяется с
глюкуроновой кислотой с образованием
моно (20%) и диклюкуронидов (80%), они хорошо
растворимы в воде. Этот вид билирубина
называется конъюгированным билирубином
(связан с глюкуроновой кислотой), а также
называется связанным прямым, т.к. может
быть прямо обнаружен с помощью реактива
Эрлиха.
Билирубинглюкурониды
в незначительных количествах диффундируют
в кровеносный капилляр. В плазме крови
присутствуют 2 формы билирубина:
неконъюгированный (непрямой, свободный)
и конъюгированный (прямой, связанный)
– 25% от общего билирубина. Билирубинглюкурониды
с желчью поступают в кишечник, где от
них отщепляется глюкуроновая кислота
и вновь образуется неконъюгированный
билирубин. В тонком кишечнике небольшая
часть билирубина может всосаться и
через портальную вену вновь поступать
в печень. Остальной билирубин подвергается
действию кишечных бактерий и в тонком
кишечнике билирубин превращается в
уробилиноген. Уробилиноген всасывается
в тонком кишечнике и через воротную
вену поступает в печень, где уробилиноген
разрушается до моно- дипирролов.
Не разрушенный
уробилиноген вновь с желчью поступает
в кишечник и восстанавливается до
стеркобилиногена (бесцветен).
Стеркобилиноген окисляется до стеркобилина
и выделяется с фекалиями. Небольшое
количество стеркобилиногена поступает
в почки, затем окисляется до стеркобилина
и выделяется с мочой.
В норме содержание
общего билирубина в сыворотке крови
составляется 8-20 мкмоль/л.
4
