Нормы анализа крови у крыс
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ажикова А.К.
1
Журавлева Г.Ф.
2
1 ГБОУ ВПО «Астраханский Государственный медицинский университет»
2 ФГОУ ВПО «Астраханский государственный университет»
Впервые изучено влияние лекарственных форм различной консистенции на количественные изменения периферической крови крыс в условиях искусственной ожоговой травмы. Любой патологический процесс может отразиться на количественных и качественных особенностях состава циркулирующей крови. Этим и определяется огромное значение необходимости изучения крови в условиях гипертермии и выявления закономерностей изменений различных показателей. Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения. Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов. Полученные данные расширяют и углубляют представления о характере интоксикации организма в условиях стрессового воздействия различных факторов.
показатели периферической крови
кроветворные органы
ожоговые поражения кожи
термическое воздействие
гипертермия
1. Ажикова А. К. Использование пуповинной крови для восстановления кожи после термической травмы / А. К. Ажикова, М. В. Лазько // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2008. – №.4. – С. 53-57.
2. Грушко М. П. Состояние периферической крови у карповых рыб в нерестовый период / М. П. Грушко, Н. Н. Федорова // Актуальные проблемы современной науки. – Технические науки: Труды 2-го Международного форума. – Самара, 2006. – С.23-25.
3. Земков Г. В. Характер и степень патологических изменений в крови и внутренних органах судака / Г. В. Земков, Г. Ф. Журавлева // Материалы VIII конф. по экологической физиологии и биохимии рыб. – Петрозаводск, 1992. – С. 40.
4. Лазько А. Е. Состояние мембран эритроцитов при воздействии серосодержащего газа / А. Е. Лазько, Р. И. Асфандияров, А. А. Резаев // Актуальные вопросы медицинской фармакологии. – 1993. – С.41-47.
5. Мамонтова Е. В. Влияние ALPHA-токоферола на степень перекисного гемолиза белых мышей в норме и при иммобилизационном стрессе / Е. В. Мамонтова // Современные проблемы науки и образования. – 2006. – № 3. – С. 27-28.
6. Островский В. К. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях / В. К. Островский, А. В. Мащенко, Д. В. Янголенко, С. В. Макаров // Клин. лаб. диагностика. – 2006. – № 6. – С. 50-53.
7. Покровский А. А. Методика определения перекисного гемолиза эритроцитов / А. А. Покровский, А. А. Абразцов // Вопросы питания. – М.: Наука, 1964. – № 6. – С.44.
8. Рожкова И. С. Влияние хронической интоксикации на свободнорадикальные процессы плазмы крови крыс / И. С. Рожкова, Д. Л. Теплый, Б. В. Фельдман // Научный руководитель. – 2015. – № 3(10). – С. 1-7.
9. Теплый Д. Л. Особенности морфологической картины сыворотки крови мышей разных возрастных групп при экспериментальном стрессе / Д. Л. Теплый, Н. А. Аюпова // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2005. – №.10. – С. 47-50.
10. Ясенявская А. Л. Влияние антиоксидантов на уровень перекисного гемолиза эритроцитов старых крыс в норме и при иммобилизационном стрессе / А. Л. Ясенявская, Н. В. Кобзева // Современные наукоемкие технологии. – 2006. – № 2. – С. 69-70.
В медицинской биотехнологии постановка экспериментов при помощи моделирования патологических состояний, например ожогового повреждения кожи, имеет огромное значение для глубокого исследования крови и кроветворных органов [3]. Исходя из этого, необходимо тщательное и всестороннее изучение всех изменений, которые происходят в организме при этих воздействиях. Главным образом это относится к системам поддержания гомеостаза [2].
Ожоговые поражения кожи стали в современном мире одним из наиболее социально значимых и распространенных типов травматических повреждений у человека. Изучению вопроса реакции клеток крови на ожоги посвящен ряд исследований [1, 8].
Любое заболевание, патологический процесс, а также ряд физиологических сдвигов могут в той или иной степени отразиться на количественных и качественных особенностях состава циркулирующей крови [5]. Этим и определяется огромное значение необходимости изучения крови. Белые клетки крови, имея высокую реактивность, быстро включаются в адаптационные реакции. Они способны к неспецифическому реагированию в ответ на альтерирующие воздействия.
Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения [1].
Свой вклад в общее состояние системы организма вносят компоненты крови. Наиболее уязвимым объектом для действия продуктов свободнорадикального окисления липидов является стенка кровеносных сосудов, что обусловлено высоким уровнем кислорода в крови и низким уровнем его утилизации [9]. В условиях патологического процесса происходит поражение неклеточного компонента сосудистой стенки.
Цель исследования – изучение показателей периферической крови половозрелых крыс в норме и в условиях термического воздействия.
Материалы и методы. Объектом исследования явились 50 беспородных крыс-самцов 4-месячного возраста. Во время эксперимента регистрировали общее состояние и поведение животных. Самцы крыс были разделены на пять групп по типу воздействия:
I группа – животные, не подвергшиеся ожоговому воздействию (контрольная, 10 шт.);
II группа – животные, получившие ожоговое воздействие и не подвергшиеся терапии (10 шт.). Раны регенерировали естественным путем;
III группа – животные, получившие ожоговое воздействие и подвергшиеся терапии спреем «Д-Пантенол» (10 шт.);
IV группа – животные, получившие ожоговое воздействие и подвергшиеся терапии бальзамом мазевой формы «Спасатель» (10 шт.);
V группа – животные, получившие ожоговое воздействие и подвергшиеся терапии аппликациями настойки календулы (10 шт.).
Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов.
Уровень гемоглобина в образцах крови крыс определяли электрофотометрическим способом на гемоглобинометре APEL Hemoglobinmeter HG-202. Мазки фиксировали и окрашивали по Романовскому – Гимзе. Идентификация форменных элементов крови проводилась согласно методике Н. Т. Ивановой [4]. Количество эритроцитов крови подсчитывали по стандартной методике в камере Горяева. Количество лейкоцитов считали по мазкам крови крыс.
Для оценки уровня свободнорадикального окисления и выраженности в связи с этим липолитических процессов в крови проводили измерение перекисной резистентности эритроцитов. Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про– и антиоксидантный баланс организма [6].
Для определения перекисного гемолиза эритроцитов использовали модификацию методов определения степени перекисного гемолиза эритроцитов (ПГЭ) А. А. Покровского и А. А. Абразцова [7], которую предложили А. Е. Лазько, Р. И. Асфандияров и А. А. Резаев [4].
Результаты исследования и их обсуждение. Анализ гематологических исследований экспериментальных животных показал, что наиболее высокий уровень гемоглобина периферической крови наблюдался у крыс, лечившихся бальзамом «Спасатель» и спреем «Д-пантенол», что наглядно отображено в таблице 1. В группе крыс, лечившихся настойкой календулы, данный показатель незначительно отличался от значений у обожженных животных, не получавших лечения.
Таблица 1
Гематологические показатели через 3 суток после ожоговой травмы
Тип воздействия | Эритроциты (шт./мкл.) | Гемоглобин (г/л) |
1 -Контроль | 7,8х106 | 27,7 |
2-Ожог | 6,5 х106* | 25,6* |
3-Ожог+аппликации мазью «Д-пантенол» | 8,2х106 * | 29,2 * |
4-Ожог+аппликации бальзамом «Спасатель» | 8,3х106* | 28,3* |
5-Ожог+аппликации настойкой календулы | 6,8х106* | 25,7* |
Примечание: * – Р<0,05 по сравнению с контролем.
Изменение уровня гемоглобина в результате опыта отмечено в таблице 1. Высокий уровень гемоглобина наблюдался у крыс, лечившихся Д-пантенолом. Средний показатель уровня гемоглобина отмечен у крыс, леченных бальзамом «Спасатель». В экспериментальной группе с настойкой календулы он незначительно и статистически недостоверно отличался от значений у животных 3 группы.
Выявлено, что термический ожог кожи вызвал уменьшение количества эритроцитов периферической крови крыс. Установлено, что при лечении ожогов этот показатель несколько увеличивался, например, при терапии бальзамом «Спасатель» и спреем «Д-пантенол».
Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про- и антиоксидантный баланс организма [10].
По данным табл. 2 показано, что не леченный термический ожог межлопаточной области спины крыс способствует наиболее полному перекисному гемолизу эритроцитов крови крыс (степень гемолиза, в среднем, 7 %, p<0,001). Лечение ожогов кожи бальзамом «Спасатель» вызывает средний гемолиз (степень гемолиза в среднем 3,94 %, р<0,05), при терапии ожоговых травм межлопаточной области спины крыс спреем Д-пантенолом наблюдался частичный гемолиз (степень гемолиза в среднем и 3,62 %, Р<0,05).
Таблица 2
Перекисная резистентность эритроцитов самцов крыс (% гемолизированных эритроцитов)
Группа | Количество животных | М+m |
1 -Контроль | 10 | 3,82+0,121* |
2 -Ожог | 10 | 6,83+0,469 *** ### |
3 -Ожог+аппликации мазью «Д-пантенол» | 10 | 3,62+0,174*** ### |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,94+0,081* |
5-Ожог+аппликации настойкой календулы | 10 | 4,94+0,081* |
Примечание: в сравнении с контрольными животными: *р<0,05; **p<0,01; ***p<0,001; в сравнении с группой 2-Ожог: #р<0,05; ##p<0,01; ###p<0,001.
Анализ данных по определению перекисного гемолиза эритроцитов самцов белых крыс показал, что устойчивость эритроцитов к перекисной провокации значительно повышалась в условиях лечения ожогов кожи крыс аппликациями бальзамом «Спасатель». Воздействие аппликациями мазью «Д-пантенол» привели к повышению устойчивости эритроцитов к перекисной провокации и приблизили показатели перекисного гемолиза эритроцитов к контролю. Термический ожог без лечения резко снизил устойчивость эритроцитов к перекисной провокации. Аппликации настойкой календулы незначительно повысил устойчивость эритроцитов к гемолизу (см. табл. 2).
Установлено, что термические ожоги существенно влияют и на общее число лейкоцитов, что проявлялось выраженной лейкопенией во все сроки наблюдения. В табл. 3 представлена некоторая волнообразность лейкопении. Так, на 3-и сутки количество лейкоцитов составляло 1,8±1,4 × 109, на 7-е – 2,5±1,4 × 109, на 14-е – 0,85±1,4 × 109, на 30-е – 2,4±1,4 × 109. Учитывая, что в контрольной серии уровень лейкоцитов составлял 10,2±1,4 × 109, что соответствует и литературным данным [9], отмечено значительное снижение числа защитных клеток крови.
Таблица 3
Содержание лейкоцитов в периферической крови крыс
Экспериментальные группы | Количество животных, n | Количество лейкоцитов × 109 на 3 сутки эксперимента | Количество лейкоцитов × 109 на 7 сутки эксперимента | Количество лейкоцитов × 109 на 10 сутки эксперимента |
1-Контроль | 10 | 3,4 ± 0,1 | 3,2 ± 0,1 | 3,0 ± 0,1 |
2-Ожог | 10 | 3,8 ± 0,2 * | 3,3 ± 0,3 * | 2,9 ± 0,2 * |
3-Ожог+аппликации мазью «Д-пантенол» | 10 | 3,2 ± 0,3 * | 3,1 ± 0,3 * | 2,9 ± 0,3 * |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,1 ± 0,3* | 3,1 ± 0,3* | 3,2 ± 0,4* |
5-Ожог+аппликации настойкой календулы | 10 | 2,8 ± 0,2 * | 3,1 ± 0,3 * | 2,9 ± 0,2 * |
Примечание: * – p<0,05 – достоверность различий между группами животных по сравнению с контролем.
Наблюдалось изменение общего количества лейкоцитов после термического воздействия между экспериментальными группами и контролем (см. табл. 3). В ходе экспериментов было выявлено, что у животных, получавших терапию Д-пантенолом, происходило незначительное уменьшение общего количества лейкоцитов в сравнении с контролем. У животных, получавших лечение настойкой календулы, количество лейкоцитов достоверно уменьшилось в сравнении с контрольной группой на 22 % (р<0,05).
Изучение лейкоцитарной формулы дало не менее интересные результаты. В табл. 4 отражены результаты исследования влияния ожоговой травмы на показатели лейкоцитарной формулы периферической крови подопытных крыс. В контрольной серии в формуле преобладали лимфоциты до 55–60 %, нейтрофилы составляли 40 %. При исследовании получено, что термический ожог приводил к достоверному и выраженному увеличению процентного числа лимфоцитов и нейтрофилов. Так, на 3-и сутки лимфоциты составляли 67,4 %.
Таблица 4
Изменение показателей лейкоцитарной формулы на 3-и сутки эксперимента
Экспериментальные группы | Нейтрофилы, M±m, % | Лимфоциты, M±m, % | Эозинофилы M±m, % | Моноциты M±m, % |
1-Контроль | 40,1±3,52 | 55,6±3,18 | 2,1±0,71 | 6,2±2,00 |
2-Ожог | 27,1± 2,97* | 67,4±2,61* | 3,1± 0,80* | 2,4± 0,34* |
3-Ожог+аппликации мазью «Д-пантенол» | 37,2± 2,91# | 60,2±2,94# | 2,7± 0,49# | 5,9± 0,61# |
4-Ожог+аппликации бальзамом «Спасатель» | 41,0± 2,99# | 58,6±5,22 # | 2,9± 0,31# | 6,4± 2,32# |
5-Ожог+аппликации настойкой календулы | 41,0± 2,99 # | 64,6±5,22 # | 2,7± 0,31# | 2,9± 2,32# |
Примечание: р<0,05, * – в сравнении с контролем,
# – в сравнении с группой получивших ожог без лечения.
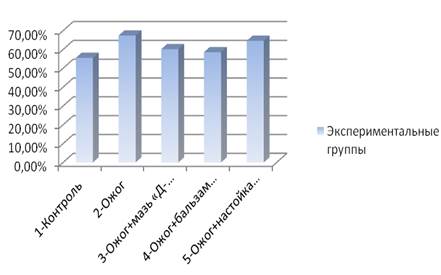
Данные эксперимента моделирования термического ожога межлопаточной области спины белых крыс свидетельствовали о достоверном колебании количества нейтрофилов у животных, получавших лечение аппликациями спрея, в сравнении с контрольной группой и группой, не получавших лечение (рис. 1).
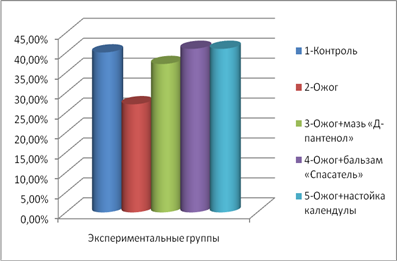
Рис. 1. Количество нейтрофилов (M±m, %) в разных опытных группах
Отмечено, что показатели количества нейтрофилов, по сравнению с контролем, чуть ниже в группе, лечившихся спреем «Д-пантенол», и незначительно выше в группе, лечившихся бальзамом «Спасатель». На рис. 2 видно, что отсутствие терапии ожога у 2 группы крыс отразилось на большем количественном содержании лимфоцитов крови.

Рис. 2. Количество лимфоцитов (M±m, %) в разных опытных группах
У группы крыс, лечившихся бальзамом «Спасатель», количество лимфоцитов увеличилось. При сравнении крыс, лечившихся спреем «Д-пантенол», с контрольной группой наблюдалось снижение количества лимфоцитов, а у крыс, лечившихся настойкой календулы, количество лимфоцитов практически не отличалось от 2 группы.
При ожоге наблюдалось изменение показателей эозинофилов: увеличение этого показателя в группе 2 (ожог без терапии), в сравнении с группами крыс, получавших лечение (р<0,05). У животных, лечившихся спреем, количество эозинофилов повысилось на 22 %, по сравнению с контролем, при терапии настойкой календулы оно понизилось, что не достоверно (рис. 3).
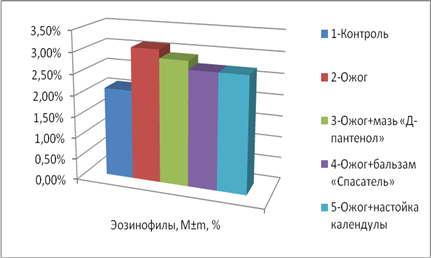
Рис. 3. Количество эозинофилов (M±m, %) в разных опытных группах
Как видно из круговой диаграммы на рис. 4, термическое воздействие без лечения приводило к снижению количества моноцитов, терапия аппликациями бальзамом «Спасатель» и спреем «Д-пантенол» стимулировало незначительное увеличение количества моноцитов в крови, по сравнению с контрольной группой подопытных животных (рис. 4).
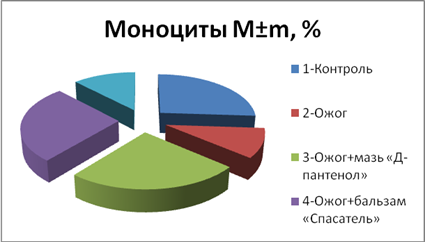
Рис. 4. Количество моноцитов (M±m, %) в разных опытных группах
Заключение
Исследование таких гематологических показателей, как количество эритроцитов, лейкоцитов, уровень гемоглобина и состояние перекисной резистентности эритроцитов, свидетельствует о значительном поражении системы крови под воздействием местного воздействия термического фактора. Наиболее результативными оказались эксперименты терапии ожогов крыс аппликациями спрея «Д-пантенол» и бальзама «Спасатель».
Таким образом, применение в эксперименте лекарственных средств для лечения ожогов (спрей Д-пантенол, бальзам «Спасатель») способствует существенному ингибированию свободнорадикального окисления, к повышению прочности клеточных мембран компонентов крови.
Библиографическая ссылка
Ажикова А.К., Журавлева Г.Ф. ИССЛЕДОВАНИЕ ГЕМАТОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРЫС В НОРМЕ И В УСЛОВИЯХ ТЕРМИЧЕСКОГО ВОЗДЕЙСТВИЯ // Современные проблемы науки и образования. – 2016. – № 2.;
URL: https://science-education.ru/ru/article/view?id=24350 (дата обращения: 14.08.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Сегодня диагностика состояния здоровья любого живого существа невозможна без использования самых прогрессивных способов обследования и современного высокотехнологичного оборудования.
Если заболела домашняя крыса, то правильным решением станет обращение вклинику ВетДруг.
Наиболее распространенными заболеваниями у этого представителя фауны считаются:
- простудные заболевания;
- коньюктивыты(глазные болезни);
- инфекционные болезни и паразиты;
- цистит и патологии мочеполовой системы.
Все необходимые анализы будут сделаны в короткие сроки, на высоком профессиональном уровне, что позволит врачу точно поставить диагноз, назначить курс лечения и подобрать эффективные препараты.
Ветеринарная лаборатория
Прием анализов осуществляет каждая ветеринарная лечебница, но большинство из них ограничиваются забором биоматериала,который впоследствии отправляется в сторонние учреждения.
Такой подход напрямую влияет на продолжительность процедурыи точность результата.
Центр ВетДруг имеет собственную лабораторию, оснащенную оборудованием, которое соответствует самым последним разработкам в сфере ветеринарной диагностики.
Сотрудники, которые имеют большой опыт работы, готовы качественно выполнить любой вид анализов.
1.Биохимическое исследование крови – распространенный и высокоинформативный способ, который позволяет сделать заключение на базе оценки большого количества важных параметров, таких как уровень глюкозы, белка, холестерина, мочевины и билирубина в организме четвероногого пациента.
На основе этих данных доктор может:
- оценить функции печени, поджелудочной железы, почек,желчного пузыря;
- выявить воспаления илинехватку важных микроэлементов и витаминов;
- поставить верный диагноз и подобрать соответствующий курс лечения.
Кровь забирают из ушной раковины, бедренной или яремной вены, венозного сплетения глазницы или через удаление кончика хвоста.
Проводят процедуру утром, на голодный желудок(с момента приема пищи должно пройти не менее 8 часов)
2.Клинический или общий анализ крови относится к категории базового исследования, который позволяет быстро получить большой объем информации о состоянии здоровья пушистого пациента.
В процессе исследования, такие параметры, как уровень СОЭ,эритроцитов,лейкоцитов,тромбоцитов, гемоглобина сравниваются с допустимыми нормами.
На основе этого врач:
- в случае отклонения от норм, назначает дополнительное расширенное обследование;
- ставит диагноз;
- подбирает нужные препараты и способ лечения.
Кровь для анализа берут при помощи иглы из яремной или бедренной вены.
Важно проводить такую процедуру утром, натощак (с момента кормления должно пройти минимум 8 часов).
3.Клинический анализ мочи с микроскопией осадка позволяет получить информацию на основе оценки таких составляющих урины, как глюкоза, билирубин, белок, кетоновые тела, при этом оценивается запах, цвет, насыщенность и прозрачность, выявляется присутствиекристаллов, бактерий, цилиндров и кровяных клеток.
Такая информация нужна для того чтобы:
- обнаружить сбои в работе мочеполовой системы;
- установить точный диагноз;
- назначить правильное лечение и контролировать процесс выздоровления.
Для получения достоверных данных собирать мочу крысы рекомендуется в утреннее время, а доставить в лабораторию ее необходимо в течение 2часов.
4.Анализ кала позволяет установить сбои в работе желудочно – кишечного тракта и оценить общее состояние пищеварительной системы питомца. Такое исследование позволяет:
- определить функциональные патологии печени, кишечника, почек, желудка, желчного пузыря и поджелудочной железы;
- выявить присутствие паразитов и возбудителей инфекций;
- контролировать правильность процесса пищеварения.
Собирать биоматериал следует в утренние часы, в чистую, плотно закрывающуюся емкость. Время доставки не должно превышать 6часов.
5.Микроскопическая диагностика инфекционных заболеваний – это исследование под микроскопом биоматериала крысы, который дает возможность выявить болезни, вызываемые простейшими микроорганизмами.
Таким методом можно:
- выяснить состояние микрофлоры;
- определить вид и концентрацию возбудителей;
- подобрать эффективный курс лечения.
В качестве биоматериала используют мазки, которые забирают из полости рта или носа, подойдет мокрота, кровь или урина крысы.
6.Гистология и цитология – это способы, которые позволяют обнаружить злокачественные или доброкачественные опухоли и образование в тканях живого существа:
- на первом этапе обследования используется метод гистологии, которая предполагает получение биоматериала хирургическим путем, а исследование проводится после операции,
- биоматериал для которой получают из тканей особи, при помощи биопсии, используя специальную иглу;
- если обнаружены уплотнения в структуре, то проводится цитологическая диагностика с углубленным анализом, материал для нее берут с помощью тонкой иглы.
Такой метод диагностики позволяет не только обнаружить новообразования, но и выяснить причины их появления.
7. Мазки на кровепаразитов– это эффективный метод определения всех возможных видов кровепаразитов в организме, появление которых может спровоцировать пироплазмоз и привести к смерти грызуна.
Капиллярную кровь четвероногого пациента помещают на предметное стекло, просушивают, окрашивают, тщательно изучают под микроскопом.
Опасные паразитические организмы (если они есть) будут присутствовать в эритроцитах.
Анализы крысы на дому
Выезд специалистов центра ВетДруг по указанному адресу позволит сделать все необходимые анализы в домашних условиях.
Таким образом можно избежать стресса, который неизбежно испытывает домашний питомец, попадая в незнакомые условия.
При этом будет гарантировано качество исследования на самом высоком уровне.
Наш сотрудник сам доставит биоматериал в лабораторию, соблюдая все правила хранения и перевозки.
Такая услуга доступна москвичам и жителям Московской области 24 часа в сутки, 365 дней в году.
Сколько проводится исследование анализов
Высокотехнологичное оборудование позволит быстро получить результаты – в среднем в течение 1-2 дней. В экстренных ситуациях можно сделать экспресс – анализ и получить результат уже через 2 часа.
