От чего зависит количество принесенного гемоглобином кислорода в ткани
Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и
углекислого газа от тканей к легким (табл. 17.4).
Кровь
осуществляет дыхательную функцию прежде всего благодаря наличию в ней
гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода
основана на способности обратимо связывать кислород. Поэтому в легочных
капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где
парциальное давление кислорода резко снижено, осуществляется отдача кислорода
тканям.
В состоянии
покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При
тяжелой физической работе количество потребляемого тканями кислорода возрастает
в 10 раз и более (до 2–3 л/мин). Доставка от легких к тканям такого количества
кислорода в виде газа, физически растворенного в плазме, невозможна вследствие
малой растворимости кислорода в воде и плазме крови (табл. 17.5).
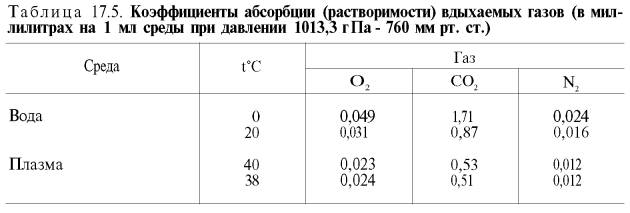
Исходя из
приведенных в табл. 17.5 данных, а также зная РO2 в артериальной
крови – 107–120 гПа (80–90 мм рт. ст.), нетрудно видеть, что количество
физически растворенного кислорода в плазме крови не может превышать 0,3 об. %.
При расчете кислородной емкости крови этой величиной можно пренебречь.
Итак, функцию
переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула
гемоглобина построена из 4 субъединиц (полипептидных цепей), каждая из которых
связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4
гема, к которым может присоединяться кислород, при этом гемоглобин переходит в
оксигемо-глобин.
Гемоглобин
человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе
гемоглобина при полном насыщении кислородом связывает 1 грамм-молекулу
кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать

В венозной
крови в состоянии покоя РО2 = 53,3 гПа, и в этих условиях гемоглобин
насыщен кислородом лишь на 70–72%, т.е. содержание кислорода в 100 мл венозной
крови не превышает
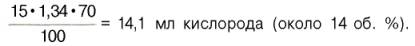
Артериовенозная
разница по кислороду будет около 6 об. %. Таким образом, за 1 мин ткани в
состоянии покоя получают 200–240 мл кислорода (при условии, что минутный объем
сердца в покое составляет 4 л).

Возрастание
интенсивности окислительных процессов в тканях, например при усиленной мышечной
работе всегда связано с более полным извлечением кислорода из крови. Кроме
того, при физической работе резко увеличивается скорость кровотока. Зависимость
между степенью насыщения гемоглобина кислородом и РО2, можно
выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации
оксигемоглобина, которая имеет S-образную форму и характеризует сродство
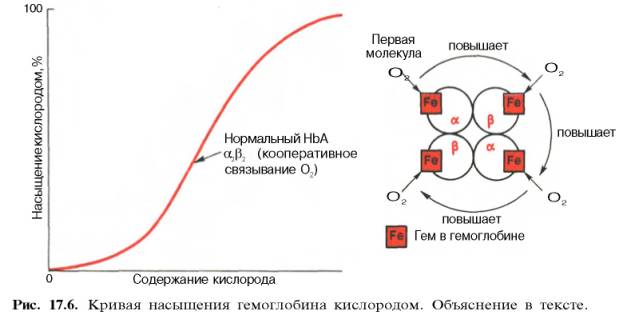
гемоглобина к кислороду (рис. 17.6).
Характерная
для гемоглобина S-образная кривая насыщения кислородом свидетельствует, что
связывание первой молекулы кислорода одним из
гемов
гемоглобина облегчает связывание последующих молекул кислорода тремя другими
оставшимися гемами. Долгое время механизм, лежащий в основе этого эффекта,
оставался загадкой, так как, по данным рентгено-структурного анализа, 4 гема в
молекуле гемоглобина довольно далеко отстоят друг от друга и вряд ли могут
оказывать взаимное влияние. В последнее время принято следующее объяснение
происхождения S-образ-ной кривой. Считают, что тетрамерная молекула гемоглобина
способна обратимо распадаться на две половинки, каждая из которых содержит одну
α-цепь и одну β-цепь:
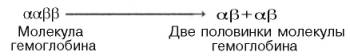
При
взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород
присоединяется к одной из половинок молекулы гемоглобина (допустим, к
α-цепи этой половинки). Как только такое присоединение произойдет,
α-полипептидная цепь претерпевает конформа-ционные изменения, которые
передаются на тесно связанную с ней β-цепь; последняя также подвергается
конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее
сродство к нему. Таким путем связывание одной молекулы кислорода
благоприятствует связыванию второй молекулы (так называемое кооперативное
взаимодействие).
После насыщения
кислородом одной половины молекулы гемоглобина возникает новое, внутреннее,
напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину
гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода,
по-видимому, по очереди связываются со второй половинкой молекулы
гемоглобина, образуя оксигемоглобин.
S-образная
форма кривой насыщения гемоглобина кислородом имеет большое физиологическое
значение. При такой форме кривой обеспечивается возможность насыщения крови
кислородом при изменении РО2 в довольно широких пределах. Например,
дыхательная функция крови существенно не нарушается при снижении РО2
в альвеолярном воздухе со 133,3 до 80–93,3 гПа. Поэтому подъем на высоту до
3,0–3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Численно
сродство гемоглобина к кислороду принято выражать величиной Р50 –
парциальное напряжение кислорода, при котором 50% гемоглобина связано с
кислородом (рН 7,4 температура 37°С). Нормальная величина Р50 около
34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом
вправо означает уменьшение способности гемоглобина связывать кислород и,
следовательно, сопровождается повышением Р50. Напротив, смещение
кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду,
величина Р50 снижена.
Ход кривой
насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от
ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН.
Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50.
В тканевых капиллярах рН ниже (поступает большое количество СО2), в
связи с чем гемоглобин легко отдает
кислород. В легких СО2 выделяется, рН повышается и гемоглобин
активно присоединяет кислород.
Способность
гемоглобина связывать кислород зависит также от температуры. Чем выше
температура (в тканях температура выше, чем в легких), тем меньше сродство
гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные
явления.
Количество
гемоглобина в крови, а также в какой-то мере его способность связывать кислород
(характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом.
Например, у новорожденных содержание гемоглобина доходит до 20–21% (вместо
обычных для взрослого 13–16%). У человека имеется несколько гемоглобинов,
которые образуются в различном количестве в разные стадии онтогенеза и
различаются по своему сродству к кислороду.
Рассмотрим
нарушения дыхательной функции крови при некоторых патологических состояниях.
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Гемоглобин, содержащийся в эритроцитах, переносит к тканям кислород. Узнайте о частой причине нарушения доставки кислорода
Фото: фотобанк Лори
Изменить размер текста:
НОРМА: КИСЛОРОД И УГЛЕКИСЛЫЙ ГАЗ
Воздух, которым мы дышим, на 98% состоит из азота и кислорода. Экология мегаполисов и промышленных районов вносит свои коррективы – в воздухе появляются даже тяжелые металлы.
Но основного компонента – кислорода О2 нам все же хватает. Транспорт для кислорода – это белок гемоглобин, содержащий железо. Он содержится в «красной» крови – эритроцитах. Гемоглобин может легко соединяться с кислородом О2 и углекислым газом СО2. А самое главное – может также легко от них избавляться. Благодаря этому в легких и тканях происходит газообмен. В зависимости от количества того или иного газа и его давления кислород и углекислый газ связываются с гемоглобином.
В воздушном пространстве легких во время вдоха много кислорода – его парциальное давление большое. Поэтому кислород через специальную мембрану между тканью легкого и сосудом поступает в кровь и соединяется с гемоглобином.
С током крови оксигемоглобин поступает к тканям. Например, к мышцам и коже стопы. Там в результате жизнедеятельности клеток накапливается углекислый газ. Его давление большое, поэтому он легко вытесняет кислород из связи с гемоглобина. Кислород поступает в ткани, а СО2 уносится с током крови по венам к легким.
ОПАСНЫЙ ВРАГ №1 – УГАРНЫЙ ГАЗ
Опасность любого пожара – отравление угарным газом. Это жизнеугрожающее состояние. Угарный газ образуется при недостатке кислорода – эта молекула в отличие от углекислого газа содержит всего один атом кислорода. В результате из безобидного СО2 получается злейший СО, ведущий к отравлению организма.
Причина этого – «слабость» кислорода в сравнении с угарным газом. СО в 300 раз крепче связывается с гемоглобином! Обычное парциальное давление кислорода во вдыхаемом воздухе не поможет. Тяжесть состояния пациента в таком случае напрямую связана с объемом гемоглобина, соединенного с угарным газом. В тяжелых случаях жизненно важные органы – сердце, почки, головной мозг – практически лишаются кислорода и погибают при нормальном его содержании во вдыхаемом воздухе.
Решается проблема срочным проведением пациенту гипербарической оксигенации. При этом кислород подается пациенту под повышенным давлением – ему помогают вытеснить угарный газ из эритроцитов.
Ситуация с отравлением угарным газом обычно острая, жизнеугрожающая. Пациент находится под контролем врачей.
ОПАСНЫЙ ВРАГ №2 – ГЛЮКОЗА
Другая ситуация с хроническими заболеваниями. Здесь выявить проблему вовремя часто не удается. Кого сейчас не беспокоят слабость, утомляемость, снижение работоспособности?
Что же это – энергетический кризис в организме или просто усталость, депрессия?
Часто причина может оказаться сладкой – это глюкоза крови. В результате соединения с ней в эритроцитах формируется ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН HbF1c. Его количество напрямую связано с уровнем глюкозы в крови. Основная проблема – это необратимость связывания глюкозы с гемоглобином. До конца жизни эритроцитов (пока они не попадут на распад в селезенку) гемоглобин в них остается в связанном с глюкозой состоянии. Это около 3х месяцев.
Поэтому гликированный гемоглобин, в отличие от разового измерения глюкозы, показывает средний уровень сахара в крови за 3 месяца. Для врачей это очень ценный показатель, особенно при контроле лечения сахарного диабета.
Вред, который наносит гликированный гемоглобин, такой же, как и при отравлении угарным газом. Только это не острая, а растянутая во времени проблема – хроническое кислородное голодание. Симптомы неспецифичны – это может быть и головокружение, общая слабость, плохая переносимость нагрузок. Все они являются результатом хронического дефицита кислорода и энергии.
Реализуется это пагубное влияние не так, как у угарного газа. Глюкоза связывается с гемоглобином и повышает связывание его с кислородом! В тканях кислород не может поменяться местами с углекислым газом – там накапливается СО2. Яркий медицинский пример – диабетическая стопа. При нормальном содержании кислорода в крови он не поступает в мышцы и кожу стопы. В тканях закисляется среда. Отсюда незаживающие раны при диабете. И поэтому одним из эффективных методов лечения диабетической стопы – местная (на нижние конечности) гипербарическая оксигенация.
В федеральной лаборатории «Гемотест» централизованная технологическая база площадью 3 500 квадратных метров включает 5 аналитических лабораторий.
ОБСЛЕДОВАНИЕ НА ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН
Пройти обследование на показатели обмена глюкозы можно в лаборатории федерального уровня «Гемотест». Исследования в «Гемотест» выполняются на высокотехнологичном оборудовании ведущих мировых производителей, технологический комплекс площадью 3 500 кв.м. включает 5 лабораторий. Например, исследование на гликированный гемоглобин выполняется в отделе общеклинических исследований:
1.18. Гликированный гемоглобин (HbA1с)
Другие исследования углеводного обмена:
1.14.2. Глюкоза (фторид) анализ крови на сахар
1.15. Экспресс-анализ глюкозы (определяется на месте)
27.54. Сахарный диабет (скрининг) Это исследование содержит несколько показателей сахарного диабета. О возможности выполнения этого исследования в Вашем городе Вы можете узнать по телефону 8-800-550-13-13.
Всего в федеральной лаборатории «Гемотест» выполняется более 3 000 лабораторных анализов по всем медицинским специальностям. Полный список исследований Вы можете посмотреть на сайте www.gemotest.ru
Желаем Вам здоровья!
Реклама
ИСТОЧНИК KP.RU


