Перенос кислорода гемоглобином биохимия
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
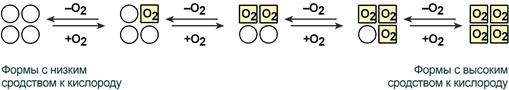
Схема кооперативного взаимодействия субъединиц гемоглобина
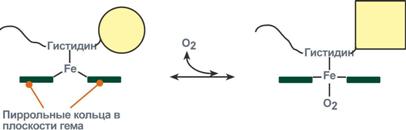
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

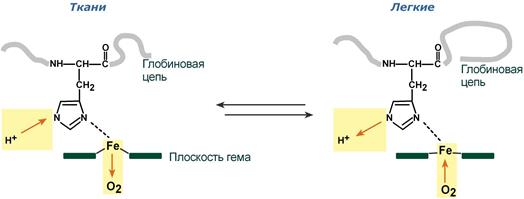
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
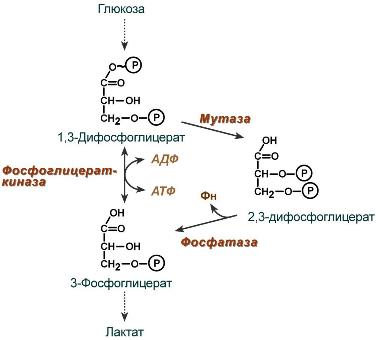
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
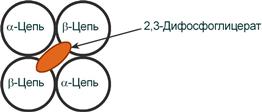
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н + из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H + и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О 2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
источник
Гемоглобин — основной белок крови
Гемоглобин входит в состав группы белков гемопротеины , которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe 2+ . Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. — альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы «в кармане» своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA 2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO 2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO 2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe 2+ , но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe 2+ в Fe 3+ . Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe 3+ в Fe 2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA 1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
источник
ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ. Перенос кислорода кровью
Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким (табл. 17.4).
Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям.
В состоянии покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При тяжелой физической работе количество потребляемого тканями кислорода возрастает в 10 раз и более (до 2–3 л/мин). Доставка от легких к тканям такого количества кислорода в виде газа, физически растворенного в плазме, невозможна вследствие малой растворимости кислорода в воде и плазме крови (табл. 17.5).
Исходя из приведенных в табл. 17.5 данных, а также зная РO2 в артериальной крови – 107–120 гПа (80–90 мм рт. ст.), нетрудно видеть, что количество физически растворенного кислорода в плазме крови не может превышать 0,3 об. %. При расчете кислородной емкости крови этой величиной можно пренебречь.
Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула гемоглобина построена из 4 субъединиц (полипептидных цепей), каждая из которых связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4 гема, к которым может присоединяться кислород, при этом гемоглобин переходит в оксигемо-глобин.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщении кислородом связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать
а каждый грамм гемоглобина – 1,34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13–16%, т.е. в 100 мл крови 13–16 г гемоглобина. При РО2 в артериальной крови 107–120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл крови содержит 19–20 об. % кислорода:
В венозной крови в состоянии покоя РО2 = 53,3 гПа, и в этих условиях гемоглобин насыщен кислородом лишь на 70–72%, т.е. содержание кислорода в 100 мл венозной крови не превышает
Артериовенозная разница по кислороду будет около 6 об. %. Таким образом, за 1 мин ткани в состоянии покоя получают 200–240 мл кислорода (при условии, что минутный объем сердца в покое составляет 4 л).
Возрастание интенсивности окислительных процессов в тканях, например при усиленной мышечной работе всегда связано с более полным извлечением кислорода из крови. Кроме того, при физической работе резко увеличивается скорость кровотока. Зависимость между степенью насыщения гемоглобина кислородом и РО2, можно выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации оксигемоглобина, которая имеет S-образную форму и характеризует сродство гемоглобина к кислороду (рис. 17.6).
Характерная для гемоглобина S-образная кривая насыщения кислородом свидетельствует, что связывание первой молекулы кислорода одним из
гемов гемоглобина облегчает связывание последующих молекул кислорода тремя другими оставшимися гемами. Долгое время механизм, лежащий в основе этого эффекта, оставался загадкой, так как, по данным рентгено-структурного анализа, 4 гема в молекуле гемоглобина довольно далеко отстоят друг от друга и вряд ли могут оказывать взаимное влияние. В последнее время принято следующее объяснение происхождения S-образ-ной кривой. Считают, что тетрамерная молекула гемоглобина способна обратимо распадаться на две половинки, каждая из которых содержит одну α-цепь и одну β-цепь:
При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из половинок молекулы гемоглобина (допустим, к α-цепи этой половинки). Как только такое присоединение произойдет, α-полипептидная цепь претерпевает конформа-ционные изменения, которые передаются на тесно связанную с ней β-цепь; последняя также подвергается конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одной молекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие).
После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой молекулы гемоглобина, образуя оксигемоглобин.
S-образная форма кривой насыщения гемоглобина кислородом имеет большое физиологическое значение. При такой форме кривой обеспечивается возможность насыщения крови кислородом при изменении РО2 в довольно широких пределах. Например, дыхательная функция крови существенно не нарушается при снижении РО2 в альвеолярном воздухе со 133,3 до 80–93,3 гПа. Поэтому подъем на высоту до 3,0–3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Численно сродство гемоглобина к кислороду принято выражать величиной Р50 – парциальное напряжение кислорода, при котором 50% гемоглобина связано с кислородом (рН 7,4 температура 37°С). Нормальная величина Р50 около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно, сопровождается повышением Р50. Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду, величина Р50 снижена.
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН. Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50. В тканевых капиллярах рН ниже (поступает большое количество СО2), в связи с чем гемоглобин легко отдает кислород. В легких СО2 выделяется, рН повышается и гемоглобин активно присоединяет кислород.
Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления.
Количество гемоглобина в крови, а также в какой-то мере его способность связывать кислород (характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20–21% (вместо обычных для взрослого 13–16%). У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и различаются по своему сродству к кислороду.
Рассмотрим нарушения дыхательной функции крови при некоторых патологических состояниях.
источник
Перенос кислорода гемоглобином биохимия
Главная функция эритроцитов (см. с. 268) — транспорт кислорода от легких в ткани и СО 2 от тканей обратно в легкие. Высшие организмы нуждаются для этого в специальной транспортной системе, так как молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворимо только около 3,2 мл О 2 . Содержащийся в эритроцитах белок гемоглобин ( Hb ) способен связать в 70 раз больше — 220 мл О 2 /л. Содержание Hb в крови составляет 140-180 г/л у мужчин и 120-160 г/л у женщин, т. е. вдвое выше по сравнению с белками плазмы (50-80 г/л). Поэтому Hb вносит наибольший вклад в образование рН-буферной емкости крови (см. с. 280).
Гемоглобин взрослого организма ( HbA , см. ниже) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами примерно 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию. Примерно 80% аминокислотных остатков глобина образуют α-спирали, обозначенные буквами А-Н (см. схему). Каждая субъединица несет группу гема (формулу см. на рис. 197) с ионом двухвалентного железа в центре. При связывании O 2 с атомом железа в геме ( оксигенация Hb) и отщеплении O 2 ( дезоксигенация ) степень окисления атома железа не меняется. Окисление Fe 2+ до Fe 3+ в геме носит случайный характер. Окисленная форма гемоглобина, метгемоглобин, не способна переносить O 2 . Доля метгемоглобина поддерживается ферментами на низком уровне и составляет поэтому обычно только 1-2%.
Четыре из шести координационных связей атома железа в гемоглобине заняты атомами азота пиррольных колец, пятая — остатком гистидина глобина (проксимальный остаток гистидина), а шестая — молекулой кислорода в оксигемоглобине и, соответственно, Н 2 О в дезоксигемоглобине.
Б. Аллостерические эффекты в гемоглобине
Аналогично аспартат-карбамоилтрансферазе (см. с. 118) Hb может находиться в двух состояниях (конформациях): обозначаемых как Т- и R-формы соответственно. Т-Форма (напряженная от англ. tense) обладает существенно более низким сродством к O 2 по сравнению с R-формой (на схеме справа). Связывание O 2 с одной из субъединиц Т-формы приводит к локальным конформационным изменениям, которые ослабляют связь между субъединицами. С возрастанием парциального давления O 2 увеличивается доля молекул Hb в высокоаффинной R-форме (от англ. relaxed). Благодаря кооперативным взаимодействиям между субъединицами с ростом концентрации кислорода повышается сродство Hb к O 2 , в результате чего кривая насыщения имеет сигмоидальный вид (см. с 276).
На равновесие между Т- и R-формами влияют различные аллостерические эффекторы , регулирующие связывание O 2 гемоглобином (желтые стрелки). К наиболее важным эффекторам относятся CO 2 , Н + и 2,3-дифосфоглицерат [ДФГ (BPG)] (см. с. 276).
Hb взрослого организма состоит, как упомянуто выше, из двух α- и двух β-цепей (α 2 β 2 ). Наряду с этой основной формой ( HbA 1 ) в крови присутствуют незначительные количества второй формы с более высоким сродством к O 2 , у второй β-цепи заменены δ-цепя-ми ( HbA 2 , α 2 δ 2 ). Две другие формы Hb встречаются только в эмбриональном периоде развития. В первые три месяца образуются эмбриональные гемоглобины состава ξ 2 ε 2 и α 2 γ 2 . Затем вплоть до рождения доминирует фетальный гемоглобин (HbF, α 2 δ 2 ), который постепенно заменяется на первом месяце жизни на HbА. Эмбриональный и фетальный гемоглобины обладают более высоким сродством к О 2 по сравнению с HbА, так как они должны переносить кислород из системы материнского кровообращения.
источник
