Переносчики кислорода миоглобин и гемоглобин
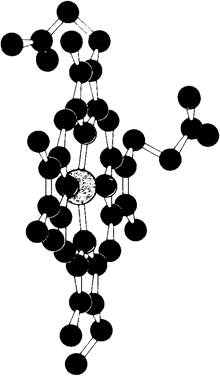
МИОГЛОБИН – сложный глобулярный белок, третьего уровня структурной организации, молекула которого состоит из 1 полипептидной цепи и содержит 153 аминокислоты. В миоглобине содержится железопорфириновая группа (гем), и он способен обратимо присоединять кислород.
Миоглобин содержится в клетках скелетных мышц. Пептидная цепь миоглобина напоминает длинную колбасу, причудливо скрученную. Было показано, что остов молекулы миоглобина состоит из 8 относительно прямолинейных отрезков, разделенных между собой местами сгибов. Каждый отрезок закручен в виде a-спирали. Все спирали являются правыми. 70 % аминокислотных остатков входят в состав спирализованных участков.
Свойства миоглобина:
1. молекула миоглобина компактна (внутри нее может уместиться 4Н2О);
2. все полярные R- группы аминокислотных остатков расположены на внешней поверхности молекулы и находятся в гидратированном состоянии, т.е. связаны с Н2О;
3. неполярные, или гидрофобные R- группы располагаются в глубине молекулы и защищены от соприкосновения с Н2О;
4. остатки пролина встречаются только в метах сгибов пептидной цепи (пролин нарушает a-спираль). В местах сгибов находятся и другие аминокислоты, которые неспособны легко образовывать a-спираль (изолейцин, серин), и аминокислоты, боковые цепи которых несут одинаковые заряды при рН7;
5. у миоглобинов, выделенных из разных млекопитающих, конформация пептидных цепей сходна (но они несколько отличаются по аминокислотному составу).
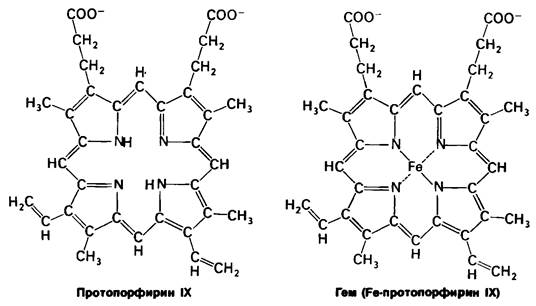
ГЕМ – комплекс порфирина и иона железа в степени окисления +2.
Ион железа встроен в кольцо порфирина таким образом, что четыре координационные связи из шести (в состоянии гибридизации sp3d2 связи у шестикоординационного железа направлены к вершинам октаэдра) затрачены на образование связей с атомами азота, еще одна связана с азотом имидазольного остатка ГИС полипептидной цепи (проксимальный Гистидин F8), а другая- также с имидазольным остатком другого ГИС (дистальный ГИС Е7). Молекула кислорода присоединяется между остатком дистального ГИС и железом. Изменения степени окисления железа при этом не происходит. Порфириновое кольцо (ГЕМ) не находится на плоскости молекулы белка, а частично погружено в него. Молекула кислорода присоединяется к гему, входя как бы через открывающуюся дверцу. Пока остается несным, дожидается молекула кислорода случайного открывания двери, или существует какой-то механизм, пускающий кислород к гему.
Миоглобин сосредоточен, главным образом, в мышцах и его главной функцией является хранение кислорода. Скорость насыщения миоглобина кислородом намного превышает таковую для гемоглобина. Миоглобин мало приспособлен для транспортировки кислорода из легких в ткани, поскольку скорость отдачи кислорода в тканях невелика (при давлении 1 мм рт. ст. примерно половина миоглобина все еще не отдает кислород).
Вопросы транспортировки кислорода решаются при участии белка четвертичной структуры – гемоглобина.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА ГЕМОГЛОБИНА. При помощи рентгеноструктурного анализа Перутцем и его сотрудниками в Кембридже установлены третичная и четвертичная структуры гемоглобина. Гемоглобин содержится в эритроцитах и служит для переноса кислорода. Молекулярная масса гемоглобина 64500. Молекула состоит из 4 отдельных полипептидных цепей: 2 a-цепей (141 остаток аминокислот) и 2 b- цепей (146 остатков аминокислот в каждой), каждая из которых связана нековалентной связью с остатками гема. Каждая из 4 отдельных цепей гемоглобина свернута нерегулярным образом и состоит из ряда a- спиральных участков, разделенных местами сгибов.
a- и b- цепи гемоглобина примерно на 70 % состоят из a-спиральных участков. По своей третичной структуре a- и b-цепи очень сходны, они образованы из a- спиральных участков одинаковой длины, согнутых под одинаковыми углами и в одних и тех же направлениях. Третичная структура a- и b-цепей гемоглобина очень сходна с третичной структурой единственной цепи миоглобина. Сходная функция гемоглобина и миоглобина, обусловленная способностью обратимо связывать О2, объясняется сходством третичной структуры.
Согласно данным рентгеноструктурного анализа молекула гемоглобина по своей форме приближается к сфере диаметром ~ 5,5 нм. 4 полипептидные цепи уложены относительно друг друга приблизительно в виде тетраэдра, в результате чего возникает характерная четвертичная структура гемоглобина.
Это очень компактная структура. Большинство гидрофобных R- групп аминокислот находится внутри глобулы, а большинство гидрофильных R- групп – снаружи. В молекуле гемоглобина возникает небольшое число контактов между одинаковыми цепями (2 a- и 2 b- цепями) и множество контактов между a- и b- цепями. В образовании таких контактов принимают участие в основном гидрофобные R- группы аминокислотных остатков.
При присоединении к гемоглобину кислорода расстояние между 2 b- цепями гемоглобина уменьшается и изменяется четвертичная структура. Таким образом, гемоглобин и оксигемоглобин (насыщенный кислородом) различаются по своей четвертичной структуре.
Четвертичная структура олигомерных белков также определяется первичной аминокислотной последовательностью входящих в их состав отдельных полипептидных цепей. Олигомерные белки (гемоглобин) обнаруживают способность к самосборке.
Главное отличие гемоглобина от миоглобина заключается в проявлении особого рода эффектов – кооперативных, влияющих на скорости присоединения- отсоединения молекул кислорода. Каждая молекула гемоглобина способна присоединять и переносить четыре молекулы кислорода, при этом кооперативность проявляется в том, что как присоединение, так и отсоединение каждой последующей молекулы кислорода облегчается в результате структурных изменений в конформации молекулы, которых у гемоглобина имеется две основных- оксигенированная и дезоксигенированная. Промежуточные состояния нестабильны. Предполагается следующий механизм кооперативного эффекта. Присоединение первой молекулы кислорода приводит к тому, что атом железа смещается от своего места примерно на 0,4-0,6 ангстрем, вызывая изменения конформации субъединицы. Изменившаяся конформация по аллостерическому эффекту облегчает присоединение кислорода к другой субъединице и т.д. Это позволяет максимально ускорить процесс присоединения кислорода в легких (рО2 = 100 мм рт. ст.). При переносе оксигенированного гемоглобина в капилляры тканей (рО2 = 5 мм рт. ст.) отсоединение молекул кислорода протекает также быстро, по кооперативному эффекту. Известны, впрочем, и химические регуляторы скорости и полноты присоединения кислорода. К ним, в частности, относится 2,3- дифосфоглицериновая кислота. Она облегчает присоединение кислорода у организмов, обитающих в высокогорных районах.
БИОХИМИЯ – Л. Страйер – 1984
ТОМ 1
ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
Переход от анаэробного существования к аэробному – важнейший этап эволюции, ибо он открыл богатейшие источники энергии. В присутствии кислорода из глюкозы можно получить в 18 раз больше энергии, чем в его отсутствие. В ходе эволюции у позвоночных выработались два основных механизма, обеспечивающих снабжение клеток постоянным и достаточным количеством кислорода. Первый-это система кровообращения, которая активно поставляет клеткам кислород. Если бы не было системы кровообращения, то размеры аэробных организмов не превышали бы миллиметра, поскольку диффузия кислорода на большие расстояния оказалась бы слишком медленной и отставала бы от потребностей клеток. Второе важнейшее приспособление для снабжения клеток кислородом – это появление в процессе эволюции специальных молекул-переносчиков кислорода, позволившее преодолеть ограничения, накладываемые низкой растворимостью кислорода в воде. У позвоночных переносчиками кислорода служат белки гемоглобин и миоглобин. Гемоглобин, содержащийся в эритроцитах, выполняет функцию переносчика кислорода кровью. Наличие гемоглобина резко увеличивает способность крови переносить кислород – с 5 до 250 мл O2 в расчете на один литр крови. Гемоглобин играет также жизненно важную роль в транспорте углекислого газа и ионов водорода. Миоглобин, находящийся в мышцах, выполняет функцию резервного источника кислорода и облегчает транспорт кислорода в мышцах.
3.1. Кислород присоединяется к простетической группе гема
Способность миоглобина и гемоглобина связывать кислород обусловлена наличием в них неполипептидного компонента, а именно гема. Гем определяет также красный цвет этих белков. Вообще очень многие белки содержат прочносвязанные специфические неполипептидные компоненты, необходимые для проявления биологической активности. Такие компоненты получили название простетических групп. Белок, лишенный своей простетической группы, называют апопротеином.
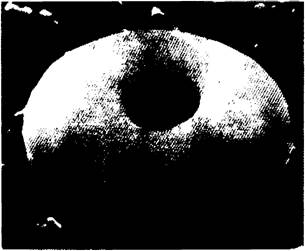
Рис. 3.1. Изображение эритроцита, полученное с помощью сканирующего электронного микроскопа
Гем состоит из органической части и атома железа. Органическая часть -протопорфирин -образована из четырех пиррольных групп. Четыре пиррола соединяются метиленовыми мостиками, образуя тетрапиррольное кольцо. К нему присоединены 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Возможны 15 вариантов пространственного расположения этих заместителей. В биологических системах присутствует только один из изомеров, называемый протопорфирин IX.
Изображение эритроцитов (двояковогнутой формы) и лейкоцитов (округлые) в мелком кровеносном сосуде, полученное с помощью сканирующего электронного микроскопа
Атом железа в геме присоединен к 4 атомам азота в центре протопорфиринового кольца (рис. 3.2 и 3.3). Железо может давать еще дополнительные связи-по обе стороны плоскости гема. Эти направления связей обозначают как пятое или шестое координационные положения. Атом железа в геме может быть в ферроформе (+2) или ферриформе (+3). Соответствующие формы гемоглобина называют феррогемоглобин или ферригемоглобин. Ферригемоглобин называется также метгемоглобином. Только феррогемоглобин (+2) способен связывать кислород. Аналогичная номенклатура применима и к миоглобину.

Рис. 3.2. Атом железа в геме способен образовывать шесть связей. Четыре из них расположены в плоскости гема. Пятая находится по одну сторону от этой плоскости, шестая-по другую. Расположение связанных с железом атомов называют также координационными положениями
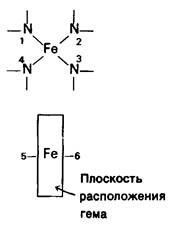
Рис. 3.3. Гем гемоглобина (желтым показано Fе, синим – N, красным-О, черным-С)
ПредыдущаяСодержаниеСледующая
Гемоглобин – состоит из белка глобина и небелковой части гема, в составе которого имеется атом Fе(II). Молекула Нb содержит 4 гема и является белком с четвертичной структурой (4 субъединицы – 2 α-цепи и 2 β-цепи, каждая из которых имеет свою третичную структуру и особым образом уложена вокруг кольца гема). Каждая из субъединиц похожа на молекулу миоглобина. Молекула гемоглобина способна присоединять 4 молекулы О2. Гемоглобин переносит кислород от легких к тканям, а углекислый газ в обратном направлении. Нb + О2 → НbО2 – оксигемоглобин – в капиллярах легких Нb насыщается кислородом при высоком парциальном давлении (100 мм рт. ст.).
В капиллярах тканей, где парциальное давление кислорода низкое (5 мм рт. ст.) НbО2 → на Нb и О2. Кислород переходит в ткани, а освободившийся Нb соединяется с поступившим из тканей СО2 и превращается в НbСО2 – карбгемоглобин, который переносится с кровью к легким. В легочных капиллярах НbСО2 → Нb + СО2. СО2 выводится из организма при выдыхании, а Нb вновь насыщается кислородом.
Сравнение зависимости насыщения от парциального давления кислорода показывает, что при парциальных давлениях кислорода, характерных для тканей, гемоглобин отдает значительные количества кислорода. В гемоглобине происходит перемещение атома железа в плоскость гема с одновременным изменением конформации полипептидной цепи, но так как молекула Нb имеет четвертичную структуру и отдельные цепи связаны между собой, то это позволяет передать изменения конформации на область связи между полипептидными цепями. Это изменяет положение в пространстве всей молекулы и облегчает доступ О2 к остальным гемам молекулы Нb. Одновременно это изменение конформации сопровождается появлением на поверхности групп, которые, диссоциируя, отдают протоны (Н+) в окружающую среду. При понижении парциального давления кислорода события повторяются в обратном направлении: отдача кислорода идет по мере снижения парциального давления, гемоглобин переходит в другое конформационное состояние, при этом из окружающей среды (ткань), где высока концентрация протонов, протоны присоединяются к гемоглобину. Такие изменения конформации позволяют гемоглобину не только регулировать обеспечение кислородом тканей, но и участвовать в поддержании кислотно-основного равновесия в организме.
При отравлении угарным газом в крови образовывается карбоксигемоглобин Нb + СО → НbСО – прочное соединение, препятствует образованию НbО2 и транспорту кислорода. Возникает кислородное голодание.
Различные формы Нb определяются методом спектрального анализа. У взрослого человека молекула НbА (2 α-цепи и 2 β-цепи). Но от целого ряда условий состав цепей гемоглобина может меняться. У плода НbF (фетальный – 2 α-цепи, 2 γ-цепи) – он лучше связывает кислород при его относительной недостаточности в период внутриутробного развития.
В результате определенных нарушений генетического аппарата клетки Нb патологический, а заболевания – гемоглобинопатии наследственного происхождения.
Классическим примером является серповидно-клеточная анемия(аномальный гемоглобин – причина). Синтезируется β-цепь необычного состава, в которой валин занимает место глутаминовой кислоты, присутствующей в нормальном НbА. Изменение такое вызывает нарушение структуры и свойств Нb, который обозначается НbS – он легко выпадает в осадок, обладает сниженной способностью переносить кислород. В результате эритроциты, содержащие НbS приобретают форму серпа. Клинически: нарушается кровообращение и дыхание, иногда летальный исход.
Миоглобин – хромопротеид, содержащийся в мышцах. Он обладает простетической группой – гемом, циклическим тетрапирролом, придающим ему красный цвет. Тетрапиррол состоит из 4 пиррольных колец, соединенных в плоскую молекулу метиленовыми мостиками. Атом железа занимает центральное положение в этой плоской молекуле. Железо в составе гема цитохромов способно менять свою валентность, в гемоглобине и миоглобине изменение валентности железа нарушает их функцию. Главная функция и гемоглобина и миоглобина – связывание кислорода.
Миоглобин – сферическая молекула, состоит из 153 аминокислот с общей молекулярной массой 17000. он состоит из одной цепи, аналогичной субъединице Нb. На уровне вторичной структуры он образует 8 α-спиральных участков, захватывающих почти 75% всех аминокислот молекулы. Атом железа в геме миоглобина, не связанный с кислородом, выступает из плоскости молекулы на 0,03 нм. В оксигенированной форме атом железа как бы погружается в плоскость молекулы гема. Образуя связь с одной из молекул гистидина глобиновой части, железо при соединении с кислородом изменяет и конформацию белка. Миоглобин удобен для хранения кислорода, но не удобен для транспорта его по крови. Это объясняется процессом насыщения миоглобина в зависимости от парциального давления кислорода. Так как в легких парциальное давление кислорода 13,3 кПа, миоглобин хорошо бы насыщался кислородом, но в венозной крови это давление составляет 5,3 кПа, а в мышцах ещё меньше – 2,6 кПа. Миоглобин в таких условиях сможет отдавать мало кислорода и будет недостаточно эффективен в транспорте кислорода от легких к тканям.
Гем –простетическая группа многих важных с точки зрения функций белков.
Гем – небелковая часть, в составе находится Fе (ΙΙ), гем входит в состав флавопротеинов, гемопротеидов, гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов.
Знание вопросов биосинтеза и распада гема призвано помочь в понимании роли гемопротеинов в организме. Нарушение этих процессов связано с развитием заболеваний. Так, с нарушением биосинтеза гема связана группа заболеваний – порфирии.
Порфирии – группа заболеваний с нарушением биосинтеза гемма. группа заболеваний с нарушением биосинтеза гемма. Наблюдается накопление побочных промежуточных продуктов, которые откладываются в различных органах или выделяются в повышенных количествах с калом или мочой. Появление в моче в значительных количествах веществ незавершенного синтеза гемма либо продуктов его распада (копропорфирин и уропорфирин) вызывает порфиринурию. Моча пурпурно-красного цвета. Это бывает при некоторых поражениях печени, кишечных кровотечениях, интоксикациях. Порфиринурия является одним из признаков отравления свинцом, когда нарушается транспорт Fe, необходимого для синтеза гемоглобина.
Гораздо чаще встречаются патологические состояния, связанные с распадом гема и нарушением выведения из организма продуктов его катаболического превращения. Наиболее распространенной является желтуха.
глицин + сукцинил – КоА
синтаза 5-аминолевулиновой кислоты
5 – аминолевулиновая кислота
Уропорфириноген ΙΙΙ В цитоплазме клеток
Копропорфириноген ΙΙΙ
Протопорфирин ΙΧ
В митохондриях + Fe2+
клетки
Гем
Из многих представителей хромопротеидов для человека наибольшее значение имеет гемоглобин. Хромопротеиды растительного и животного происхождения, находящиеся в пищевых продуктах, подвергаются действию ферментов пищеварительного тракта.
Гемоглобин пищи, находящийся в ней в денатурированном состоянии, легко гидролизуется, распадаясь на простетическую группу и белок. Белок расщепляется пепсином и трипсином с образованием пептидов и аминокислот. Следовательно, глобиновая часть гемоглобина подвергается обычным превращениям в ЖКТ, которые свойственны простым белкам. Простетическая группа – гемм – окисляется в гематин. Гематин всасывается в кишечнике очень плохо. Эти пигменты выделяются с калом частью в неизмененном виде, частью в виде различных продуктов, образующихся под влиянием бактерий кишечника. Обычные химические способы обнаружения крови в кале, имеющие большое значение для клиники, основаны на реакциях гематина, и могут дать достоверные результаты только в том случае, если диета не содержит мяса, в котором присутствует миоглобин.
Время жизни эритроцитов у взрослого организма составляет около 4 месяцев. Спустя этот период времени эритроциты разрушаются в основном в печени, селезенке и костном мозге. В ходе разрушения из эритроцитов высвобождается гемоглобин (8 – 9 г в сутки).
В декабре 1927 года норвежский зоолог Дитлев Рустад в 1750 километрах от побережья Антарктиды обнаружил очень странную рыбу с прозрачным телом и молочно-белыми жабрами. Когда Рустад вскрыл рыбу, он обнаружил, что ее кровь была бесцветной, как стекло. Так в его дневнике появилась запись «бесцветная кровь»…
Зачем нужен гемоглобин?
Практически всем видам позвоночных животных для транспорта кислорода к тканям необходима специальная система доставки, поскольку молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворяется всего лишь 3,2 мл О2. Содержащийся в эритроцитах позвоночных белок гемоглобин (Hb, рис. 1) способен связать в 70 раз больше — 220 мл О2/л. Содержание Hb в крови человека варьирует в пределах 120–180 г/л, что вдвое выше, чем концентрация белков плазмы (50–80 г/л). Поэтому гемоглобин вносит наибольший вклад в поддержание рН-буферной емкости крови. По своей структуре гемоглобин взрослого человека (HbA) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами около 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию.
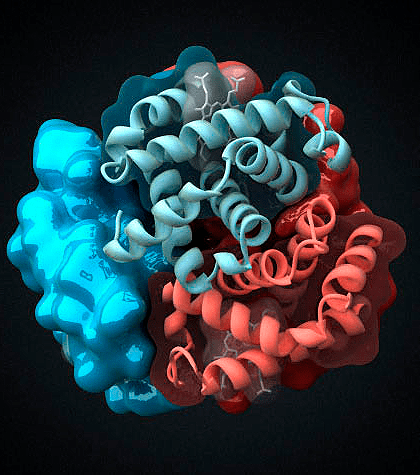
Рисунок 1. Молекула гемоглобина. Гемоглобин является одним из наиболее хорошо изученных белков. Он был открыт немецким физиологом Отто Функе в 1851 году, а структуру этого белка описал австрийский молекулярный биолог Макс Перутц в 1959 году, за что тремя годами позднее получил Нобелевскую премию по химии [1].
Visual Science
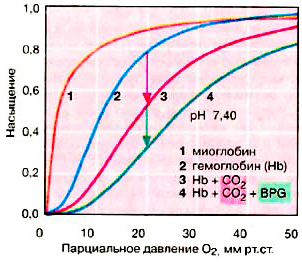
Рисунок 2. Насыщение гемоглобина и миоглобина кислородом
Каждая субъединица гемоглобина несет группу гема с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется. Окисление Fe2+ до Fe3+ в геме носит случайный характер. Окисленная форма гемоглобина — метгемоглобин — не способна переносить O2. Доля метгемоглобина поддерживается ферментами на низком уровне и составляет 1–2% [2]. Центры связывания O2 на каждой из четырёх субъединиц действуют кооперативно: когда молекула O2 связывается с одним из них, у других возрастает сродство к кислороду (данное явление называют положительной кооперативностью) [3]. Вследствие этого кривая насыщения гемоглобина кислородом имеет ярко выраженный сигмоидальный характер (рис. 2, кривая 2).
Другой мышечный белок — миоглобин, являющийся эволюционным предшественником гемоглобина, — является мономером и содержит единственный центр связывания O2, из-за чего его кривая насыщения кислородом несигмоидальна (рис. 2, кривая 1). Сродство к кислороду у миоглобина примерно в 13 раз выше, чем у гемоглобина (50%-насыщение миоглобина O2 достигается уже при парциальном давлении кислорода в 1–2 мм рт. ст., в то время как для гемоглобина эта цифра равна 26 мм рт. ст.) [4]. Из-за этого гемоглобин способен эффективно отдавать кислород в тканях и является более эффективным переносчиком, чем миоглобин. Но из этого не следует, что миоглобин малоэффективный и плохо устроенный белок, поскольку он выполняет принципиально иную биологическую функцию — запасание кислорода и обеспечение им митохондрий. Данные адаптивные различия между миоглобином и гемоглобином появились в результате миллионов лет эволюции…
Прозрачные рыбы
В 1927 году экспедицией норвежских китобоев близ острова Буве во время очередной промысловой охоты была поднята на сушу невиданная рыба, практически бесцветная и, самое интересное, с прозрачной («стеклянной») кровью. Это был первый обнаруженный вид позвоночных, не содержащих белка гемоглобина. За счет поразительного сходства головы рыбы с головой крокодила, рыбу назвали крокодиловая белокровка (Chaenocephalus aceratus). Белокровки (Channichthyidae; рис. 3) или ледяные рыбы обитают в холодных водах возле Антарктиды и южного побережья Южной Америки. Температура воды в этих краях опускается аж до −1,9 °C (температура замерзания морской воды ниже, чем пресной), причем является довольно постоянной.
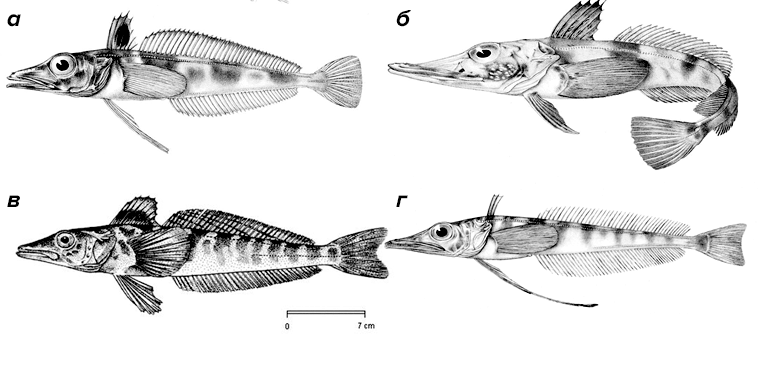
Рисунок 3. Некоторые представители белокровок. а — Chaenodraco wilsoni. б — Chaenocephalus aceratus. в — Champsocephalus gunnari. г — Cryodraco atkinsoni. Белокровки (Channichthyidae) — семейство из отряда Окунеобразные (Perciformes), в котором описано 16 видов. Данные рыбы питаются крилем, рачками и другими рыбами. Недавние исследования показали, что рацион этих рыб различается в зависимости от возраста. В целом, в рационе преобладает антарктический криль (Euphausia superba) и равноногие рачки (Themisto gaudichaudii). В рационе молодых особей преобладает Т. gaudichaudii и эвфаузииды (Thyanoessa sp.), а доля антарктического криля меньше. Ледяные рыбы достигают общей длины 25–75 см. Они являются пелагиальными представителями антарктических вод, обитают на глубине от 200 до 700 метров. Некоторые подвиды C. aceratus обнаруживаются в районе 1–2 тыс. метров. Белокровки — доминирующий вид в Антарктиде, полностью лишенный плавательного пузыря, в связи с чем многие виды этих рыб являются донными.
Очень немногие рыбы могут выжить в суровых условиях Антарктики. Ледяная рыба выживает за счет специального антифриза, присутствующего в крови и предотвращающего образование кристаллов льда в организме. Этот антифриз (AFGP, antifreeze glycoprotein) представляет собой гликопротеин, предположительно произошедший от панкреатической трипсиногеноподобной протеазы [9]. AFGP способен связываться с микроскопическими кристалликами льда и предотвращать их рост [10].
Ледяные рыбы имеют очень низкий уровень метаболизма и проводят большую часть времени практически неподвижно. Белокровки обитают в богатой кислородом воде и поглощают его непосредственно через кожу [11], потому что при пониженных температурах кровь, содержащая гемоглобин, становится очень вязкой, и выживание с такой кровью было бы весьма проблематично.
Отсутствие гемоглобина компенсируется модификацией сердечнососудистой системы. Все представители ледяных рыб имеют большее сердце, чем у других рыб такого же размера, а это увеличивает ударный объем, в несколько раз повышает общее количество циркулирующей крови и поднимает скорость кровотока. При низком артериальном давлении это достигается за счет снижения системного сопротивления потоку. Сочетание высокой пропускной способности сердечнососудистой системы, высокого содержания кислорода и относительно низких скоростей метаболизма ледяной рыбы позволяет обеспечить достаточное количество кислорода в тканях [12].
Гемоглобиновая потеря
Белокровки пережили потерю генов гемоглобина достаточно давно. Как показывает молекулярный анализ, почти у всех ледяных рыб одна мутация привела к потере гена, кодирующего β-цепь и часть α-цепи гемоглобина. Потеря способности к синтезу гемоглобина вызвала развитие компенсаторных изменений: увеличился объем сердца и общий объем крови (приблизительно в 3.5 раза по сравнению с костистыми рыбами аналогичного размера) [13–15]. Ученые, проанализировав ДНК представителей нототениевых рыб, пришли к выводу, что только у одного вида белокровок (Neopagetopsis iona) присутствуют гены гемоглобина, но они не являются функциональными [16].
Наряду с гемоглобином, у белокровок отсутствует и миоглобин, переносящий кислород в скелетных мышцах. При этом у десяти видов миоглобин сохранился только в сердечной мышце (в частности, в желудочке) [17], а у шести видов миоглобин был утрачен и там, причем механизм утраты гена у каждого вида индивидуален [18]. Общим механизмом подобной утраты является дупликация коротких (5–25-нуклеотидных) фрагментов, приводящая к сдвигу рамки считывания, преждевременной терминации транскрипции, появлению ложного сигнала полиаденилирования или нарушению связывания РНК-полимеразы с промоторной областью ДНК [19], [20].
Утрата гемоглобина первоначально должна была стать адаптацией к холоду: известно, что растворимость кислорода в холодной воде выше [21], а значит, потребность в гемоглобине, напротив, меньше. Отсутствие эритроцитов также снижает вязкость крови, что особенно критично в условиях экстремально низкой температуры. В процессе эволюции у белокровок произошли довольно радикальные изменения, компенсирующие утрату гемоглобина, включая вдвое большие энергозатраты по перекачке крови по сравнению с другими рыбами [22].
Ледяные рыбы произошли от малоподвижного донного предка. В холодных, хорошо перемешиваемых, богатых кислородом антарктических водах рыбы с низкой скоростью метаболизма могут выжить даже без гемоглобина. В середине третичного периода экологический кризис в Южном океане, вызванный похолоданием [23], привел к появлению обширных пустующих экологических ниш. Отсутствие конкуренции позволило мутантам, не имеющим гемоглобина, оставить после себя потомство, которое заселило пустые места обитания. У детенышей развились механизмы компенсации мутаций. В относительно изолированных фьордах образовались места обитания, которые колонизировали несколько особей, что привело к возникновению шести видов рыб, изолированных друг от друга и независимо потерявших гены глобинов [22].
Гистологически показано, что особенностью ледяных рыб является высокий объем митохондрий при сходном их количестве и высокое отношение липид/белок в митохондриальных мембранах в сравнении с близкородственными видами семейства нототениевых рыб (рис. 4). Интересно, что у белокровок, у которых отсутствует миоглобин в скелетной мускулатуре, но присутствует в сердечной, объем митохондрий в скелетных мышцах существенно выше, чем в миокарде. О молекулярных механизмах этого феномена известно довольно мало. Предположительно, это явление связанно с одним из ключевых белков-регуляторов биогенеза митохондрий PGC-1α [23].
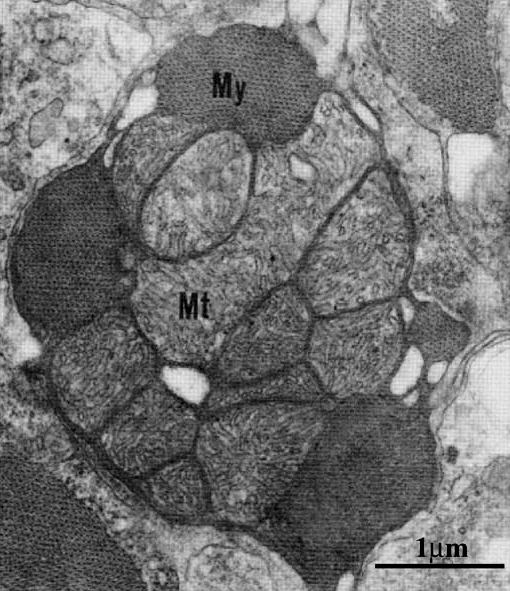
Рисунок 4. Поперечный разрез миоцитов желудочков сердца (C. aceratus). Большие митохондрии (Mt) по периферии окружены миофибриллами (My).
Регулятором биогенеза мембран митохондрий у белокровок является оксид азота-II (NO) (рис. 5). По сравнению с другими рыбами, у белокровок наблюдается повышенное содержание этого сигнального агента в крови. В ответ на потерю гемоглобина и миоглобина в мышцах ледяных рыб увеличивается биосинтез фосфолипидов, причем, независимо от синтеза митохондриальных белков и репликации митохондриальной ДНК, это приводит к увеличению размера митохондрий. Молекула NO стимулирует образование PGC-1α, который регулирует репликацию митохондриальной ДНК. Но ничего не известно о том, как биосинтез митохондриальных фосфолипидов интегрирован в этот процесс у ледяных рыб; возможно, это индуцируется высоким уровнем NO (темная стрелка на рисунке) [18].
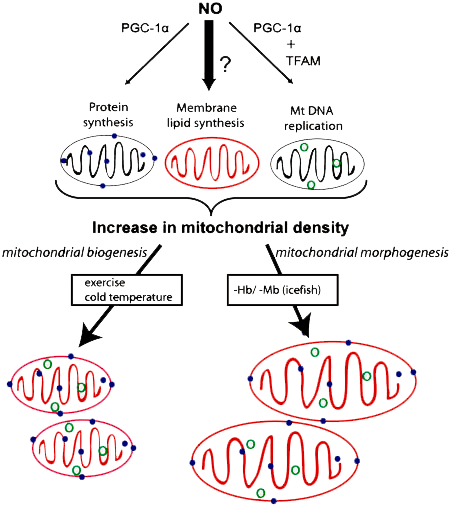
Рисунок 5. Процесс биогенеза митохондрий у ледяных рыб. Образование митохондрий включает в себя синтез митохондриальных белков (синие точки), фосфолипидов и репликацию митохондриального генома (зеленые кружки). В ответ на стимулы, такие как понижение температуры (или повышение физической нагрузки у млекопитающих) эти три компонента митохондриального биогенеза согласованно активируется, что приводит к увеличению плотности митохондрий.
Заключение
Безусловно, гемоглобин — жизненно важный белок, на котором основано дыхание большинства организмов. Эволюция гемоглобина происходила миллионы лет, но в специфических условиях Антарктики (холодная вода, обогащенная кислородом) адаптивные преимущества могут достигаться за счет эволюционной утраты гемоглобина (дезадаптация). Ледяные рыбы являются одной из ярких иллюстраций того, как гены, которые считаются абсолютно необходимыми для жизни позвоночных, в определенных условиях могут редуцироваться, обеспечивая выживание вида. Причудливы пути эволюции.
- Макс Перутц. «Наука и техника»;
- Кольман Я., Рём К.-Г., Вирт Ю. Наглядная биохимия. М.: «Мир», 2000. — 469 с.;
- Ленинджер А. Основы биохимии. М.: «Мир», 1985. — 369 с.;
- Проссер Л. Сравнительная физиология животных. М.: «Мир», 1977. — 574 с.;
- Tate R.C. Fishes. London: Printed by order of the trustees of the British Museum, 1914;
- Tate R.C. Antarctic fishes of the Scottish National Antarctic expedition. Edinburg: Robert Grant & Son, Williams & Norgate, 1913;
- Champsocephalus gunnari. Encyclopedia of life;
- Википедия: Белокровные рыбы;
- Chi-Hing C. Cheng, Liangbiao Chen. (1999). Evolution of an antifreeze glycoprotein. Nature. 401, 443-444;
- J. A. Raymond, A. L. DeVries. (1977). Adsorption inhibition as a mechanism of freezing resistance in polar fishes.. Proceedings of the National Academy of Sciences. 74, 2589-2593;
- C.-H Christina Cheng, H William Detrich. (2007). Molecular ecophysiology of Antarctic notothenioid fishes. Philosophical Transactions of the Royal Society B: Biological Sciences. 362, 2215-2232;
- Karl-Hermann Kock. (2005). Antarctic icefishes (Channichthyidae): a unique family of fishes. A review, Part I. Polar Biol. 28, 862-895;
- Yuqiong Zhao, Manoja Ratnayake-Lecamwasam, Sandra K. Parker, Ennio Cocca, Laura Camardella, et. al.. (1998). The Major Adult α-Globin Gene of Antarctic Teleosts and Its Remnants in the Hemoglobinless Icefishes. J. Biol. Chem.. 273, 14745-14752;
- Guido di Prisco, Ennio Cocca, Sandra K Parker, H.William Detrich. (2002). Tracking the evolutionary loss of hemoglobin expression by the white-blooded Antarctic icefishes. Gene. 295, 185-191;
- Guido di Prisco, Joseph T. Eastman, Daniela Giordano, Elio Parisi, Cinzia Verde. (2007). Biogeography and adaptation of Notothenioid fish: Hemoglobin function and globin–gene evolution. Gene. 398, 143-155;
- T. J. Near. (2006). A Genomic Fossil Reveals Key Steps in Hemoglobin Loss by the Antarctic Icefishes. Molecular Biology and Evolution. 23, 2008-2016;
- B. D. Sidell, M. E. Vayda, D. J. Small, T. J. Moylan, R. L. Londraville, et. al.. (1997). Variable expression of myoglobin among the hemoglobinless Antarctic icefishes. Proceedings of the National Academy of Sciences. 94, 3420-3424;
- K. M. O’Brien, I. A. Mueller. (2010). The Unique Mitochondrial Form and Function of Antarctic Channichthyid Icefishes. Integrative and Comparative Biology. 50, 993-1008;
- D. J. Small. (2003). The myoglobin gene of the Antarctic icefish, Chaenocephalus aceratus, contains a duplicated TATAAAA sequence that interferes with transcription. Journal of Experimental Biology. 206, 131-139;
- B. D. Sidell. (2006). When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes. Journal of Experimental Biology. 209, 1791-1802;
- L. Bargelloni, S. Marcato, T. Patarnello. (1998). Antarctic fish hemoglobins: Evidence for adaptive evolution at subzero temperature. Proceedings of the National Academy of Sciences. 95, 8670-8675;
- Daniela Giordano, Ignacio Boron, Stefania Abbruzzetti, Wendy Van Leuven, Francesco P. Nicoletti, et. al.. (2012). Biophysical Characterisation of Neuroglobin of the Icefish, a Natural Knockout for Hemoglobin and Myoglobin. Comparison with Human Neuroglobin. PLoS ONE. 7, e44508;
- M. R. Urschel, K. M. O’Brien. (2008). High mitochondrial densities in the hearts of Antarctic icefishes are maintained by an increase in mitochondrial size rather than mitochondrial biogenesis. Journal of Experimental Biology. 211, 2638-2646;
- F. Garofalo, D. Pellegrino, D. Amelio, B. Tota. (2009). The Antarctic hemoglobinless icefish, fifty five years later: A unique cardiocirculatory interplay of disaptation and phenotypic plasticity. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 154, 10-28;
- S. Austin, J. St-Pierre. (2012). PGC1 and mitochondrial metabolism – emerging concepts and relevance in ageing and neurodegenerative disorders. Journal of Cell Science. 125, 4963-4971.
