Полипептидные цепи в молекуле гемоглобина

ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 3. ПЕРЕНОСЧИКИ КИСЛОРОДА—МИОГЛОБИН И ГЕМОГЛОБИН
3.11. Гемоглобин состоит из четырех полипептидных цепей
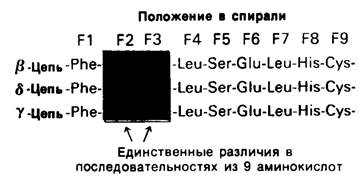
Обратимся теперь к гемоглобину-белку, родственному миоглобину. Если миоглобин состоит из одной полипептидной цепи, то гемоглобин-из четырех. Эти четыре цепи удерживаются вместе нековалентными связями. Каждая цепь содержит один гем, и, таким образом, в молекуле гемоглобина имеются четыре участка связывания кислорода. Гемоглобин А-основной гемоглобин взрослого организма-состоит из двух цепей одного типа, называемых а-цепи, и двух цепей другого типа, называемых β-цепи. В целом субъединичная структура гемоглобина А описывается формулой α2β2. У взрослых есть, кроме того, минорный гемоглобин А2, на долю которого приходится примерно 2% общего количества гемоглобина; субъединичная структура этого гемоглобина α2δ2. Эмбрионы содержат другие гемоглобины. На ранних этапах эмбрионального развития выявляется гемоглобин плода α2ε2. На смену ему приходит гемоглобин F с субъединичной структурой а2у2. Биологическое значение этих разных гемоглобинов представляет собой очень интересную проблему, которую мы обсудим в следующей главе. Общая для всех перечисленных гемоглобинов α-цепь содержит 141 аминокислотный остаток, β, δ и γ-Цепи содержат по 146 остатков с очень схожей последовательностью аминокислот (рис. 3.23).
Рис. 3.23. β-, γ- и δ-Цепи гемоглобинов человека обладают сходными аминокислотными последовательностями. Для примера показаны участки трех цепей с остатками от F1 до F9
3.12. Рентгеноструктурный анализ гемоглобина
Как упоминалось ранее, пространственную структуру гемоглобина А определили Макс Перутц и сотрудники. Этот монументальный труд был начат в 1936 г., когда для выполнения дипломной работы Перутц уехал из Австрии в Англию в Кембридж и начал работать в лаборатории Джона Бернала (J. Bemal), где двумя годами ранее были получены первые рентгеновские отпечатки кристаллов белка. Бернал и студентка- дипломница Дороти Кродфут Ходжкин (D. С. Hodgkin) получили отличные отпечатки дифракции пепсина и таким образом показали, что белкам свойственна точно определенная структура. Еще в 1934 г. они предсказали перспективность применения рентгеноструктурного анализа как метода, «позволяющего получить гораздо более подробные сведения о белковой структуре по сравнению с тем, что могли дать предшествовавшие физические и химические подходы». Прошло, однако, более 20 лет, прежде чем этот прогноз оправдался. В тот период, когда Перутц избрал объектом своей работы гемоглобин, самым высокомолекулярным соединением с расшифрованной структурой был краситель фталоцианин, состоящий из 58 атомов. Перутц же взялся за молекулу в сотни раз большую. Не удивительно, что «мои товарищи смотрели на меня с жалостливой улыбкой… По счастью, экзаменаторы, принимавшие мою дипломную работу, не настаивали на окончательном установлении структуры, иначе бы я оставался студентом-дипломником в течение 23 лет». Однако Лоуренс Брэгг (L. Bragg), который вместе со своим отцом впервые в 1912 г. применил рентгеноструктурный анализ, стал в это время во главе Кавендишской лаборатории и поддержал работу Перутца. Он писал: «Я не обманывал себя в отношении перспективы. Дело выглядело так, как если бы нулевую вероятность успеха помножили на бесконечную важность искомого результата; результат этой математической операции был никому не известен». Успех пришел в 1959 г., когда Перутц получил карту электронной плотности низкого разрешения для оксигемоглобина лошади. Впоследствии были получены карты высокого разрешения как для окси-, так и дезоксигемоглобина лошади и человека. Гемоглобины этих двух видов очень близки по своей структуре.
3.13. Четвертичная структура гемоглобина
Молекула гемоглобина имеет почти правильную форму шара диаметром 55 А. Четыре цепи, образующие молекулу гемоглобина, расположены в виде тетраэдра (рис. 3.24). Четыре гема, по одному у каждой субъединицы, находятся в углублениях на внешней стороне молекулы. Эти четыре кислородсвязывающих участка расположены далеко друг от друга: расстояние между двумя ближайшими атомами железа составляет 25 А. Каждая α-цепь контактирует с обеими β-цепями. В то же время взаимодействия между двумя а- или между двумя β-цепями незначительны.
Рис. 3.24. Модель гемоглобина при низком разрешении. α-Цепь показана желтым, β-цепь-синим, гем-красным

3.14. α- и β-Цепи гемоглобина очень сходны с миоглобнном
Пространственные структуры миоглобина и α- и β-цепей гемоглобина обладают поразительным сходством (рис. 3.25). Близкое подобие в конфигурации основных цепей этих белков оказалось неожиданным, поскольку в последовательности аминокислотных остатков в этих трех полипептидных цепях существует много различий. Собственно, только 24 положения из 141 идентичны во всех трех полипептидных цепях; это показывает, что очень сходные пространственные структуры могут быть обусловлены совершенно разной последовательностью аминокислот (рис. 3.26).
Рис. 3.25. Сравнение конформаций главной цепи миоглобина и (3-цепи гемоглобина. Сходство конформаций совершенно очевидно

Рис. 3.26. Сравнение аминокислотных последовательностей миоглобина кашалота и α- и β-цепей гемоглобина человека на примере участка от остатка F1 от остатка F9. Последовательности аминокислот имеют гораздо меньше сходства, чем пространственные структуры этих трех полипептидных цепей

Совершенно очевидно, что пространственная конфигурация миоглобина кашалота и α- и β-цепей гемоглобина человека имеет общебиологическое значение. В сущности, эта структура свойственна всем миоглобинам и гемоглобинам позвоночных. Сложная конфигурация полипептидной цепи, впервые выявленная на примере миоглобина, это та основная форма, которую природа предназначила для переносчика кислорода: смысл ее в том, что вокруг гема создается такое микроокружение, которое обеспечивает обратимость связывания кислорода.
Гемоглобин (НЬ) – сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
В мышцах внутриклеточный транспорт и кратковременное депонирование кислорода осуществляет другой белок – миоглобин (Mb). Он не является олигомером, так как состоит только из одной полипептидной цепи, конформация которой очень похожа на пространственную структуру β-цепи гемоглобина (рис. 1.20). Большую часть молекулы
Рис. 1.20. Структура миоглобина иβ-цепи гемоглобина
А– миоглобин; Б– β-цепь гемоглобина
Mb и протомеров Hb составляют 8 α-спиральных участков, образующих глобулу с гидрофобным углублением, в котором находится центр связывания с кислородом (активный центр).При этом полипептидные цепи миоглобина и протомеров гемоглобина идентичны всего на 20%.
Оба белка являются холопротеинами, простетическая группа – гем, который находится в активном центре и участвует во взаимодействии с кислородом (рис. 1.21). Гем (ферропротопорфирин) представляет собой органическое соединение с плоской молекулой, включающей 4 пиррольных цикла и ион железа Fe2+. Он является окрашенным соединением и придает красный цвет гемоглобину, эритроцитам (красные кровяные тельца) и крови.
Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а также к радикалу гистидина с помощью атома Fe. Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема (рис. 1.22). В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Рис. 1.21. Строение гемоглобина и гема
А– гемоглобин– сложный белок, олигомер, состоит из 2 α- и 2 β-субъединиц глобина, каждая имеет центр связывания, где располагается небелковая часть молекулы – гем. Он участвует в присоединении молекулы кислорода. Между протомерами образуется аллостерический центр для присоединения регуляторного лиганда гемоглобина 2,3-бисфосфоглицерата;
Б– гем– простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. В центре молеку-
2+
лы расположен ион железа (Fe ), который образует 6 координационных связей: 4 – с атомами азота пиррольных колец гема, 1 – с азотом радикала гистидина цепей глобина, 1 – с молекулой кислорода. В присоединении О2к гему участвует еще один радикал гистидина цепи глобина
Рис. 1.22. Взаимодействие кислорода с гемом в миоглобине и гемоглобине
Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр:
Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода
ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих.
Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями. Они характерны для всех олигомерных белков и используются для регуляции их активности.
Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24).
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях.
График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию – обратимое связывание с
Рис. 1.23. Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом
А– при взаимодействии молекулы дезоксигемоглобина НЬ с О2 происходят кооперативные конформационные изменения, которые сопровождают присоединение каждой последующей молекулы кислорода; Б– в результате изменения конформации активного центра возрастает сродство НЬ к кислороду, 4-я молекула кислорода присоединяется к оксигенированному гемоглобину [НЬ(О2)3] в 300 раз легче, чем 1-я
Рис. 1.24. Кривые насыщения миоглобина и гемоглобина кислородом
кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Изменение сродства гемоглобина к О2 обеспечивает быстрое насыщение крови кислородом в легких, а также освобождение и передачу его в ткани. Миоглобин обладает более высоким сродством к О2, поэтому связывает и передает в митохондрии клеток кислород, транспортируемый НЬ в мышцы.
Гемоглобин доставляет в сутки до 600 л (850 г) О2 в ткани и способствует удалению из них ~ 500 л (1000 г) СО2. Движущей силой этих потоков является градиент концентраций О2 между альвеолярным воздухом и межклеточной жидкостью. Парциальное давление О2 в альвеолярном воздухе составляет 100 мм рт.ст. Парциальное давление О2
в тканях намного ниже (~ 40 мм рт.ст.), что обусловлено поступлением и использованием кислорода митохондриями клеток, где он превращается в Н2О. Таким образом О2 поглощается клетками.
Обмен О2 и СО2 происходит в капиллярах: в легких О2 переходит из альвеолярного воздуха в эритроциты, а СО2 – в обратном направлении; в капиллярах тканей О2 из эритроцитов перемещается в клетки тканей, а СО2 – в обратном направлении (рис. 1.25).
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы – аллостерическими лигандами. Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Молекула гемоглобина способна связываться с несколькими лигандами: О2, Н+, СО2, 2,3-бис- фосфоглицератом (БФГ). Н+, СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра.
Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц.
Рис. 1.25. Перенос кислорода и диоксида углерода гемоглобином. Эффект Бора
БФГ образуется из глюкозы в эритроцитах и является одним из регуляторов работы гемоглобина. Его молярная концентрация в крови близка к молярной концентрации НЬ. В центре молекулы гемоглобина полипептидные цепи 4 протомеров образуют полость (аллостерический центр), причем величина ее увеличивается в дезоксигемоглобине и уменьшается в оксигемоглобине. БФГ поступает в полость дезоксигемоглобина, связываясь с положительно заряженными группами на β-протомере (рис. 1.26). При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2.
Рис. 1.26. Связывание БФГ с дезоксигемоглобином
Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию НЬ и освобождению БФГ.
Содержание БФГ в крови человека соответствует содержанию гемоглобина и повышается при понижении содержания кислорода в воздухе (гипоксии) или затруднении дыхания при заболеваниях легких. Понижение его концентрации ухудшает снабжение тканей кислородом.
Это важно учитывать при переливании крови и сохранять необходимую концентрацию БФГ при консервации. Переливание донорской крови с пониженным содержанием БФГ может привести к гипоксии и гибели больных.
В регуляции работы гемоглобина основная роль принадлежит протонам Н+. • В ткани НЬ поступает преимущественно в виде НЬ(О2)4. Но при низком парциальном давлении О2 происходит отщепление части кислорода. Увеличение содержания не полностью оксигенированных форм НЬ облегчает высвобождение О2.
В мышцах образуется много СО2, который под действием карбоангидразы превращается в угольную кислоту Н2СО3, диссоциирующую на Н+ и бикарбонат-ион:
СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Повышение концентрации Н+ вызывает протонирование ионогенных групп НЬ, что приводит к снижению его сродства к О2:
Н+ + НЬ О2 → Н+ НЬ + О2
Далее с дезоксигемоглобином взаимодействует
БФГ:
В легкие поступает кровь с высоким содержанием дезоксигемоглобина, протонированного, связанного с БФГ или СО2. В такой форме гемоглобин имеет пониженное сродство к О2.
Из капилляров диффундирует СО2, освобождающийся в результате реакции:
Н+ + НСО-3 → Н2СО3 → СО2 + Н2О
Это стимулирует депротонирование гемоглобина:
Н+ НЬ → Н+ + НЬ
Высокое парциальное давление О2 приводит к оксигенированию НЬ, при этом вытесняется БФГ:
НЬ БФГ → НЬ + БФГ
Частичное оксигенирование гемоглобина повышает его сродство к кислороду, все реакции, приведенные выше, происходят в обратном порядке.
Зависимость сродства гемоглобина к кислороду от концентрации ионов водорода (Н+) получила название эффекта Бора по имени датского физиолога, изучавшего функционирование гемоглобина (см. рис. 1.25).
Таким образом, количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается.

Видовые различия гемоглобина обусловлены химическим составом и строением глобина. Гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей, Глобин состоит из 4 полипептидных цепей. На сегодняшний день известно 5 полипептидных цепей, формирующих молекулу гемоглобина (альфа, бетта, гамма, дельта, эпсилон) при скрещении цепей образуются различные физиологические гемоглобины.
Общая формула глобина X2Y2, где Х – альфа цепь,Y одна из оставшихся 4 – х.
В состав молекулы входят по 2 полипептидные цепи двух разных типов, каждая из которых оборачивает 1 гем гемоглобина. Гемоглобины различных видов различаются вторичной, третичной и четвертичной структурами, и индивидуальные свойства гемоглобинов неразрывно связаны с их структурами. Известно, что гемоглобин человека состоит из двух равных половин, каждая из которых образована двумя одинаковыми полипептидными цепями. У человека обнаружены гемоглобины различных типов, которые отличаются по химическому строению. отличающийся от HbA вторичной, третичной и четвертичной структурами, что обусловливает их различия: по спектральным характеристикам, электрофоретической подвижности, устойчивости к тепловой денатурации и др. В крови новорожденного ребенка содержится ~ 80% HbF, который к концу первого года жизни почти целиком заменяется на HbA (в крови взрослого человека содержится до ~ 1,5% HbF от общего количества гемоглобина).
Физиологические гемоглобины:
Первый гемоглобин – зародышевый в 3 месяца сменяется на плодный или фетальный гемоглобин НвF (он состоит из альфа2 + гамма2 цепей – a2g2), который присутствует в период эмбриогенеза, и полностью замещается гемоглобином взрослого к концу 1 – го года жизни. Гемоглобин взрослого – А1 и А2, начинают синтезироваться в плодный период и после 1- го года жизни процент HbА1 составляет 97 – 98% – основной компонент эритроцитов взрослого, он состоит из альфа2 + бетта2 цепей (a2b2 ).
2-3% – гемоглобин А2, процент НвF к концу 1-го года – не более 1%.
Фетальный гемоглобин по сравнению с гемоглобином взрослого обладает более высоким сродством к кислороду, т.к. фетальный гемоглобин связывает 2,3-дифосфоглицерат труднее, чем НвА.
Растворы гемоглобина окрашены в темно-красный цвет и имеют характерные спектры поглощения в ультрафиолетовой и видимой областях спектра. Изоэлектрическая точка гемоглобина ~ 7. В кислой и щелочной среде гемоглобин легко денатурируется, скорость денатурации различна у различных видов гемоглобинов.
Синтез гемоглобина
Функция гемоглобина требует наличия обоих компонентов гема и глобина. Синтез гемоглобина осуществляется 2 путями – синтез гема и глобина. Затем эти составные объединяются и составляют молекулу гемоглобина. Синтез гемоглобина начинается в митохондриях с конденсации молекул: глицина и сукцинил – КоА, конечным продуктом конденсации этих молекул является дельта – аминолевулиновая кислота, далее конденсация 2- х молекул аминолевулиновой кислоты образует пироловое кольцо, которое подвергаясь действию аминолевулинатдегидрогеназы переходит в порфобилиноген, конденсация 4 – х колец которого даёт образование уропорфириногена, эта реакция катализируется комплексом 2 – х ферментов. Уропорфириногенсинтетаза –I катализирует конденсацию и дезаминирование порфобилиногена в уропорфириноген I, эта реакция активна при некоторых видах порфирий. В нормальных условиях работает, почти исключительно, уропорфириноген-III-косинтетаза при этом образуется уропорфириноген III, который при декарбоксилировании образует копропорфириноген. Копропорфириноген подвергаясь процессам декарбосилирования превращается в протопорфириноген III, далее под воздействием оксидазы образуется протопорфирин 9. Завершающей стадией является включение в протопорфирин 2 – х валентного железа, эта реакция катализируется митохондриальным ферментом гем – синтетаза или ферро-хелатаза (однако эта реакция хорошо идёт и без ферментов). Биосинтез гемма идёт в большинстве тканей млекопитающих, за исключением зрелых эритроцитов, которые не содержат митохондрий. Преимущественныи местом синтеза является печень, т.к. именно в печени протекает основной метаболизм порфиринов. Все порфобилиногены бесцветны, тогда как порфирины – имеют окраску.
Регуляция синтеза гема
Скорость – лимитирующей реакцией синтеза гема является конденсация сукцинил-КоА и глицина, приводящая к образованию амино – левуленовой кислоты. Т.О. основным регуляторным ферментом является АЛК – синтетаза.
1. Гем является аллостерическим ингибитором АЛК – синтетазы, по принципу обратной связи.
2. Гем является корепрессором синтеза самого фермента АЛК – синтетазы.
3. Железо регулирует синтез этого фермента на этапе трансляции.
Механизм: На матричной РНК, кодирующей АЛК – синтетазу имеется определённая последовательность нуклеотидов, которая называется железо – чувствительным элементом. Этот участок связывается с регуляторным железо-связывающим белком, который ингибирует процесс трансляции. При высоких концентрациях железа в клетках, оно образует комплекс с регуляторным железосвязывающим белком и снижает сродство этого белка к железочувствительному элементу мРНК, тем самым, активируя трансляцию АЛК – синтетазы. При низких концентрациях железо не связывается с регуляторным белком и трансляция тормозится.
На индукцию АЛК – синтетазы в печени оказывают действие и другие факторы: при приёме лекарственных средств, метаболизм которых происходит в печени при участии цитохрома Р450, возрастает потребность в геме за счёт повышенного расхода, соответственно активируется АЛК – синтетаза. Глюкоза может тормозить индукцию АЛК – синтетазы. Гипоксия способствует повышению активности АЛК – синтетазы в клетках костного мозга, а в печени не изменяет активность этого фермента.
Дата добавления: 2016-10-23; просмотров: 1322 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
