Полоса соре у гемоглобина
вещество, образующееся в случае, когда присутствующие в пигменте крови гемоглобине атомы железа окисляются с образованием окиси железа (для сравнения: оксигемоглобин). Метгемоглобин не может соединяться с молекулярным кислородом и, следовательно, не может переносить кислород в организме. Наличие метгемоглобина в крови (метгемоглобинемия (methaemoglobinaemia)) может быть связано с приемом кислородосодержащих лекарственных веществ или с каким-либо наследственным нарушением состава молекулы гемоглобина. Симптомами метгемоглобинемии являются повышенная утомляемость, головная боль, головокружение и цианоз. [ https://mirslovarei.com]
Спектральные свойства оксигемоглобина (рис.1) характеризуются наличием двух полос поглощения в желто-зеленой части видимого спектра, одна из которых, лежащая ближе к красной области спектра, обозначается как -полоса; другая, с более короткой длиной волны, более широкая и с менее резкими краями,- как полоса . В фиолетовой части спектра лежит весьма интенсивная полоса поглощения, обозначаемая как -полоса (или полоса Соре). Максимум -полосы поглощения HbO2 находится в области длин волн 575-579 нм, максимум -полосы приходится на 540-544 нм. -полоса имеет максимум в интервале 410-416 нм. Между – и -полосой находится минимум при 560 нм. -, – и -полосы характерны для группы гема. Считается, что -полоса обусловлена порфирином простетической группы.
В ближней инфракрасной области спектра оксигемоглобин имеет широкую малоинтенсивную полосу поглощения около 925 – 930 нм (рис.2). В ультрафиолетовой области наблюдаются две полосы поглощения. ‘-полоса (343-360 нм) обусловлена связанным железом. Максимум -полосы, обусловленной белковой частью молекулы гемоглобина, находится при 275 – 280 нм.
Вместо и -полос в спектре поглощения деоксигемоглобина имеется одна, более широкая и менее интенсивная полоса в области 555-560 нм. Кривая поглощения асимметрична и имеет отчетливый перегиб при 585-590 нм. В красной области спектра наблюдается слабая полоса с максимумом при 760 нм. Максимум широкой и интенсивной -полосы находится на длине волны: 425 – 431 нм. В области 620-680 нм деоксигемоглобин поглощает свет во много раз сильнее, чем оксигемоглобин. В ближней инфракрасной области спектра деоксигемоглобин имеет полосу с максимумом при 910 нм.
Спектральные свойства метгемоглобина зависят от рН среды. При рН-7 метгемоглобин находится в кислой форме. Спектр поглощения характеризуется узкой полосой с максимумом при 500 нм, широкой – в области 630 нм и интенсивной полосой Соре в интервале 405-407 нм. В области 540-570 нм имеются два перегиба кривой поглощения. При рН 7.4 20% всего метгемоглобина составляет щелочной метгемоглобин. При увеличении рН спектр постепенно меняется: исчезает полоса с максимумом при 630 нм, заменяясь неотчетливым перегибом при 600 нм, в желто-зеленой области появляются две полосы поглощения с максимумами на 577 и 540 нм.
Максимум полосы Соре смещается к 411 нм. Щелочные растворы метгемоглобина имеют максимумы при 417, 540 и 578 нм, положение которых незначительно отличается от оксигемоглобиновых, но их интенсивность значительно ниже. После рН 9.4 увеличение рН приводит к исчезновению полос с максимумами при 577 нм и 540 нм.
Рисунок1. Спектральная зависимость молярного коэффициента поглощения
гемоглобина. Шкала линейная. : 1 – оксигенированная форма, 2 –
деоксигенированная.
Рисунок2. Спектральная зависимость молярного коэффициента поглощения
гемоглобина. Шкала логарифмическая: 1 – оксигенированная форма, 2-
деоксигенированная.
Важным для практики является свойство гемоглобина изменять свое сродство с кислородом в зависимости от температуры, рС02 и рН крови, а также от давности хранения консервированной крови (Laver, Sei-fen, 1964). Снижение температуры, рС02 и возрастание рН увеличивают химическое сродство гемоглобина с кислородом, что графически выражается в смещении кривой диссоциации оксигемоглобина влево (см. рис. 3). Сродство гемоглобина к кислороду повышается, то процесс идет в сторону образования оксигемоглобина и график диссоциации смещается влево. Это наблюдается при снижении напряжения углекислого газа при понижении температуры, при сдвиге рН в щелочную сторону.
При снижении сродства гемоглобина к кислороду процесс идет больше в сторону диссоциации оксигемоглобина, при этом график диссоциации смещается вправо. Это наблюдается при повышении парциального давления углекислого газа, при повышении температуры, при смещении рН в кислую сторону.
Газы в крови находятся в двух состояниях: физически растворенном и химически связанном. Растворение происходит в соответствии с законом Генри, согласно которому количество газа, растворенного в жидкости, прямо пропорционально парциальному давлению этого газа над жидкостью. На каждую единицу парциального давления в 100 мл крови растворяется 0,003 мл О2 или 3 мл/л крови.
Каждый газ имеет свой коэффициент растворимости. При температуре тела растворимость СО2 в 25 раз больше, чем О2.
Из-за хорошей растворимости углекислоты в крови и тканях СО2 переносится в 20 раз легче, чем О2. Стремление газа переходить из жидкости в газовую фазу называют напряжением газа. В обычных условиях в 100 мл крови находится в растворенном состоянии всего 0,3 мл О2 и 2,6 мл СО2. Такие величины не могут обеспечить запросы организма в О2.
Газообмен кислорода между альвеолярным воздухом и кровью происходит благодаря наличию концентрационного градиента О2 между этими средами. Транспорт кислорода начинается в капиллярах легких, где основная масса поступающего в кровь О2 вступает в химическую связь с гемоглобином. Гемоглобин способен избирательно связывать О2 и образовывать оксигемоглобин (НрО2). Один грамм гемоглобина связывает 1,36 – 1,34 мл О2, а в 1 литре крови содержится 140-150 г гемоглобина. На 1 грамм гемоглобина приходится 1,39 мл кислорода. Следовательно, в каждом литре крови максимально возможное содержание кислорода в химически связанной форме составит 190 – 200 мл О2 или 19 об% – это кислородная емкость крови. Кровь человека содержит примерно 700 – 800 г гемоглобина и может связывать 1 л кислорода.
В обычных УСЛОВИЯХ насыщение О2 составляет 95-97%. При дыхании чистым кислородом насыщение крови О2 достигает 100%, а при дыхании газовой смесью с низким содержанием кислорода процент насыщения падает. При 60-65% наступает потеря сознания.
Зависимость связывания кислорода кровью от его парциального давления можно представить в виде графика, где по оси абсцисс откладывается р02 в крови, по ординате – насыщение гемоглобина кислородом.
Рис. 3. Кривые диссоциации оксигемоглобина цельной крови при различных рН крови [А] и при изменении температуры (5)
Кривые 1-6 соответствуют 0°, 10°, 20°, 30°, 38° и 43°С (увеличить)
Этот график – кривая диссоциации оксигемоглобина, или сатурационная кривая, показывает, какая доля гемоглобина в данной крови связана с О2 при том или ином его парциальном давлении, а какая – диссоциирована, т.е. свободна от кислорода. Кривая диссоциации имеет S-образную форму. Плато кривой характерно для насыщенной О2 (сатурированной) артериальной крови, а крутая нисходящая часть кривой – венозной, или десатурированной, крови в тканях (рис. 1).
Сродство кислорода к гемоглобину и способность отдавать О2 в тканях зависит от метаболических потребностей клеток организма и регулируется важнейшими факторами метаболизма тканей, вызывающими смещение кривой диссоциации. К этим факторам относятся: концентрация водородных ионов, температура, парциальное напряжение углекислоты и соединение, которое накапливается в эритроцитах – это 2,3-дифосфоглицератфосфат (ДФГ). Уменьшение рН крови вызывает сдвиг кривой диссоциации вправо, а увеличение рН крови – сдвиг кривой влево. Вследствие повышенного содержания СО2 в тканях рН также меньше, чем в плазме крови. Величина рН и содержание СО2 в тканях организма изменяют сродство гемоглобина к О2. Их влияние на кривую диссоциации оксигемоглобина называется эффектом Бора (Х. Бор, 1904). При повышении концентрации водородных ионов и парциального напряжения СО2 в среде сродство гемоглобина к кислороду снижается. Этот “эффект” имеет важное приспособительное значение: СО2 в тканях поступает в капилляры, поэтому кровь при том же рО2 способна освободить больше кислорода. Образующийся при расщеплении глюкозы метаболит 2,3-ДФГ также снижает сродство гемоглобина к кислороду.
На кривую диссоциации оксигемоглобина оказывает влияние также и температура. Рост температуры значительно увеличивает скорость распада оксигемоглобина и уменьшает сродство гемоглобина к О2. Увеличение температуры в работающих мышцах способствует освобождению О2. Связывание О2 гемоглобином снижает сродство его аминогрупп к СО2 (эффект Холдена).
От парциального напряжения физически растворенного углекислого газа зависит процесс связывания СО2 кровью. Углекислота поступает в эритроцит, где имеется фермент карбоангидраза, который может в 10 000 раз увеличить скорость образования угольной кислоты. Пройдя через эритроцит, угольная кислота превращается в бикарбонат и переносится к легким.
Различные яды, ограничивающие транспорт О2, такие как СО, нитриты, ферроцианиды и многие другие, практически не действуют на транспорт СО2 Блокаторы карбоангидразы также никогда полностью не нарушают образование молекулярного СО2. И наконец, ткани обладают большой буферной емкостью, но не защищены от дефицита О2. Выведение СО2 легкими может нарушиться при значительном уменьшении легочной вентиляции (гиповентиляции) в результате заболевания легких, дыхательных путей, интоксикации или нарушении регуляции дыхания. Задержка СО2 приводит к дыхательному ацидозу – уменьшению концентрации бикарбонатов, сдвигу рН крови в кислую сторону. Избыточное выведение СО2 при гипервентиляции во время интенсивной мышечной работы, при восхождении на большие высоты может вызвать дыхательный алкалоз, сдвиг рН крови в щелочную сторону. [https://www.medicinform.net/human/fisiology2_2.htm]
Применение на практике
Спектрометрический метод используют для обнаружения оксида углерода (II) в крови.
В крови лиц, отравленных оксидом углерода (II), не весь гемоглобин превращается в карбоксигемоглобин. Смерть наступает значительно раньше, чем достигается полное превращение оксигемоглобина в карбоксигемоглобин.
Карбоксигемоглобин можно обнаружить в крови спектроскопом, который является прибором для визуального спектрального определения ряда веществ, в том числе и карбоксигемоглобина.
При рассматривании крови спектроскопом наблюдаются линии и полосы, позволяющие сделать вывод о наличии или отсутствии карбоксигемоглобина.
Подлежащую исследованию кровь разбавляют водой до тех пор, пока не будет получен раствор, имеющий светло-розовую окраску. При спектроскопическом исследовании этого раствора четко видны соответствующие спектральные полосы.
Спектр оксигемоглобина крови OHb имеет две полосы поглощения между линиями Фраунгофера D и Ε при длинах волн 577—589 и 536—556 нм. Спектр карбоксигемоглобина COHb имеет две полосы поглощения при длинах волн 564—579 и 523— 536 нм. Смещается влево.
После прибавления одного объема свежеприготовленного раствора сульфида аммония (NH 4 ) 2 S или других восстановителей (дитионит натрия Na 2 S 2 O 4 ·2H 2 O и др.) к четырем объемам водного раствора исследуемой крови оксигемоглобин (OHb) превращается в дезоксигемоглобин Hb, в спектре которого имеется одна широкая полоса поглощения при 543—596 нм. Карбоксигемоглобин не восстанавливается сульфидом аммония и другими восстановителями. Поэтому после прибавления восстановителей полосы поглощения карбоксигемоглобина не исчезают.
Таким образом, после прибавления раствора сульфида аммония к крови, содержащей окси- и карбоксигемоглобин, сохраняются две полосы поглощения карбоксигемоглобина, но исчезают полосы поглощения оксигемоглобина, а вместо них появляется широкая полоса поглощения дезоксигемоглобина. По наличию соответствующих полос поглощения в спектре крови делают вывод об отравлении оксидом углерода (II).
Спектральный метод оправдывает себя при исследовании крови, содержащей 10-30 % карбоксигемоглобина.
Практическая часть
Порядок выполнения работы
1. Приготовить раствор оксигемоглобина в концентрации моль/л.
2. Снять спектр поглощения исследуемого образца.
3. Настроить термостат на необходимую температуру и поместить в него раствор гемоглобина (воспользоваться одним из способов ниже).
4. Снять спектр поглощения до и после нагрева.
5.Сделать вывод об оптических свойствах растворов гемоглобина, модифицированных воздействием различных температур.
Варианты термостатирования:
1.раствор термостатировать при 35,45,55 градусах в течение 20 мин.
2.раствор термостатировать при 40 градусах в течение 10,15,30,45 мин.
3.раствор термостатировать при 50 градусах в течение 5,10,15,20 мин.
Контрольные вопросы:
1. Как отличаются гемоглобин, оксигемоглобин и метгемоглобин в зеленой области спектра и полосе Соре?
2.Изобразите графики поглощения гемоглобина, оксигемоглобина и метгемоглобина.
3.От чего зависит сродство кислорода к гемоглобину и способность отдавать О2?
4.Как используют спектрометрический метод для обнаружения оксида углерода (II) в крови?
5.Как влияет рн среды на спектральные свойства метгемоглобина?
6.Как влияет парциальное давление и температура на кривую диссоциации оксигемоглобина?
Лабораторная работа №22
Изучение оптических свойств
различных форм гемоглобина
Каждая форма гемоглобина
характеризуется определенным спектром поглощения, представляющим собой зависимость
оптической плотности раствора гемоглобина от длины волны света. Наиболее
интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая
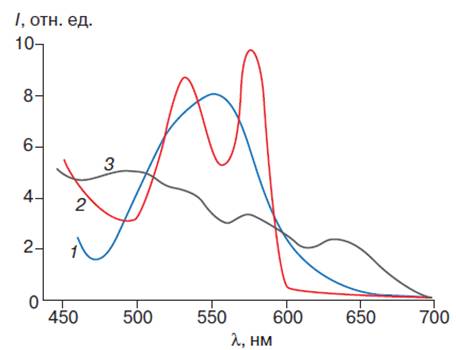
порфириновой части его молекулы (рис. 5).

Рис. 5. Спектр поглощения
производных гемоглобина. Спектры поглощения дезоксигемоглобина (1),
оксигемоглобина (2) и ферригемоглобина (3)
По изменению положения и
интенсивности поглощения этой полосы можно судить о структурных изменениях
молекул различных форм гемоглобина (табл. 22).
Таблица 22
Спектральные характеристики различных форм
гемоглобина
Формы гемоглобина | α-Полоса | β-Полоса | Полоса | |||
λ, | ελ, | λ, | ελ, | λ, | ελ, | |
Оксигемоглобин | 557 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоголобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Оборудование
и материалы. СФ-(46) или другой спектрофотометр,
центрифуга на 9000 об/мин, центрифужные пробирки, кюветы, пенициллиновые
флаконы, пипетки Пастера, прибор для получения оксида углерода, гемоглобин кристаллический,
хлористый натрий, гепарин, бихромат калия, феррицианид калия, дитионит натрия.
Получение
раствора оксигемоглобина. Для работы рекомендуется использовать
свежеприготовленные растворы гемоглобина. Кровь берут у декапитированных животных.
Цельную кровь стабилизируют гепарином, растворенным в 0,85%-ном растворе
хлористого натрия. Для отделения плазмы стабилизированную кровь центрифугируйте
в течение 10 мин при 3000 об/мин. Плазму крови отберите пипеткой. К эритроцитам
добавьте трехкратный объем 0,85%-ного раствора хлористого натрия, осторожно при
этом размешивая суспензию стеклянной палочкой. Суспензию центрифугируйте в течение
5 мин при 6000 об/мин. Промойте эритроциты 3 раза. Промытые эритроциты
подвергните гемолизу дистиллированной водой в течение 20 мин. Стромы осадите центрифугированием
при 9000 об/мин в течение 15 мин. В прозрачном гемолизате определите содержание
гемоглобина с помощью приведенного в работе № 20 метода.
Ход
анализа
Регистрация
спектра поглощения оксигемоглобина. Раствор
оксигемоглобина разбавьте дистиллированной водой до оптической плотности
раствора, попадающей в диапазон 0,4-0,5. Снимите спектр поглощения раствора
оксигемоглобина в интервале длин волн 380-600 нм (оптическая плотность раствора
измеряется через каждые 5 нм).
Регистрация
спектра поглощения метгемоглобина. Добавьте к раствору
оксигемоглобина 1-2 капли насыщенного раствора феррицианида калия. Визуально
оцените изменение окраски. Раствор метгемоглобина имеет коричневую окраску.
Снимите спектр поглощения раствора гемоглобина в интервале длин волн 380-600
нм. Для компенсации светопоглощения за счет феррицианида в контроль добавьте
такой же объем раствора этого вещества, какой был добавлен к раствору
оксигемоглобина.
Регистрация
спектра поглощения метгемоглобина. Добавьте к водному
раствору оксигемоглобина несколько кристаллов дитионита натрия (Na2S2O4).
Визуально оцените изменение окраски. Ярко алая окраска (цвет оксигемоглобина)
переходит в синевато-красную, характерную для гемоглобина. Снимите спектр
поглощения раствора в интервале длин волн 380-600 нм.
ЗАДАНИЕ
1. Представьте в графическом виде
зависимость оптической плотности различных состояний гемоглобина от длины
поглощаемого света (спектр поглощения), откладывая по оси ординат оптическую
плотность раствора, а по оси абсцисс соответствующие длины волн.
2. Найдите минимумы и максимумы
поглощения гемоглобинов и сделайте вывод.
Поглощение света и цвет гемоглобина.Цвет растворенного вещества, не испускающего световые лучи, зависит от его способности поглощать падающий свет в той или иной части спектра видимого света. Как правило, каждое вещество поглощает свет лишь в определенной области спектра, тогда как свет других длин волн проходит через это вещество почти беспрепятственно. Цвет раствора вещества определяется спектральным составом прошедшего через него света.
Красный цвет растворов гемоглобина (и, следовательно, крови) обусловлен тем, что это вещество относительно сильно поглощает коротковолновый свет, т. е. в синей области спектра, а большую часть длинноволнового (красного) света пропускает.
При исследовании света, прошедшего через раствор оксигенированного гемоглобина, с помощью спектроскопа можно обнаружить не только полосу поглощения в синей области спектра (полосу Соре), но также две характерные темные полосы (полосы поглощения) в желтой и желто-зеленой областях спектра с максимумами при длинах волн 577 и 541 нм [11].
Дезоксигемоглобин несколько интенсивнее, чем оксигемоглобин, поглощает длинноволновые лучи и менее интенсивно – коротковолновые. В связи с этим венозная кровь выглядит темнее и имеет красный цвет с синеватым оттенком. При спектроскопическом исследовании выявляется одна широкая полоса поглощения в желто-зеленой части спектра с максимумом при длине волны 555 нм.
Спектрфотометрия. Для количественного анализа абсорбционных свойств окрашенного раствора используют спектрофотометры. В этих приборах видимый свет разлагается в спектр при помощи призмы или дифракционной решетки, а затем свет очень узкой области длин волн (так называемый монохроматический свет) проходит через исследуемый раствор. Поглощение света зависит от длины волны и от свойств раствора. Для определения соотношения между интенсивностью падающего (I0) и прошедшего (I) света используется фотоэлемент. Отношение I/I0 называется пропусканием, а отношение (I0 — I)/I0 – поглощением. Полный спектр поглощения раствора получают путем последовательного измерения этих величин для разных длин волн.
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 607
| Рис. 22.4. Спектры поглощения оксигемоглобина (НbО2) и дезоксигемоглобина (Hb). По оси ординат слева-коэффициент поглощения, справа -экстинкция |
Спектры поглощения.На рис. 22.4 изображены спектры поглощения оксигемоглобина ндезоксигемоглобина. Тем участкам спектра, в которых при спектроскопии обнаруживаются темные полосы, соответствуют максимумы на кривой поглощения. Для оксигемоглобина характерны два таких максимума, а для гемоглобина – один, занимающий положение между ними. Из рисунка видно, что эти максимумы приходятся на те же длины волн, что и полосы поглощения.
Точки пересечения обеих кривых поглощения, или так называемые изобестические точки, соответствуют длинам волн, при которых растворы равной концентрации Hb и НbО2 пропускают свет в одинаковой степени. Если длина волны световых лучей соответствует изобестической точке, то поглощение их гемоглобином не зависит от степени его оксигенации. Монохроматический свет такой длины волны используют в тех случаях, когда необходимо определить концентрацию гемоглобина, не подвергая его химическим модификациям (см. ниже). Если же спектрофотометрию используют для измерения насыщения гемоглобина кислородом, то, напротив, выбирают свет с такой длиной волны, при которой разница между коэффициентами поглощения оксигемоглобина и дезоксигемоглобина максимальна, т.е. 600, 577, 470 нм и т. д. (см. рис. 22.4).
Закон Ламберта-Бэра. Вкачестве количественной характеристики поглощения света часто используют также экстинкцию(Е) (на рис. 22.4 отложена по правой оси ординат):
О)
где I0-интенсивность падающего света, а I- интенсивность прошедшего света. Экстинкцию удобно использовать в связи с тем, что она прямо про-
порциональна концентрации растворенного вещества С:
(2)
где d-толщина слоя раствора, а ε – коэффициент экстинкции (величина, постоянная для каждого вещества). Линейная зависимость между экстинкцией, концентрацией и толщиной слоя раствора называется законом Ламберта-Бэра. Этот закон справедлив только для монохроматического света.
Содержание гемоглобина в крови; среднее содержание гемоглобина в эритроците
Нормальные показатели.Содержание гемоглобина в крови человека составляет в среднем 158 г/л (15.8 г/дл) у мужчин и 140 г/л (14 г/дл) у женщин. Как и практически любые биологические показатели, эта величина претерпевает определенные колебания даже у здоровых людей. Пределы колебаний определяют путем построения частотного распределениязначений для большого числа людей (рис. 22.5).
С возрастом содержание гемоглобина в крови заметно меняется. В крови новорожденного оно составляет 200 г/л. причем возможны значительные индивидуальные колебания (рис. 22.5). В течение первого года жизни содержание гемоглобина снижается примерно до 115 г/л, а затем постепенно возрастает до уровня, характерного для взрослых.
Высокое содержание гемоглобина в крови наблюдается не только у плода, но также у лиц, длительное время живущих в условиях высокогорья (с. 714). И в том и в другом случае повышение содержания гемоглобина необходимо для того, чтобы обеспечить нормальное снабжение тканей кислородом при пониженном парциальном давлении этого газа.
Уменьшение содержания гемоглобина по сравнению с нормальным уровнем называется анемией.Как правило, диагноз анемия ставят в том случае, если содержание гемоглобина меньше 130 г/л у мужчин и 120 г/л у женщин.
Измерение содержания гемоглобина.Для измерения содержания гемоглобина существует много методов, в том числе: 1) определение количества связанного О2(1 г Hb может присоединить до 1,36 мл О2); 2) анализ уровня железа в крови (содержание железа в гемоглобине составляет 0,34%); 3) колориметрия (сравнение цвета крови с цветом стандартного раствора); 4) измерение экстинкции (спектрофотометрия). При проведении рутинных определений уровня гемоглобина отдают предпочтение последнему методу, так как при использова-
6C8 ЧАСТЬ VI. ДЫХАНИЕ
нии первых двух способов необходима сложная аппаратура, а метод колориметрии неточен.
Спектрофотометрический анализ. Принцип метода состоит в определении содержания Hb в крови по экстинкции монохроматического света. Поскольку растворенный гемоглобин нестабилен, а экстинкция зависит от степени оксигенации, его необходимо предварительно перевести в стабильную форму.
Спектрофотометрические измерения содержания гемоглобина производят следующим образом. Кровь набирают в капиллярную пипетку и затем смешивают с раствором, содержащим калий железосинеродистый (K3[Fe(CN)6]), цианистый калий (KCN) и бикарбонат натрия (NaHCO3). Под действием этих веществ эритроциты разрушаются, и гемоглобин превращается в цианметгемоглобинHbCN (содержащий трехвалентное железо), способный сохраняться в течение нескольких недель. При спектрофотометрии раствор цианметгемоглобина освещают монохроматическим светом с длиной волны 546 нм и определяют экстинкцию Е. Зная коэффициент экстинкции ε и толщину слоя раствора d, можно, исходя из закона
Ламберта-Бэра [уравнение (2)], определить концентрацию раствора С непосредственно по величине экстинкции Е. Чаще предпочитают, однако, предварительно откалибровать шкалу экстинкции при помощи стандартного раствора. В настоящее время цианметгемоглобиновый метод считается наиболее точным из общепринятых способов измерения содержания гемоглобина [32].
Среднее содержание гемоглобина в эритроците.
Важным диагностическим показателем, позволяющим оценить эритропоэз и провести дифференциальную диагностику различных форм анемии, служит среднее содержание гемоглобина в одном эритроците (СГЭ) (по международной классификации-mean corpuscular hemoglobin, MCH). Эта величина отражает абсолютное количество гемоглобина, содержащееся в среднем в одном эритроците. Ее находят путем деления количества гемоглобина в определенном объеме крови на число эритроцитов в том же объеме.
Приведем пример расчета СГЭ. У здорового мужчины в 1 л крови содержится 158 г Hb и 5,1 млн ∙ 106 эритроцитов (1 л = 106 мкл). СГЭ равно отношению этих величин:
Такая же величина СГЭ характерна и для здоровых женшин:
Эритроциты с нормальным содержанием гемоглобина (26-36 пг) называют нормохромнымн. Если СГЭ патологически снижено, то эритроциты называют гипохромными, а если оно повышено – гиперхромными. Эти же термины употребляют и для обозначения различных форм анемии. Так, когда образование гемоглобина снижается в результате недостатка железа, содержание гемоглобина в расчете на эритроцит падает, и возникает гипохромная анемия. При других разновидностях анемии (например, пернициозной анемии) нарушается образование красных кровяных телец в костном мозгу, и в крови появляются деформированные эритроциты с высоким содержанием гемоглобина. В этом случае речь идет о гиперхромной анемии. После значительной кровопотери СГЭ сначала не изменяется (нормохромная анемия), а в последующем вследствие избыточной продукции эритроцитов содержание гемоглобина в них падает (гипохромная анемия).
Рекомендуемые страницы:
