Превращение гемоглобина в тканях
Продолжительность
жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается
гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и
распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе
оба процесса могут происходить и в клетках других органов. Распад гемоглобина в
печени начинается с разрыва α-метиновой связи между I и
II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей
ок-сидазой и приводит к образованию зеленого пигмента вердоглобина
(холеглобина):
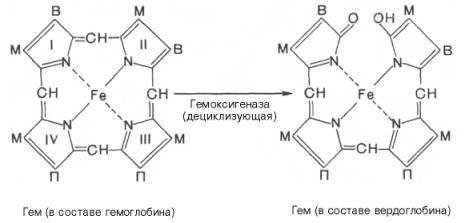
В приведенных
структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа,
В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН)
– остаток пропионовой кислоты.
Как видно из
приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и
белковый компонент. Имеются экспериментальные доказательства, что в этом
окислительном превращении гемоглобина принимают участие витамин С, ионы Fe2+и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит
спонтанно с освобождением железа, белка-глобина и образованием одного из
желчных пигментов – биливердина. Спонтанный распад сопровождается
перераспределением двойных связей и атомов водорода в пиррольных кольцах и
метиновых мостиках. Образовавшийся биливердин ферментативным путем
восстанавливается в печени в билирубин, являющийся основным желчным пигментом у
человека и плотоядных животных:
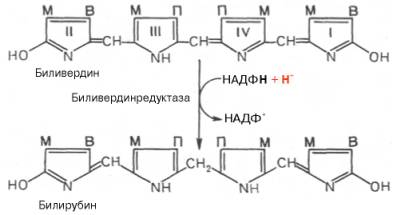
Основное
место образования билирубина – печень, селезенка и, по-видимому, эритроциты
(при распаде их иногда разрывается одна из метиновых связей в протопорфирине).
Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе
с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в
клетках системы макрофагов, называется свободным, или непрямым, билирубином,
поскольку вследствие плохой растворимости в воде он легко адсорбируется на
белках плазмы крови и для его определения в крови необходимо предварительное
осаждение белков спиртом. После этого билирубин вступает во взаимодействие с
диазореактивом Эрлиха.
В крови
взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л.
Около 75% этого количества приходится на долю непрямого билирубина. Повышение
его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий
уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой
билирубин, поступая с током крови в печень, подвергается обезвреживанию путем
связывания с глюку-роновой кислотой. В этом процессе принимают участие особый
фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся
донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка
глюкуроновой кислоты с образованием сравнительно индифферентного комплекса –
билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с
диазореактивом. В желчи всегда присутствует прямой билирубин. В крови
количество прямого и непрямого билирубина, а также соотношение между ними резко
меняются при поражениях печени, селезенки, костного мозга, болезнях крови и
т.д., поэтому определение содержания обеих форм билирубина в крови имеет
существенное значение при дифференциальной диагностике различных форм желтухи.
При желчнокаменной болезни в составе желчных камней наряду с основным их
компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие
плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде
билирубината кальция, участвующего в формировании камней.
Дальнейшая
судьба желчных пигментов, точнее билирубина, связана с их превращениями в
кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от
комплекса с билирубином и освободившийся билирубин подвергается восстановлению
в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет
около 300 мг стеркобилиногена. Последний легко окисляется под действием света и
воздуха в стеркобилин. Механизм бактериальных превращений билирубина до
стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными
продуктами восстановления являются последовательно мезобилирубин и
мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена
поступает через воротную вену в печень, где подвергается разрушению с образованием
моно- и дипиррольных соединений. Кроме того, очень небольшая часть
стеркобилиногена после всасывания через систему геморроидальных вен попадает в
большой круг кровообращения, минуя печень, и в таком виде выводится с мочой.
Однако называть его уробилиногеном не совсем точно (см. главу 18). Суточное
содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно
стеркобилиноген является нормальной органической составной частью мочи. Если с
мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена),
то это является свидетельством недостаточности функции печени, например, при
печеночной или гемолитической желтухе, когда печень частично теряет способность
извлекать этот пигмент из крови воротной вены. Химически уробилиноген
(мезо-билиноген) неидентичен стеркобилиногену (уробилиногену) мочи.
Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и
биливердина является свидетельством полного прекращения поступления желчи в
кишечник. Такое состояние часто наблюдается при закупорке протока желчного
пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная
болезнь, раковые поражения поджелудочной железы и др.).
Таким
образом, количественный и качественный анализ желчных пигментов в моче может
представлять большой клинический интерес.

Хлорофилл и гемин содержат четыре ядра — производных пиррола, составляющие циклическую систему порфирина, которая включает ион металла как центральный атом. Хлорофилл — это зеленый пигмент растений, встречающийся в природе в связанном состоянии с молекулой белка. Он функционирует как механизм для превращения световой энергий в химическую в процессе фотосинтеза, столь важного в растениях. Гемоглобин, одна из составных частей красных кровяных шариков в крови позвоночных, состоит из гемина (красный пигмент), связанного с белком. Он действует как переносчик кислорода из легких к тканям животного. Эта функция основана на присутствии железа в комплексе. Ядовитые свойства окиси углерода связаны с ее способностью заменять кислород в этом процессе и оказывать, таким образом, удушающее действие. На рис. 22.2 приведены формулы хлорофилла и гемина. [c.499]
Превращение гемоглобина в тканях. Как известно, эритроциты крови, подобно другим клеткам тела, с течением времени отмирают. В настоящее время считают, что средняя продолжительность жизии эритроцита, сухое вещество которого на 90—95% состоит из гемоглобина, равна 110—120 дням и что все количество эритроцитов, а следовательно и гемоглобина, полностью обновляется в организме на протяжении 3—4 месяцев. [c.364]
Превращение гемоглобина в тканях. Как известно, эритроциты крови, подобно другим клеткам тела, с течением времени отмирают. В настоящее [c.385]
Токсичность некоторых ядов может увеличиваться не только при взаимодействии с другими веществами, но и за счет их превращений непосредственно в организме. Так, например, отравляющее действие этиленгликоля, поступающего в организм, объясняется его окислением в щавелевую кислоту, которая является более токсичным продуктом. Окись углерода, попадая в организм, вступает в реакцию с гемоглобином крови, который является передатчиком кислорода, и образует стойкое соединение (метгемоглобин), в результате чего снижается доставка кислорода к тканям. Высокая токсичность метанола объясняется его окислением в организме с последующим расщеплением в формальдегид и муравьиную кислоту. Вместе с тем многие ядовитые вещества в результате реакций, протекающих в организме, превращаются в менее токсичные или вообще нетоксичные продукты. Так, например, довольно ядовитые соединения двухвалентного железа окисляются в организме в нетоксичные трехвалентные соединения. [c.41]
Однако в результате различных превращений токсичность некоторых ядов может увеличиваться. Например, высокая токсичность метанола объясняется его окислением в организме до формальдегида и муравьиной кислоты. Окись углерода, попадая в организм, вступает в реакцию с гемоглобином крови, который является передатчиком кислорода, и образует стойкое соединение — метгемоглобин, в результате чего снижается доставка кислорода к тканям. [c.242]
Так как метгемоглобин не может служить переносчиком кислорода от легких к тканям, при образовании в организме значительных количеств этого пигмента смерть наступает, как и при отравлении окисью углерода, от недостаточного снабжения тканей кислородом. Однако превращение части гемоглобина в метгемоглобин менее опасно, чем образование карбоксигемоглобина, поскольку метгемоглобин постепенно и относительно быстро восстанавливается в организме в исходный гемоглобин. [c.68]
В тканевых капиллярах происходит быстрая диффузия кислорода в жадно поглощающие его ткани, в результате чего парциальное давление кислорода резко снижается и падает до 30—40 мм. Это приводит к обратному превращению значительной части оксигемоглобина в гемоглобин. [c.462]
С тех пор как в растительных и животных тканях были найдены пигменты, их присутствие не переставало привлекать внимание исследователей даже в тех случаях, когда окраска могла быть безразлична с точки зрения биохимической функции. Яркая красная окраска является отличительным признаком крови, и именно поэтому она производит гораздо большее впечатление, чем бесцветная лимфа, хотя способность гемоглобина поглощать видимый свет не имеет прямой связи с его биологической деятельностью переносчика кислорода. В фотосинтезирующих клетках наличие окрашенного вещества приобретает особое значение. Так как в этих клетках свет превращается в химическую энергию, возникает вопрос, участвует ли. пигмент в этом превращении или же его окраска, аналогично красной окраске крови, только случайное проявление. [c.401]
При повышении концентрации или парциального давления окиси углерода равновесие смещается вправо. Значительная часть гемоглобина оказывается превращенной в карбоксигемоглобин и перестает участвовать в переносе кислорода к тканям. Обратный процесс — смещение равновесия в сторону распада карбоксигемоглобина. Если отравленный окисью углерода человек будет для дыхания получать чистый воздух без окиси углерода, то его нормальное самочувствие восстанавливается. [c.55]
Медь относится к сильным цитоплазматическим ядам, но небольшие ее количества организму необходимы для образования гемоглобина (медь в его состав не входит), превращения железа в доступную для синтеза гема форму, способствует переносу в костный мозг железа, повышает его всасывание в кишечнике и использование в тканях. Медь нужна также для образования ферментов, в которых она содержится. К таким ферментам принадлежат энзимы, катализирующие превращения тирозина, аскорбиновой кислоты и др. [c.157]
Это положение было также экспериментально обосновано. Показано, что при отравлении мыши такой высокой концентрацией окисью углерода, при которой весь гемоглобин ее был бы превращен в карбоксигемоглобин, при даче кислорода под давлением 2 атм. количество растворенного в плазме кислорода повысилось до 4%. Жизнь животного при этом была сохранена, что свидетельствует о нормальном использовании тканью свободного растворенного в плазме кислорода при полном выключении функции гемоглобина как переносчика кислорода. [c.219]
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Гемоглобин связывает СО сразу после высвобождения кислорода примерно 15% СО2, присутствующего в крови, переносится молекулами гемоглобина. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей СО в угольную кислоту (рис. 6.14). Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие сдвинуто в сторону диссоциации. Для [c.57]
Токсическое действие. Гемолитический яд. В организме восстанавливается, окисляя вещества тканей, а затем окисляется кислородом. В больших количествах вызывает превращение гемоглобина в метгемоглобин. Однако отравления в производственных условрих крайне редки [c.799]
Как мы уже видели (разд. 8.12 и далее), большая часть кислорода переносится гемоглобином эритрощ1тов. Эти клетки образуют важнейшую ткань тела человека, поскольку их общий объем составляет 3 л (у взрослого мужчины), а об-пц1Й вес почти равен весу печеш . Эритроциты представляют собой очеш> мелкие дегенеративные клетки, лишенные ядра, митохондрий и иных внутриклеточных органелл. В их собственном обмене кислород не используется. Относительно небольшое количество необходимого им АТР вырабатывается в ходе гликолитического превращения глюкозы, поступающей из крови, в лактат. Основная функция эритроцитов — транспорт О 2 из легких в ткани и участие в транспорте СО2 из тканей в лепкие. 35% массы эритроцита приходится на гемоглобин, который составляет 90% общего количества белка, содержащегося в клетке. [c.768]
Так, например, при содержании 1% (объемного) СО во вдыхаемом воздухе 95% гемоглобина переходит в форму НЬСО. Между тем смерть наступает вследствие недостаточного снабжения тканей (в первую очередь мозга) кислородом, даже при связывании 70% гемоглобина окисью углерода. Если вовремя увеличить парциальное давление кислорода (вдыхание чистого кислорода), то можно вызвать достаточное превращение карбоксигемоглобина в оксигемоглобин. [c.66]
Свободные аминокислоты могут претерпевать в организме человека и животных различные превращения часть их используется для синтеза белков органов и тканей, часть затрачивается на синтез различных других веществ гормонов, ферментов, простетической группы гемоглобина и т. д. (стр. 345 и далее), часть, подвергаясь распаду, используется в качестве энергетического материала. [c.325]
Двуокись углерода растворяется в крови главным образом в виде бикарбонат-ионов НСО . Поскольку кровь практически нейтральна (т. е. не содержит ионов ОН ), сначала происходит гидратация двуокиси углерода, в результате которой образуется угольная кислота. Обычно эта реакция протекает медленно в крови она значительно ускоряется ферментом — ангидразой угольной кислоты. Затем угольная кислота Н2СО3 отдает один ион Н” ” белкам крови, способным его принимать ( щелочной резерв крови ). В ходе этого процесса pH крови изменяется лишь незначительно. Это объясняется тем, что наряду с поглощением двуокиси углерода в капиллярах тканей происходит превращение более кислого оксигемоглобина артериальной крови в более щелочной гемоглобин венозной крови. В легких эти реакции протекают в обратном направлении. На чистом воздухе и под влиянием образующегося более кислого оксигемоглобина равновесие смещается в направлении НСО -Ь Н” ” Н2О + СО2. Следовательно, гемоглобин является основным источником щелочного резерва крови. [c.490]
При острых отравлениях кислотами, принятыми внутрь, наблюдаются жжение и сильная боль во рту, глотке, пищеводе, желудке, а также рвота, иногда с примесью крови. Позднее рвотные массы напоминают по цвету кофейную гущу вследствие превращения гемоглобина в гематнн и могут содержать клочья слизистой оболочки пищевода или желудка. Может иметь место ожог кожи лица. Слизистая оболочка рта, зева, глотки обычно ярко-красная, отечная, с сероватыми или желтоватыми пленками омертвевшей ткани, местами кровоточит. Вследствие сильной боли может наступить шок. Смерть при отравлении кислотами может наступить в первые днн от шока или перфорации желудка или позднее — от осложнений, вызванных отравлением (сужение пищевода или желудка и последствия этого сун ения). [c.360]
Биологическое действие. Аскорбиновая кислота участвует в создании окислительно-восстановительного потенциала ( д) в клетке и тем самым влияет на активность ряда ферментов. EQ системы аскорбиновая кислота дегидроаскорбиновая кислота равен 0,08 В, поэтому аскорбиновая кислота может участвовать в восстановлении цитохромов с и а, кислорода, нитратов. Витамин С защищает гемоглобин, препятствуя его окислению принимает участие в синтезе коллагена на этапе гидроксилирования пролина и лизина в оксипролин и оксилизин (это повышает прочность коллагеновых волокон) способствует биосинтезу хондроитинсульфатов соединительной ткани участвует в обмене тирозина (участвует в биосинтезе адреналина на этапе гидроксилирования дофамина и предохраняет адреналин от окисления участвует в обмене тирозина на этапе окисления й-оксифенилпировиноградной кислоты в гомогентизиновую кислоту и ее окислении) участвует в образовании желчных кислот на этапе 7а-гид-роксилирования предшественника участвует в синтезе фолиевой кислоты и через нее влияет на обмен нуклеиновых кислот и превращения рибозы в дезоксирибозу, косвенно активирует кроветворение и регенераторные процессы, увеличивает всасывание железа. В коре надпочечников содержится много аскорбиновой кислоты, которая используется в биосинтезе кортикостероидных гормонов. Этот процесс усиливается кортикотропином. Витамин С действует как главный водорастворимый антиоксидант и может ингибировать образование нитрозаминов (канцерогены) при приеме пищи. [c.344]
Последние 25 лет характеризуются широким применением в биохимии метода меченых атомов. Благодаря достижениям физики биохимия обогатилась новь)м методом исследования, позволяющим проследить за превращением веществ в организме, за процессами синтеза и распада органических соединений. Р1скусственно радиоактивные, а также природные стабильные изотопы, будучи введены в состав молекул тех или иных соединений, метят эти соединения, придавая им радиоактивность или же (в случае стабильных изотопов) большую плотность. По этим признакам можно следить за превращением веществ в организме, за использованием их для синтеза сложных соединений, а также за их распадом. Применение метода меченых атомов позволило выяснить пути синтеза многих органических веществ в организме (красящей части гемоглобина, производных пурина, креатина и многих иных веществ). Замечательно, что применение метода меченых атомов в биохимии позволяет проследить за скоростью обновления составных частей клеток и тканей организмов, за продолжительностью жизни отдельных химических соединений в организме. [c.12]
Гемоглобин эритроцитов обладает свойствами слабой кислоты я его соль, содержащая ионы калия, связывает кислоты, т. е. препятствует Понижению pH крови за счет превращения солеобразно-го соединения гемоглобина в свободный гемоглобин и соответствующую соль калия. Гемоглобин и выполняет функцию главного буфера крови, около /4 общей буферной емкости крови приходится на гемоглобин. Окоигемоглобин связывает ионы Н+ слабее, чем гемоглобин поэтому превращение оксигемоглобина в гемоглобин в капиллярах тканей организма ведет к повышению щелочности [c.183]
Кроме того, что эффект Бора важен для снабжения тканей кислородом и удаления СО , он еще участвует и в стабилизации pH крови. Превращение СО в угольную кислоту в капиллярах тканей могло бы изменить pH крови в кислую сторону, если бы протон не связывался с гемоглобином наоборот, в капиллярах легких освобождение протона гемоглобином предотвращает подщелачивание. Буферные свойства гемоглобина создают примерно всей буферной емкости крови и наряду с буферными свойствами системы [НСО ]/[Н2СО ], находящейся в равновесии с газообразным СО2, поддерживают pH крови с высокой точностью. [c.502]
Биологическая химия Издание 3 (1960) — [
c.364
]
Биологическая химия Издание 4 (1965) — [
c.385
,
c.386
]
