Принимает участие в синтезе гемоглобина
Гемоглобин синтезируется в клетках костного мозга. Все необходимые для синтеза гемоглобина составные части поступают с током крови.
Белковая часть молекулы синтезируется как и все простые белки из аминокислот матричным способом.
Синтез гема протекает в несколько стадий под влиянием различных ферментов:
1. Вначале происходит образование дельта-аминолевулиновой кислоты. Это реакция протекает в результате конденсации сукцинил-КоА и глицина в митохондриях под действием фермента аминолевулинатсинтетазы.
2.Следующая реакция протекает в цитоплазме. Происходит образование порфобилиногена в результате реакции конденсации двух молекул дельта-аминолевулиновых кислот.
3.Затем, в результате многоступенчатых реакций из четырех монопиррольных молекул порфобилиногена образуется протопорфирин 1Х, являющийся непосредственным предшественником гема.
4. Протопорфирин IX присоединяет молекулу железа (реакция осуществляется под влиянием фермента гемсинтетазы или феррохелатазы) и образуется гем, который затем используется для биосинтеза всех гемопротеидов. Оба фермента, участвующие в синтезе ПБГ, регулируемые, они ингибируются гемом и НЬ. Поэтому гем не образуется в избытке или недостатке. Также строго в определенном количестве образуется и белковая часть Нb, т. к. ее синтез может происходить только в присутствии тема, и образующиеся полипептидные цепи тут же соединяются с гемом. При низкой концентрации гема, когда нарушается его синтез, образование гемоглобина также замедляется.
Каждая из образовавшихся полипетидных цепей глобина присоединяются кодному гему, образуя моном ер гемоглобиан. 4 таких мномера, объединивщись, образуют гемоглобин.
Основной функцией гемоглобина является перенос кислорода из легких к тканям и перенос углекислого газа от тканей к легким, участие в поддержке рН крови. Свои функции гемоглобин выполняет только в составе эритроцита. Продолжительность жизни эритроцита 110-120 дней. Затем эритроцит подвергается гемолизу
3. Распад гемоглобина. Превращение билирубина в желудочно- кишечном тракте. Свободный и связанный билирубин. Свойства.
При гемолизе эритроцитов гемоглобин попадает в кровь и соединяется с белком гаптоглобином, в виде комплекса гемоглобин-гаптоглобин (Нр-Нb) транспортируется в клетки макрофагально-моноцитарной системы (ММС): это Купферовы клетки печени, клетки лимфоузлов, селезенки, пейеровых бляшек в кишечнике.
Процесс начинается с окислительного расщепления метинового мостикамежду первым и вторым пиррольными кольцами и образуется вердоглобин. Затем от вердоглобина отщепляется глобин, железо и образуется биливердин (зеленого цвета), вещество линейной структуры. Железо соединяется с b-глобулинами и в виде трансферина доставляется в печень и селезенку, где депонируется в виде ферритина. Глобин распадается так же как и все простые белки до аминокислот.
Биливердин восстанавливается за счет НАДФН2 в неконьюгированный,
свободный билирубин, который не растворим в воде и является токсичным соединением. Свободный билирубин выходит из клеток ММС, соединяется с
альбуминами и поступает в гепатоциты. В крови он называется непрямым потому, что дает реакцию с реактивом Эрлиха не сразу, а после добавления в сыворотку крови кофеинового реактива или спирта для осаждения белка.
В Купферовых клетках печени распад гемоглобина также начинается с
образования вердоглобина, затем биливердина. В печени непрямой билирубин обезвреживается в гепатоцитах путем реакции конъюгации, соединяясь с одной или двумя молекулами глюкуроновой кислоты, образуя моно- или диглюкуронид билирубина. Такой билирубин называется конъюгированным и
связанным и прямым. Этот билирубин хорошо растовряется в воде, не обладает токсическими свойствами. Биливердин и прямой билирубин собираются в желчном пузыре, придавая желчи оливковый цвет и потому их относят к пигментам желчи. Желчь поступает в тонкий кишечник, но в желчном протоке прямой билирубин, теряя глюкуроновые кислоты, снова превращается в непрямой. Биливердин проходит через весь кишечник не изменяя своей химической структуры и удаляется с калом, окрашивая его в зеленоватый цвет, т.е. он является пигментом кала. А непрямой билирубин в кишечнике восстанавливается до мезобилиногена (уробилиногена), часть которого всасывается в воротную вену и возвращается в печень, где распадается до бесцветных моно- и дипирролов. Последние выводятся через почки вместе с мочой.
Большая часть мезобилиногена поступает в толстый кишечник, где под
влиянием ферментов микроорганизмов восстанавливается в стеркобилиноген. Часть стеркобилиногена, всасываясь в кровь через геморроидальные вены, попадает в почки. В моче под действием света и воздуха происходит окисление стеркобилиногена до стеркобилина, который придает моче желтый цвет, т.е. является пигментом мочи. Остальная часть стеркобилиногена окисляется в толстом кишечнике на свету до стеркобилина и вместе с биливердином является пигментом кала, придавая ему коричнево-зеленый цвет.
У грудных детей в кишечнике нет гнилостных бактерий, поэтому
билирубин не превращается в стеркобилиноген и выводится как таковой. Соответственно цвет кала у детей обусловлен биливердином и билирубином (желто-зеленый).
У детей в первые три месяца эмбрионального периода образуется эмбриональный гемоглобин. Затем он преобразуется в фетальный (гемоглобин F), который доминирует вплоть до рождения ребенка. После рождения в течение первого месяца жизни фетальный гемоглобин постепенно заменяется на гемоглобин взрослого (гемоглобин А), отличающегося составом полипептидных цепей. Эмбриональный и фетальный гемоглобин обладают более высоким сродством к кислороду по сравнению с гемоглобином взрослого.
Пигменты желчи, кала и мочи.
При распаде гемоглобина образуются пигменты желчи, кала и мочи.
Пигменты желчи: биливердин (зеленого цвета), связанный билирубин (глюкурониды билирубина –желтого цвета). Цвет желчи зависит от соотношения этих пигментов.
Пигменты кала: биливердин (зеленого цвета), стеркобилин (коричневого цвета)
Пигмент мочи: стеркобилин
Цвет сыворотки крови тоже зависит в определенной степени от наличия в ней билирубина. В норме количество общего билирубина в крови равно 8—20 мкмоль/л, на долю непрямого билирубина приходится 75- 100%, а прямого от 0 до 25%. Количество прямого билирубина незначительно. Прямой билирубин проходит через пачечную ткань, и появляется в моче, непрямой билирубин в моче появиться не может, вследствие его нерастворимости в воде.
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
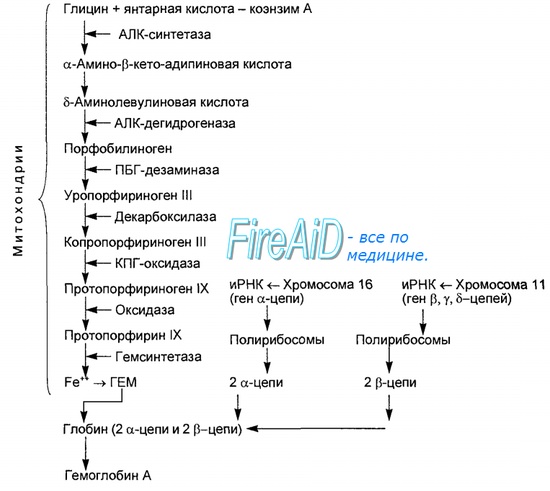
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Гемоглобин синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гемоглобин необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах – для образования цитохрома Р450ю Первая реакция синтеза гема – образование 5-аминолевулиновой кислоты из глицина и сукцинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции – сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена, дезаминированиепорфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также неферментативно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириногенIX, а протопорфириноген IX – в протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с б и в-полипепептидными цепями глобина, образует гемоглобин. Гемоглобин регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Рис. 1. Синтез гемма
Цифрами на схеме указаны ферменты: 1 – аминолевулинатсинтаза; 2 – аминолевулинатдегидратаза; 3 – порфобилиногендезаминаза; 4 – уропорфириноген III косинтаза; 5 – уропорфириногендекарбоксилаза; 6 – копропорфи-риноген III оксидаза; 7 – протопорфириногеноксидаза; 8 – феррохелатаза.
Буквами обозначены заместители в пиррольных кольцах: М – метил, В – винил, П – остатки пропионовой кислоты, А – ацетил, ПФ – пиридоксальфосфат. Донором железа служит депонирующий железо в клетках белок ферритин.
Витамин В12 – биосинтез, биологическая роль. Значение витаминов группы К
Витамин В12 и родственные ему кобаламины играют важную роль в жизнедеятельности человека. Они участвуют в различных биохимических превращениях, предотвращают развитие злокачественной анемии крови, различных заболеваний печени, используются при лечении лучевой болезни. Кобаламины синтезируются различными микроорганизмами. В промышленности производство витамина В12 основано на использовании пропионовокислых бактерий.
Механизм образования витамина В12, наиболее сложного из известных тетрапиррольных пигментов, выяснен значительно лучше, чем, например, хлорофиллов и бактериохлорофиллов. По образному выражению известного английского ученого А. Баттерсби, внесшего большой вклад в раскрытие биосинтеза витамина В12.
Разветвление основного пути биосинтеза тетрапиррольных пигментов в сторону витамина В12 начинается с Урогена. Сначала под действием особых ферментов происходит введение метильной группы. Соединение, получившее название прекоррин-1, далее подвергается метилированию с образованием прекоррина-2. Третье метилирование проходит по мезо-углеродному мостику, и в результате возникает частично восстановленный макроцикл прекоррина-3.
Последующие превращения, каждое из которых контролируется своими ферментами, включает метилирование, сужение макроцикла с образованием корринового цикла, введение метильных групп и затем, два метилирования по мезо-мостикам и декарбоксилирование остатка уксусной кислоты. Заключает этот цикл превращений перегруппировка метильной группы с образованием важного промежуточного соединения – гидрогенобириновой кислоты.
На заключительном этапе биосинтеза кислота амидируется по остаткам уксусной кислоты и включает ионы двухвалентного кобальта, превращаясь в диамидкобириновой кислоты. Далее происходит восстановление Со2+ Со+, и эта активная форма превращается в диамидаденозилкобириновой кислоты. Наличие аденозильноголиганда, является необходимым условием для дальнейшего ступенчатого амидирования четырех карбоксильных групп. Оставшаяся карбоксильная группа кобировой кислоты участвует в образовании так называемой нуклеотидной петли.
Первоначально происходит присоединение 1-аминопропанола-2 с образованием соединения. Ферменты, контролирующие этот процесс, обладают высокой специфичностью к аденозилкобириновой кислоте. Фосфорилирование по гидроксильной группе аминопропанола дает фосфат. Последний превращается в коферментную форму витамина В12 аденозинкобаламина. Замена остатка аденозина на циано-группу приводит к цианкобаламину – лекарственной форме витамина В12. В организме происходит обратная замена [4].
Было установлено, что витамин В12 поступающий с пищевыми веществами, предохраняется от разрушения в кишечнике благодаря тому, что он соединяется с «внутренним» фактором Кастла, природа которого также была выявлена. Он оказался мукопротеином – белком, находящимся в желудочном соке здорового человека и содержащим в своём составе 11-12% гексозамина. Этот фактор был найден также в желтке яиц, в молоке и других пищевых продуктах.
Биохимическая роль витамина В12многогранна, роль витамина В12 заключается в синтезе нуклеиновых групп при превращении гомоцистеина в метионин, а оксиэтиламина в холин, являющихся липотропными факторами.
Витамин В12 принимает участие и в реакции ацетилиривакоэнзима А, ускоряя процесс биологического окисления уксусной и пировиноградной кислот.Введение витамина В12 приводит к уменьшению содержания сахара в крови вследствии усиления окисления глюкозы в тканях. В 1948 г. было доказано положительное действие этого витамина на синтез пуриновых пиримидиновых оснований, т.е. на синтез рибонуклеиновой дезоксирибонуклеиновой кислот.
Предполагают, что витамин В12 способствует превращению глюкозы в дезоксирибозу. Источником в этом случае служат некоторые аминокислоты – глицин, глютаминовая и метионин.
Витамин В12 способствует накоплению жира у животных, ускоряя превращение аминокислот в глюкозу, которая переходит в жир.
Витамин В12 участвует в превращении каротина в витамин А и отложении последнего в печени, он обезвреживает никотиновую кислоту путём её метилирования с образовниемметилникотина.
К витаминам группы К относятся природные вещества – витамин K1 (фнллохннон) и витамин К2 (менахинон). Из синтетических препаратов известны витамин Кз (метннон) и водорастворимый препарат викасол, обладающие высокой биологической активностью. Свое название витамин К получил от слова «коагуляция» (свертываемость).
Витамины группы К участвуют в процессах свертывания крови. Они оказывают влияние на биосинтез прокоагулянтов и являются стимуляторами биосинтеза в печени четырех белков ферментов, необходимых для свертывания крови и образования активных тромбопластина и тромбина.
У взрослого человека витамин К2 синтезируется кишечной микрофлорой (1,5мг в сутки). Синтез витаминов К кишечной микрофлорой исключает возможность возникновения у взрослого человека первичного К-авитамнноза. У взрослого человека возможны вторичные К-авитаминозы, развивающиеся в результате прекращения усвоения витаминов К в кишечнике или вследствие прекращения его эндогенного синтеза кишечной микрофлорой. Частой причиной вторичной недостаточности витамина К являются болезни печени. Вторичный К-авитаминоз может иметь место при обтурационной желтухе, когда вследствие прекращения поступления желчи s двенадцатиперстную кишку нарушается усвоение жирорастворимых веществ, в том числе витаминов группы К.
Вопрос 89.Гормоны передней доли гипофиза и их действие на организм животных
Передняя доля гипофиза вырабатывает группу гормонов белковой или полипептидной структуры, влияющих на организм через действие на щитовидную железу, надпочечники и половые железы.
Аденогипофиз продуцирует также гормоны, действующие на органы и ткани организма – соматотропный гормон или гормон роста, гормон, стимулирующий пигментные клетки -меланоцито-стимулирующий гормон (МСГ), экзофтальмический фактор.
Соматотропный гормон, полученный из гипофизов различных животных и человека, обладает специфичностью, отличаясь по своим физико-химическим и иммунологическим свойствам. Гормон роста, полученный из гипофизов домашних животных, не оказывает биологического действия на приматов. Соматотропный гормон домашних животных, молекулярный вес которого в два раза больше, чем молекулярный вес гормона роста приматов, состоит из биологически активного ядра, общего для соматотропинов всех видов, и аминокислотной оболочки.
Основной стороной биологического действия гормона роста является его способность стимулировать анаболические процессы.
Гормон роста повышает содержание белка в печени, мышцах и тканях, уменьшает выделение азота. Под влиянием гормона роста уменьшается выделение мочой калия, фосфора, магния, натрия и хлора; выделение кальция увеличивается. Увеличивается количество внеклеточной жидкости. Уровень мочевины в крови снижается. Для проявления анаболического действия гормона роста необходимо наличие в организме определенного уровня кортизола, инсулина и тироксина.
Гормон роста оказывает действие на углеводный обмен. При достаточно длительном применении он повышает уровень сахара в крови [3].
Этот гипергликемизирующий эффект осуществляется рядом механизмов. Гормон роста увеличивает поступление углеводов из печени в кровь. Гормон роста тормозит переход углеводов в жиры, повышает выделение инсулина. Это связано с непосредственным действием гормона на островки поджелудочной железы, либо является следствием повышенного поступления глюкозы в кровь. Одновременно гормон роста стимулирует выработку глюкагона клетками островков поджелудочной железы, активизирует инсулиназную активность печени, повышает выработку В-липопротеидного антагониста инсулина.
Гормон роста оказывает на углеводный обмен фазное действие. В первые часы после инъекции он вызывает снижение сахара крови, возможно, в связи с усилением выработки инсулина или вследствие высвобождения связанного инсулина. В дальнейшем проявляется гипергликемизирующее действие гормона роста. При длительном избытке гормона роста, наступает истощение инсулярного аппарата и может развиться сахарный диабет. У неполовозрелых животных, у которых способность инсулярного аппарата к регенерации велика, гормон роста не оказывает диабетогенного действия.
Гормон роста оказывает жиромобилизующее действие. После его введения повышается содержание неэстерофицированных жирных кислот в крови и имеет место увеличение количества жира в печени.
Гормон роста стимулирует окисление жира в печени, вызывая преходящуюгиперкетонемию. Выработка кетоновых тел в печени под влиянием гормона роста повышается. У животных с экспериментальным диабетом и у больных сахарным диабетом может развиться кетоацидоз. Этот эффект выражен у больных сахарным диабетом с удаленным гипофизом. Эффект гормона роста на жировой и белковый обмен проявляется на фоне «обусловливающего» пермессивного действия физиологического количества кортизола. Большие дозы гликокортикоидов тормозят жиромобилизующее действие гормона роста. Гормон роста усиливает функцию почек, повышает клиренс креатинина. Меланоцито-стимулирующий гормон (МСГ) вырабатывается у животных средней долей гипофиза, которая у человека является рудиментарным органом.
