Регуляторные молекулы влияющие на сродство гемоглобина к кислороду
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
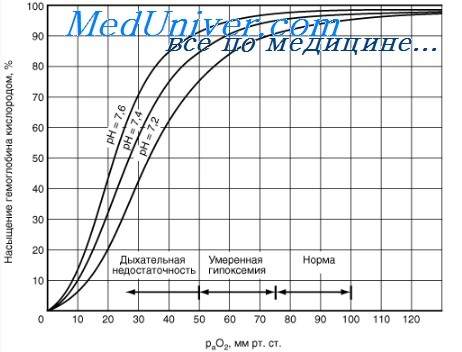
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
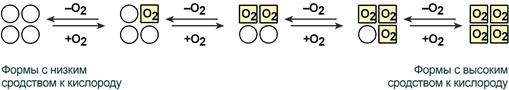
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Факторы влияющие на КДО. Влияние температуры на кривую диссоциации оксигемоглобина (КДО)
Обсуждению этого вопроса посвящена обширная литература. Считается, что наибольшее влияние на положение КДО оказывает кислотность среды (эффект Бора). Было установлено, что при Ph больше 6,0 в крови преобладает оксигемоглобин, при Ph менее 6,0 — восстановленный гемоглобин.
Было установлено также, что на величину Р50 влияет находящееся в эритроците фосфорное соединение 2,3 дифосфоглицерат (2,3-ДФГ) и что концентрация этого вещества увеличивается по мере снижения Ph. Высказывалось даже предположение, что на положение кривой диссоциации оксигемоглобина Ph влияет через 2,3-ДФГ. Это предположение в дальнейшем частично подтвердилось, что позволило окончательно прояснить роль Ph в изменениях положения КДО.
Ph, изменяя структуры групп гемоглобина, связанных с кислородом, непосредственно влияет на аффинитет гемоглобина с кислородом. Кроме того, Ph оказывает на положение КДО опосредованное влияние через содержание в эритроците 2,3-ДФГ, поскольку кислая среда активирует образование этого фосфата, а щелочная среда его ингибирует.
Однако 2,3-ДФГ и сам может непосредственно влиять на положение КДО. Воздействуя на атомы железа в молекулах гемоглобина, 2,3-ДФГ снижает сродство гемоглобина к кислороду и способствует ускорению диссоциации оксигемоглобина. Установлено, что увеличение 2,3-ДФГ на 1 ммоль/л повышает Р50 на 1,23 мм Нд. На содержание в эритроците 2,3-ДФГ оказывают непосредственное влияние неорганические фосфаты, тиреоидные и некоторые гипофизарные гормоны.
Основная роль напряжения углекислоты в регуляции положения КДО реализуется через влияние ее на кислотность среды. При гиперкапнии Ph снижается, при гипокапнии — повышается.

Температура крови оказывает серьезное влияние на положение кривой диссоциации оксигемоглобина. Установлено, что при гипертермии КДО смещается вправо, при гипотермии — влево.
Этот феномен имеет серьезный физиологический смысл. В альвеоле притекающая кровь контактирует с охлажденным альвеолярным воздухом, что способствует смещению КДО влево и повышению аффинитета гемоглобина с кислородом. Ускоряется оксигенация крови.
В тканях, особенно в функционирующей мышечной ткани, температура всегда повышена. Это способствует смещению КДО вправо и снижению сродства гемоглобина к кислороду, что облегчает переход кислорода в клетки.
Воздействие температуры на положение КДО усиливается под влиянием 2,3-ДФГ. При низком содержании этого фосфата в эритроците, при прочих равных условиях, влияние гипотермии на увеличение аффинитета гемоглобина к кислороду существенно повышается и способствует большему смещению кривой влево.
Данный феномен создает серьезные проблемы для реаниматолога в случаях переохлаждения организма пострадавшего (длительное нахождение в холодной воде, замерзание при отрицательной температуре воздуха, особенно в состоянии алкогольного опьянения). В этой ситуации сродство гемоглобина к кислороду может быть столь высоким, что на тканевом уровне практически прекращается газообмен.
Противоположная ситуация возникает при гипертермии, при которой на фоне резкого увеличения потребности в кислороде в силу низкого аффинитета гемоглобина к кислороду (смещение КДО вправо) возникают сложности в оксигенации крови в легких.
– Также рекомендуем “Значение положения кривой диссоциации оксигемоглобина (КДО). Механизм формирования КДО”
Оглавление темы “Параметры потребления кислорода и гемодинамики”:
1. Кривая диссоциации оксигемоглобина (КДО). Физиологический смысл КДО
2. Кислородтранспортная функция крови. Нормальная кривая диссоциации оксигемоглобина (КДО)
3. Факторы влияющие на КДО. Влияние температуры на кривую диссоциации оксигемоглобина (КДО)
4. Значение положения кривой диссоциации оксигемоглобина (КДО). Механизм формирования КДО
5. Гемодинамические параметры. Кислородный поток и потребление кислорода
6. Факторы влияющие на потребление кислорода. Предупреждение критической тканевой гипоксии
7. Законы Старлинга. Сердечный выброс по Старлингу
8. Регуляция сердечного выброса по кислороду. Влияние венозного притока на сократимость миокарда
9. Современный взгляд на сердечный выброс. Взаимоотношение факторов влияющих на сократимость миокарда
10. Неконтролируемая внутривенная инфузия. Кривая венозного притока
В легких сродство гемоглобина к кислороду очень высокое. На уровне тканей – низкое. В тканях происходит распад веществ с образованием углекислого газа, который проникает из тканей в эритроцит, взаимодействует с водой с образование угольной кислоты, которая распадается на гидрокарбонатный ион протон водорода:
CO2 + H2O H2CO3 H+ + HCO3-
Н+ присоединяется к гемоглобину, образуется дезоксигемоглобин, а кислород отделяется от него и уходит в ткани. таким образом, чем выше количество Н+ , тем меньше сродство гемоглобина к кислороду.
Дезоксигемоглобин переносится к легким. На уровне легких в эритроцитах происходит следующая реакция:
H+ + HCO3- H2CO3 CO2 + H2O
Углекислый газ и вода удаляются через легкие. А на место протона к молекуле гемоглобина присоединяется кислород, и процесс повторяется.
Кроме того, сродство гемоглобина к кислороду регулируется веществом 2,3-дифосфоглицератом, которое образуется в эритроцитах при распаде глюкозы. 2,3-дифосфоглицерат может присоединяться к дезоксигемоглобину на уровне тканей, поэтому в присутствии 2,3-дифосфоглицерата сродство кислорода к гемоглобину снижается, и кислород поступает в ткани.
Белковые цепи гемоглобина α и β кодируются различными генами. При мутациях в этих генах синтезируются аномальные гемоглобины. При этом наблюдаются гемоглобинопатии. Например, аномальным является гемоглобин М, у которого в β-цепи гидрофильная аминокислота глутамат заменена на гидрофобную аминокислоту валин. В результате гемоглобин М нерастворим, образует осадок в виде длинных волокон, эритроцит деформируется и приобретает форму серпа. Такой гемоглобин неспособен переносить кислород. В результате развивается заболевание серповидноклеточная анемия. Кроме того, аминокислота гистидин активного центра гемоглобин может быть на тирозин, в результате атом железа в геме приобретает степень окисления +3. образуется мет-гемоглобин, который неспособен переносить кислород, возникает гипоксия в организме.
Флавопротеины – относятся к хромопротеинам. В качестве небелковой части выступает флавинмононуклеотиод (ФМН) и флавинадениндинуклетотид (ФАД) (см. лекция). Флавопротеины являются ферментами окислительно-восстановительных реакций, обеспечивающих организм энергией.
Липопротеины – в качестве небелковой части содержат липиды: свободные жирные кислоты, триацилглицеролы, фосфолипиды, холестерин. Липопротеины входят в состав клеточных мембран, осуществляют транспорт липидов по крови к тканям.
Липиды соединяются с белковой частью с помощью ионных связей и гидрофобных связей.
Фосфопротеины – в качестве небелковой части содержат фосфат. Фосфат присоединяется к белковой части при помощи сложно-эфирной связи с ОН-группой сеина, треонина, тирозина. К фосфопротеинам относятся : казеин молока, вителлин яйца, ихтулин рыб. Таким эти белки способствуют росту и развитию организма.
Металлопротеины – в качестве небелковой части содержат ионы металлов – железо, медь, кобальт, марганец, молибден, цинк, магний, кальций, калий, натрий. Связь иона металла с белковой частью осуществляется с помощью координационных связей. Металлопротеины являются ферментами. Трансферрин переносит железо в крови, ферритин запасает железо в тканях.
Нуклеопротеины – в качестве небелковой части содержат нуклеиновые кислоты – ДНК, РНК. В результате образуются следующие нуклеопротеины – дезоксирибонулеопротеины (ДНП) и рибонулеопротеины (РНП). ДНП входят в состав хромосом, отвечают за хранение и передачу наследственной информации. РНП входят в состав рибосом, на которых осуществляется синтез белка.
ДНК – состоит из нуклеотидов. Нуклеотид состоитиз азотистого основания, дезоксирибозы и фосфата. Различают пуриновые азотистые основания – аденин и гуанин, пиримидиновые азотистые основания – цитозин, тимин. Нуклеотиды соединяются сложноэфирными связями в первичную структуру ДНК. Вторичная структура ДНК представлена двойной спиралью. Внутри спирали – водородные связи, образованные между комплементарными азотистыми основаниями: аденин комплементарен тимину, гуанин – цитозину. При наружу обращены дезоксирибоза и фосфат отрицательнозаряженный. Третичная структура образуется при связывании спирали ДНК с положительно заряженными белками гистонами в составе хромосом.
При делении клетки происходит удвоение ДНК – репликация, редупликация. При этом двойная спираль ДНК раскручивается, образуются 2 исходные нити ДНК, на каждой из которых по принципу комплементарности строятся дочерние цепи ДНК. В результате образуются две двойные молекулы ДНК. Между нитями – водородные связи, образованные при взаимодействии комплементарных азотистых оснований. Процесс протекает в ядре клетки.
РНК – также состоит из нуклеотидов. Это одноцепочечная молекула. Нуклеотид РНК представлен азотистыми основаниями (аденин, цитозин, урацил, гуанин), рибозой, фосфатом.
Дата добавления: 2016-11-02; просмотров: 1083 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление


