Серповидная анемия какая мутация
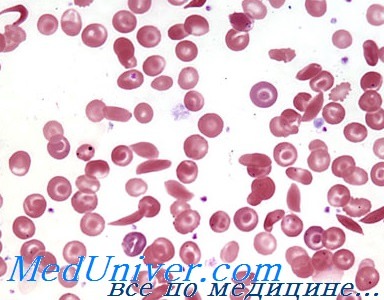
Генетика серповидноклеточной анемии. НаследованиеHbS был первым обнаруженным аномальным гемоглобином с высоким клиническим значением. Он возникает вследствие замены единственного нуклеотида, которая изменяет кодон шестой аминокислоты В-глобина глутаминовой кислоты на валин (GAG -> GTG: Glu6Val). Гомозиготность по данной мутации — причина серповидноклеточной анемии, серьезного заболевания, часто встречающегося в некоторых частях света. Болезнь имеет характерное географическое распределение, чаще всего встречается в Экваториальной Африке и реже всего в Средиземноморье, Индии и странах, в которые мигрировали люди из этих регионов. С этой, обычно фатальной в раннем детстве болезнью рождаются около 1 из 600 афроамериканцев, хотя все более частым становится более долгое выживание. Серповидноклеточная анемия — тяжелое аутосомно-рецессивное гемолитическое заболевание, характеризующееся тенденцией эритроцитов принимать выраженно аномальную форму (серпа) в условиях низкого насыщения кислородом. Гетерозиготы, про которых говорят, что они имеют «признак» серповидноклеточно-сти, обычно клинически здоровы, но их эритроциты в условиях очень низкого давления кислорода in vitro принимают форму серпа. Случаи, когда бы это могло происходить in vivo, редки, хотя гетерозиготы имеют риск инфаркта селезенки, особенно при полетах на большой высоте в самолетах с низким давлением в кабине. Гетерозиготное состояние наблюдают приблизительно у 8% афроамериканцев, но в областях, где частота гена высокая (например, в Западной Центральной Африке), вплоть до 25% новорожденных — гетерозиготы. Молекулярная патология HbS – серповидноклеточной анемииОколо 50 лет тому назад Ингрэм обнаружил, что аномалия HbS связана с заменой одной из 146 аминокислот в В-цепи молекулы гемоглобина. Все клинические проявления наличия HbS — последствия этого единственного изменения в гене В-глобина. Это было первой демонстрацией того, что мутация в структурном гене может вызывать замену аминокислоты в соответствующем белке. Поскольку аномалия HbS локализуется в В-цепи, формула HbS может быть записана как а2b2s или, более точно, а2Ab2s.
Гетерозиготы имеют смесь двух типов гемоглобинов (НbА и HbS), обозначаемых а2Аb2А, а2Аbs, а также гибридный тетрамер гемоглобина, обозначаемый как a2AbA,bs. Серповидноклеточность и ее последствияМолекулы гемоглобина, содержащие мутантные субъединицы b-глобина, нормальны по их способности выполнять их главную функцию связывания кислорода (если они не полимеризованы, как указано далее), но в ненасыщенной кислородом крови они растворимы в пять раз меньше по сравнению с нормальным гемоглобином. Относительная нерастворимость дезоксигемоглобина S является физической основой феномена серповидноклеточности. В условиях низкой кислородной напряженности молекулы HbS собираются в форме полимеров, формирующих стержни или волокна, искажающие форму эритроцитов. Эти уродливые эритроциты деформируются хуже, чем в норме, и, в отличие от нормальных красных кровяных клеток, не могут сжиматься, проходя через капилляры, тем самым блокируя ток крови и вызывая локальную ишемию. Происхождение мутаций гемоглобина SУ большинства лиц африканского происхождения нормальный ген b-глобина содержится в пределах фрагмента рестрикции размером в 7,6 килобазы ДНК. В то же время в определенных частях Африки, например в Гане и почти у 70% афроамериканцев, аллель серповидноклеточного глобина часто обнаруживают во фрагменте размером в 13 килобаз. Частая ассоциация серповидноклеточного глобина с 13-килобазовым фрагментом — поразительный пример неравновесного сцепления. В других частях Африки (например, в Кении) мутация серповидноклеточности обычно связана с фрагментом размером в 7,6 килобазы. Эти находки позволяют утверждать, что мутация серповидноклеточности возникла в Западной Африке в хромосоме, которая содержала ген р-глобина во фрагменте длиной 13 килобаз, и что подобная мутация, по крайней мере, один раз, независимо произошла где-то еще. Защита от малярии, обеспечиваемая данной мутацией у гетерозигот, обеспечила ее высокую частоту в областях, пораженных малярией. – Также рекомендуем “Генетика гемоглобинов HbС, Hammersmith. Наследование” Оглавление темы “Генетика гемоглобинопатий”:
|
Как и почему возникает клеточная анемия
Это заболевание является своеобразной приспособительной реакцией, возникшей у населения, проживающего в районах с высоким распространением малярии. Возбудитель болезни – плазмодий, передаваемый комарами, живет и размножается в клетках крови. Периодически паразиты выходят в кровоток, вызывая тяжелое состояние, сопровождающееся лихорадкой, сыпью, спутанностью сознания и даже смертельными исходами.
Укус комара
Поэтому местные жители в процессе эволюции приобрели особенность, позволяющую противостоять возбудителям. Часть эритроцитов – красных кровяных клеток изменила свою форму и свойства. Они увеличили плотность и стали не круглыми, а полукруглыми, напоминающими по форме серп. В такой крови плазмодии размножаются гораздо хуже и малярия не развивается.
Однако при такой особенности количество серповидных клеток у каждого больного индивидуально. При небольших концентрациях измененных эритроцитов больные не предъявляют жалоб.
Заболевание является наследственным:
- Дети, один из родителей которых имеет признаки изменения эритроцитов, а у другого нет такой особенности, здоровы.
- Однако если оба родителя имеют в крови серповидные эритроциты, у детей в кровотоке могут полностью отсутствовать нормальные красные кровяные тельца.
Симптомы серповидноклеточной анемии
В начале жизни, пока плодные (фетальные) клетки крови не поменялись на «взрослые», ребенок с такой генетической особенностью чувствует себя нормально. Однако, постепенно его состояние ухудшается – возникает задержка физического и умственного развития, опухают суставы, появляются боль в груди, животе, пожелтение кожи, увеличение селезенки.
Характерно неправильное развитие скелета – череп в виде башни с утолщенными швами, напоминающими гребни, искривление позвоночника.
Признаки серповидной анемии:
- слабость;
- головная боль;
- затрудненное дыхание;
- пациент не может выдержать нагрузку;
- анорексия;
- быстрый сердечный ритм;
- низкое кровяное давление;
- сердечная недостаточность.
Головная боль
Быстрый сердечный ритм
У пациентов периодически наступают гемолитические кризы – состояния, при которых измененные эритроциты разрушаются. Повышается температура, нарушается дыхание, появляются явные признаки желтухи, кровь в моче, кровотечения. Возможны сильные боли в животе, вызванные увеличением селезенки. Без срочного переливания крови больной может очень быстро умереть.
До начала миграции населения проблема серповидноклеточной анемии касалась только стран, где она давно наблюдалась. Однако теперь такие случаи регистрируются в государствах, где малярия никогда не встречалась.
Как диагностируется заболевание?
Подозрения может вызывать история болезни пациента и его семьи. При этом симптомы патологии могут быть специфическими для других состояний, связанных с анемией или гемолизом.
После тщательного физического осмотра пациента, назначаются лабораторные анализы крови, подтверждающие анемию и гемолиз. Точно подтверждает наличие HbS и самого заболевания специальная лабораторная обработка образца крови пациента (электрофорез гемоглобина). Под микроскопом (после надлежащей подготовки) эритроциты приобретают характерную форму серповидных клеток.
Лабораторные нарушения гемолиза с обнаруживаемой анемией включают высокий уровень ЛДГ и высокий уровень билирубина.
Визуальные исследования, в основном, УЗИ брюшной полости, показывают увеличение селезенки или печени.
Лечение серповидноклеточной анемии
До последнего момента, единственным возможным вариантом лечения пациентов с этим видом анемии была трансплантация донорских стволовых клеток. Такая процедура требует соответствующего донора, и сам пациент также должен быть с допустимым состоянием здоровья. Из-за строгих требований лечению подвергался лишь небольшой процент пациентов с гомозиготной серповидно-клеточной анемией.
Для пациентов с симптомами тяжелого кризиса, симптомы облегчаются следующими методами:
- Обезболивание. Во многих случаях требуется сильный анальгетик (морфий).
- Оксигенотерапия.
- Переливание крови. Проводится только по индивидуальным показаниям, в случае угрозы жизни
Переливание крови
Поддержка в течение бессимптомного периода:
- Предотвращение недостатка кислорода.
- Предотвращение обезвоживания.
- Профилактика инфекций везде, где это возможно.
- Антибиотикопрофилактика из-за недостаточной функции селезенки (постоянное применение пенициллина у детей до пяти лет).
- Быстрое и целенаправленное лечение инфекций.
- Вакцинация (против пневмококка, Haemofilus influenzae).
- Прием фолиевой кислоты (спорная рекомендация).
Новые методы лечения серповидной анемии — генная терапия
Раньше больные дети умирали в раннем возрасте, но теперь медицина может продлить им жизнь, а с внедрением новой технологии – избавить от заболевания. Лечение, основанное на реактивации выработки гемоглобина, было представлено на ежегодном собрании Американского общества гематологов в Орландо, штат Флорида.
В процессе лечения у больного изымаются стволовые клетки, которые затем размножаются и вводятся обратно. В большинстве случаев такой метод приводит к излечению. Новую методику уже начали применять в США.
Ученые выяснили, что до рождения и в первые месяцы после появления на свет у ребёнка не вырабатываются серповидные красные кровяные клетки. В его кровотоке циркулирует фетальный (плодный) гемоглобин, имеющий нормальное строение. Поэтому в самом раннем детстве у ребёнка не возникает симптомов заболевания.
Со временем этот тип гемоглобина заменяется взрослым, а эритроциты приобретают серповидную форму. Учёные выяснили, что за этот переход отвечает ген BCL11A и белок с таким же названием. Выключив этот процесс, и оставив гемоглобин в плодном состоянии, можно вылечить больных.
Для этого из организма пациента «вылавливают» стволовые клетки, в которые с помощью специального вируса транспортируют маленькую шпилечную РНК, которая не дает образовываться белку BCL11A. Зачем эритроциты оставляют размножаться в специальных культурах.
Пациенту проводится цитостатическая терапия с помощью препаратов, убивающих костный мозг, как при лечении лейкоза. После этого пациенту вводят выращенные стволовые клетки. Они формируют новый костный мозг, заставляя его вырабатывать фетальный гемоглобин, который находился в кровотоке больного до рождения и в первые месяцы жизни.
Результаты лечения хорошие. Первые трое взрослых пациентов, которым была проведена «подсадка» стволовых клеток через 9,10 и 18 месяцев, чувствуют себя намного лучше. Двое из трех больше не нуждаются в переливания крови. В анализах у них не обнаружено существенных отклонений.
Затем такая процедура была проведена двум подросткам 12 и 16 лет. «Подсадка» была повторена через 5 месяцев. Практически сразу отпала необходимость в переливании крови, и исчезли гемолитические кризы.
Все больные, прошедшие лечение, избавились от риска разрушения сосудов мозга, легочной пневмонии, поражений костей. В дальнейшем планируется продолжить развивать и улучшать такой метод лечения.
Поделиться ссылкой:
Серповидноклеточная анемия: причины, диагностика, лечениеЭтиология и встречаемость серповидноклеточной анемии. Серповидноклеточная анемия (MIM № 603903) — аутосомно-рецессивное заболевание гемоглобина, вызванное миссенс-мутацией гена бета-субъединицы, заменяющей валин на глутаминовую кислоту в 6 положении. Болезнь чаще вызвана гомозиготностью по мутации серповидноклеточности, хотя серповидноклеточную анемию также может вызывать компаундная (составная) гетерозиготность по аллелю серповидноклеточности и аллелям HbC или бета-талассемии. Распространение серповидноклеточной анемии широко изменяется среди популяций в соответствии с прошлым и настоящим распространением малярии. Мутация серповидноклеточности, как оказалось, несколько повышает сопротивляемость малярии, таким образом, давая преимущество выживания гетерозиготным носителям мутации. Патогенез серповидноклеточной анемииГемоглобин формируется из четырех субъединиц: двух а-субъединиц, кодируемых геном ЯВА в хромосоме 16, и двух бета-субъединиц, кодируемых геном ЯВВ в хромосоме 11. Мутация Glu6Val в бета-субъединице уменьшает растворимость ненасыщенного кислородом гемоглобина и вызывает формирование сети жестких волокнистых полимеров, искажающих строение эритроцита, придавая ему форму серпа. Серповидные эритроциты закупоривают капилляры и вызывают инфаркты. Первоначально обогащение кислородом заставляет полимер гемоглобина растворяться, и эритроциты восстанавливают нормальную форму; тем не менее, регулярное нарушение формы приводит к необратимому переходу клеток в серповидную форму, впоследствии такие эритроциты удаляются из кровотока в селезенке. Скорость удаления эритроцитов из кровотока превышает возможность их синтеза в костном мозге, что приводит к гемолитической анемии. Аллельная гетерогенность часто встречается при большинстве менделирующих заболеваний, особенно когда мутантные аллели вызывают снижение функции. Серповидноклеточная анемия — важное исключение из этого правила, поскольку в данном случае единственная специфическая мутация ответственна за уникальные новые свойства HbS. HbC тоже менее растворим, чем HbA, и тоже стремится кристаллизоваться в эритроцитах, уменьшая их деформируемость в капиллярах и вызывая легкий гемолиз, но HbC не формирует полимерные волокна, как HbS. Неудивительно, что другие мутации с новыми функциями, например, мутации в гене FGFR3, вызывающие ахондроплазию, часто имеют аналогичное снижение аллельной гетерогенности, когда фенотип зависит от специфического, уникального изменения функции белка.
Фенотип и развитие серповидноклеточной анемииКлиническая картина у больных серповидноклеточной анемией обычно проявляется в течение первых двух лет жизни анемией, задержкой развития, спленомегалией, регулярными инфекциями и дактилитами (болезненными припухлостями кистей или стоп, вызванными закупоркой капилляров в небольших костях, обнаруженных у приведенной в примере пациентки). Инфаркты вследствие закупорки сосудов происходят во многих тканях, вызывая инсульты мозга, острый кардиальный синдром, почечный папиллярный некроз, инфаркты селезенки, язвы ног, приапизм, асептический некроз костей и снижение зрения. Окклюзия сосудов костей вызывает приступы болей, при отсутствии лечения эти болезненные эпизоды могут продолжаться в течение нескольких дней и даже недель. Функциональная аспления вследствие инфарктов и других недостаточно ясных факторов, предрасполагает к бактериальным инфекциям, например, пневомококковому или сальмонеллезному сепсису и остеомиелиту. Инфекция — основная причина смерти во всех возрастных группах, хотя прогрессирующая почечная и дыхательная недостаточность также нередкие причины смерти на четвертом и пятом десятилетиях жизни. Пациенты также имеют высокий риск развития угрожающей жизни апластической анемии после парвовирусной инфекции, поскольку парвовирусы вызывают временное прекращение образования эритроцитов. Гетерозиготные носители мутации («признака» серповидноклеточности) не имеют анемии и обычно клинически здоровы. Однако в условиях серьезной гипоксии, например, при восхождении в горы, эритроциты пациентов с «признаком» серповидноклеточности могут принимать форму серпа, вызывая симптомы, подобные наблюдаемым при серповидноклеточной анемии. Особенности фенотипических проявлений серповидноклеточной анемии: Лечение серповидноклеточной анемииКонкретному больному серповидноклеточной анемией дать точный прогноз тяжести течения болезни невозможно. Хотя молекулярная основа болезни стала известной раньше других моногенных заболеваний, лечение остается только симптоматическим. Никакой специфический терапии, предохраняющей от процесса образования серповидных эритроцитов, не найдено. Существенно снижает тяжесть болезни персистенция HbE Исследуется несколько фармакологических препаратов, нацеленных на увеличение концентрации HbF, в этих целях одобрено использование гидрокси-мочевины. Хотя генотерапия имеет шанс улучшить или излечить эту болезнь, эффективная пересадка гена b-глобина не достигнута. Пересадка костного мозга остается единственным доступным в настоящее время лечением, способным помочь при серповидноклеточной анемии. Из-за 11% смертности, вызванной сепсисом в первые 6 мес жизни, большинство штатов в США проводит неонатальный скрининг на серповидноклеточную анемию с целью проведения профилактики антибиотиками, продолжающейся до 5-летнего возраста. Риски наследования серповидноклеточной анемииПоскольку серповидноклеточная анемия — аутосомно-рецессивное заболевание, будущие сибсы больного ребенка имеют 25% риск серповидноклеточной анемии и 50% риск носительства серповидноклеточности. Используя ДНК плода, полученную при БВХ или амниоцентезе, можно провести пренатальную диагностику обнаружением мутации. Пример серповидноклеточной анемии. Второй раз за полгода семейная пара карибского происхождения обратилась со своей 24-месячной дочерью в отделение неотложной помощи, поскольку девочка не может стоять. В анамнезе отсутствуют повышение температуры, инфекция или травма, и в остальном медицинская история ничем не примечательна; данные предыдущих осмотров соответствовали норме, за исключением низкого уровня гемоглобина и слегка увеличенной селезенки. При текущем осмотре патологии не найдено, за исключением пальпируемого края селезенки и отека стоп. Стопы болезненны при пальпации, и девочка не хотела вставать на ноги. Оба родителя имели сибсов, умерших в детстве от инфекций, и других сибсов, вероятно, имевших серповидноклеточную анемию. С учетом анамнеза и повторного болезненного увеличения стоп врач проверил ребенка на наличие серповидноклеточной анемии методом электрофореза гемоглобина. Результат этого теста подтвердил наличие HbS. – Также рекомендуем “Болезнь Тея-Сакса: причины, диагностика, лечение” Оглавление темы “Врожденные болезни”:
|
