Сколько аминокислот входит в состав гемоглобина
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
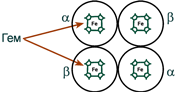
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Гемоглобин – белок, содержащийся в эритроцитах и осуществляющий обмен кислорода между легкими и тканями организма. Имеет в своем составе железо. Также он обуславливает цвет крови.
Синонимы русские
Содержание гемоглобина.
Синонимы английские
Hemoglobin, Haemoglobin, Haemoglobin concentration, Hb, Hgb.
Единицы измерения
Г/л (грамм на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Общая информация об исследовании
Измеряется количество гемоглобина, содержащегося в эритроцитах белка, который доставляет кислород к тканям и органам, а углекислый газ – от тканей и органов к легким, где он выдыхается.
Это происходит за счет того, что кислород способен связываться железом, атомы которого “встроены” в гемоглобин. “Подходя” к тканям, эритроциты освобождаются от кислорода и забирают “отработанный” диоксид углерода (углекислый газ).
Гемоглобин состоит из аминокислот, образующих белковый комплекс глобин, и гема, содержащего железа. Образование глобина и гема у некоторых людей может нарушаться, что грозит анемией.
Сниженный уровень гемоглобина, скорее всего, свидетельствует об анемии – состоянии, при котором организм не получает достаточно кислорода, что вызывает слабость и быструю утомляемость.
Гемоглобин повышается при увеличении количества эритроцитов и снижается, соответственно, если их становится меньше.
Снижение количества эритроцитов может происходить из-за уменьшения их образования в костном мозге, их потери в результате кровотечения или разрушения внутри организма.
Для чего используется исследование?
- Чтобы оценить тяжесть анемии или полицитемии.
- Чтобы отслеживать в динамике эффективность терапии этих состояний.
Когда назначается исследование?
- Входит в рутинный клинический анализ крови, который может назначаться по различным показаниям.
Что означают результаты?
Референсные значения
Возраст | Пол | Гемоглобин, г/л |
134-198 | ||
14 дней – 1 мес. | 107-171 | |
1-2 мес. | 94-130 | |
2-4 мес. | 103-141 | |
4-6 мес. | 111-141 | |
6-9 мес. | 110-140 | |
9-12 мес. | 113-141 | |
1-5 лет | 110-140 | |
5-10 лет | 115-145 | |
10-12 лет | 120-150 | |
12-15 лет | мужской | 120-160 |
женский | 115-150 | |
15-18 лет | мужской | 117-166 |
женский | 117-153 | |
18-45 лет | мужской | 132-173 |
женский | 117-155 | |
45-65 лет | мужской | 131-172 |
женский | 117-160 | |
> 65 лет | мужской | 126-174 |
женский | 117-161 |
Причины изменения уровня гемоглобина
Уровень гемоглобина выше у мужчин, так как андрогены стимулируют образование эритроцитов.
Причины повышения уровня гемоглобина:
- дегидратация (обезвоживание) из-за сгущения крови – гемоконцентрации;
- истинная полицитемия в результате избыточной продукции эритроцитов в костном мозге;
- хроническая обструктивная болезнь легких; хроническая сердечная недостаточность.
Причины понижения уровня гемоглобина:
- железо-, B12- или фолиево-дефицитная анемия;
- острое или хроническое кровотечение (хотя во время кровотечения или сразу после него уровень гемоглобина будет повышен),
- нарушения синтеза гемоглобина (серповидно-клеточная анемия, талассемия);
- хронические болезни почек (как правило, из-за уменьшения синтеза гормона эритропоэтина, который стимулирует образование эритроцитов в костном мозге);
- цирроз печени;
- микседема (снижение функции щитовидной железы);
- гемолиз (разрушение эритроцитов), который может происходить по разным причинам – из-за наследственного дефекта эритроцитов, в результате появления антител к собственным эритроцитам или токсического действия при малярии;
- онкологические заболевания костного мозга или метастазы других опухолей в костный мозг;
- апластическая анемия;
- системные заболевания соединительной ткани;
- хронические инфекции.
Что может влиять на результат?
Повышенный уровень гемоглобина наблюдается:
- у людей, поднимающихся на большую высоту, так как их организм адаптируется к пониженной концентрации кислорода;
- у курильщиков (вследствие кислородного голодания тканей);
- при влиянии гентамицина и пентоксифиллина.
Уровень гемоглобина понижен:
- в норме у беременных,
- у соблюдающих вегетарианскую диету,
- после сдачи крови,
- при выраженной липемии и повышении количества лейкоцитов,
- при сдаче крови в положении лежа (снижение до 5 %).
Важные замечания
- Следует понимать: нормальный уровень эритроцитов не всегда означает, что содержание в них гемоглобина будет тоже в норме.
Также рекомендуется
- Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
- Гематокрит
- Эритропоэтин
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, нефролог, хирург.
Гемоглобин – состоит из белка глобина и небелковой части гема, в составе которого имеется атом Fе(II). Молекула Нb содержит 4 гема и является белком с четвертичной структурой (4 субъединицы – 2 α-цепи и 2 β-цепи, каждая из которых имеет свою третичную структуру и особым образом уложена вокруг кольца гема). Каждая из субъединиц похожа на молекулу миоглобина. Молекула гемоглобина способна присоединять 4 молекулы О2. Гемоглобин переносит кислород от легких к тканям, а углекислый газ в обратном направлении. Нb + О2 → НbО2 – оксигемоглобин – в капиллярах легких Нb насыщается кислородом при высоком парциальном давлении (100 мм рт. ст.).
В капиллярах тканей, где парциальное давление кислорода низкое (5 мм рт. ст.) НbО2 → на Нb и О2. Кислород переходит в ткани, а освободившийся Нb соединяется с поступившим из тканей СО2 и превращается в НbСО2 – карбгемоглобин, который переносится с кровью к легким. В легочных капиллярах НbСО2 → Нb + СО2. СО2 выводится из организма при выдыхании, а Нb вновь насыщается кислородом.
Сравнение зависимости насыщения от парциального давления кислорода показывает, что при парциальных давлениях кислорода, характерных для тканей, гемоглобин отдает значительные количества кислорода. В гемоглобине происходит перемещение атома железа в плоскость гема с одновременным изменением конформации полипептидной цепи, но так как молекула Нb имеет четвертичную структуру и отдельные цепи связаны между собой, то это позволяет передать изменения конформации на область связи между полипептидными цепями. Это изменяет положение в пространстве всей молекулы и облегчает доступ О2 к остальным гемам молекулы Нb. Одновременно это изменение конформации сопровождается появлением на поверхности групп, которые, диссоциируя, отдают протоны (Н+) в окружающую среду. При понижении парциального давления кислорода события повторяются в обратном направлении: отдача кислорода идет по мере снижения парциального давления, гемоглобин переходит в другое конформационное состояние, при этом из окружающей среды (ткань), где высока концентрация протонов, протоны присоединяются к гемоглобину. Такие изменения конформации позволяют гемоглобину не только регулировать обеспечение кислородом тканей, но и участвовать в поддержании кислотно-основного равновесия в организме.
При отравлении угарным газом в крови образовывается карбоксигемоглобин Нb + СО → НbСО – прочное соединение, препятствует образованию НbО2 и транспорту кислорода. Возникает кислородное голодание.
Различные формы Нb определяются методом спектрального анализа. У взрослого человека молекула НbА (2 α-цепи и 2 β-цепи). Но от целого ряда условий состав цепей гемоглобина может меняться. У плода НbF (фетальный – 2 α-цепи, 2 γ-цепи) – он лучше связывает кислород при его относительной недостаточности в период внутриутробного развития.
В результате определенных нарушений генетического аппарата клетки Нb патологический, а заболевания – гемоглобинопатии наследственного происхождения.
Классическим примером является серповидно-клеточная анемия(аномальный гемоглобин – причина). Синтезируется β-цепь необычного состава, в которой валин занимает место глутаминовой кислоты, присутствующей в нормальном НbА. Изменение такое вызывает нарушение структуры и свойств Нb, который обозначается НbS – он легко выпадает в осадок, обладает сниженной способностью переносить кислород. В результате эритроциты, содержащие НbS приобретают форму серпа. Клинически: нарушается кровообращение и дыхание, иногда летальный исход.
Миоглобин – хромопротеид, содержащийся в мышцах. Он обладает простетической группой – гемом, циклическим тетрапирролом, придающим ему красный цвет. Тетрапиррол состоит из 4 пиррольных колец, соединенных в плоскую молекулу метиленовыми мостиками. Атом железа занимает центральное положение в этой плоской молекуле. Железо в составе гема цитохромов способно менять свою валентность, в гемоглобине и миоглобине изменение валентности железа нарушает их функцию. Главная функция и гемоглобина и миоглобина – связывание кислорода.
Миоглобин – сферическая молекула, состоит из 153 аминокислот с общей молекулярной массой 17000. он состоит из одной цепи, аналогичной субъединице Нb. На уровне вторичной структуры он образует 8 α-спиральных участков, захватывающих почти 75% всех аминокислот молекулы. Атом железа в геме миоглобина, не связанный с кислородом, выступает из плоскости молекулы на 0,03 нм. В оксигенированной форме атом железа как бы погружается в плоскость молекулы гема. Образуя связь с одной из молекул гистидина глобиновой части, железо при соединении с кислородом изменяет и конформацию белка. Миоглобин удобен для хранения кислорода, но не удобен для транспорта его по крови. Это объясняется процессом насыщения миоглобина в зависимости от парциального давления кислорода. Так как в легких парциальное давление кислорода 13,3 кПа, миоглобин хорошо бы насыщался кислородом, но в венозной крови это давление составляет 5,3 кПа, а в мышцах ещё меньше – 2,6 кПа. Миоглобин в таких условиях сможет отдавать мало кислорода и будет недостаточно эффективен в транспорте кислорода от легких к тканям.
Гем –простетическая группа многих важных с точки зрения функций белков.
Гем – небелковая часть, в составе находится Fе (ΙΙ), гем входит в состав флавопротеинов, гемопротеидов, гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов.
Знание вопросов биосинтеза и распада гема призвано помочь в понимании роли гемопротеинов в организме. Нарушение этих процессов связано с развитием заболеваний. Так, с нарушением биосинтеза гема связана группа заболеваний – порфирии.
Порфирии – группа заболеваний с нарушением биосинтеза гемма. группа заболеваний с нарушением биосинтеза гемма. Наблюдается накопление побочных промежуточных продуктов, которые откладываются в различных органах или выделяются в повышенных количествах с калом или мочой. Появление в моче в значительных количествах веществ незавершенного синтеза гемма либо продуктов его распада (копропорфирин и уропорфирин) вызывает порфиринурию. Моча пурпурно-красного цвета. Это бывает при некоторых поражениях печени, кишечных кровотечениях, интоксикациях. Порфиринурия является одним из признаков отравления свинцом, когда нарушается транспорт Fe, необходимого для синтеза гемоглобина.
Гораздо чаще встречаются патологические состояния, связанные с распадом гема и нарушением выведения из организма продуктов его катаболического превращения. Наиболее распространенной является желтуха.
глицин + сукцинил – КоА
синтаза 5-аминолевулиновой кислоты
5 – аминолевулиновая кислота
Уропорфириноген ΙΙΙ В цитоплазме клеток
Копропорфириноген ΙΙΙ
Протопорфирин ΙΧ
В митохондриях + Fe2+
клетки
Гем
Из многих представителей хромопротеидов для человека наибольшее значение имеет гемоглобин. Хромопротеиды растительного и животного происхождения, находящиеся в пищевых продуктах, подвергаются действию ферментов пищеварительного тракта.
Гемоглобин пищи, находящийся в ней в денатурированном состоянии, легко гидролизуется, распадаясь на простетическую группу и белок. Белок расщепляется пепсином и трипсином с образованием пептидов и аминокислот. Следовательно, глобиновая часть гемоглобина подвергается обычным превращениям в ЖКТ, которые свойственны простым белкам. Простетическая группа – гемм – окисляется в гематин. Гематин всасывается в кишечнике очень плохо. Эти пигменты выделяются с калом частью в неизмененном виде, частью в виде различных продуктов, образующихся под влиянием бактерий кишечника. Обычные химические способы обнаружения крови в кале, имеющие большое значение для клиники, основаны на реакциях гематина, и могут дать достоверные результаты только в том случае, если диета не содержит мяса, в котором присутствует миоглобин.
Время жизни эритроцитов у взрослого организма составляет около 4 месяцев. Спустя этот период времени эритроциты разрушаются в основном в печени, селезенке и костном мозге. В ходе разрушения из эритроцитов высвобождается гемоглобин (8 – 9 г в сутки).
![]()
1 ответ:
![]()
2
0
в состав гемоглобина входит множество аминокислот таких как гистидин, валин,лейцин,треонин,пролин,глутаминовая кислота,лизин,глицин.молекула гемоглобина состоит из двух частей:простетической группы (гема),и белка типа альбумина -глобина.4%гема 96%глобина.гемоглобин отвечает за доставку и за перенос кислорода и удаления углекислого газа.
Читайте также
![]()
Гемоглобин ребенка немного выше нормы, но высокий гемоглобин, может увеличить вязкость крови и спровоцировать образование тромбов, обратитесь к гематологу. На время ограничьте потребление красного мяса, замените его курицей, морепродуктами, исключите яблоки, ешьте больше молочного, кальций затрудняет всасывание железа.
![]()
недавно была такая ситуация поэтому рекомендую употреблять гематоген который продают в аптеках.
![]()
Продукты, повышающие гемоглобин, это, в первую очередь, печень. Говяжья, куриная, свиная… Если ребенок отказывается есть ее жареной или тушеной, то приготовьте паштет и намазывайте на хлеб. Это выход. По себе знаю. Терпеть не могу печень, но гемоглобин низкий, приходится выкручиваться.
Конечно, в мясе тоже содержится железо (кроме свинины – там маловато).
Из овощей и фруктов для повышения гемоглобина стоит выбрать брокколи, авокадо, гранат. Добавьте в рацион петрушку.
Из круп – гречку, овес, пшено, кукурузу. Ржаной хлеб содержит много железа.
Следует употреблять в пищу печень трески, икру, форель, можно сельдь.
И обязательно надо много гулять на свежем воздухе.
![]()
170 это уже верхний предел гемоглобина у мужчин. Высока вероятность возникновения тромбов в сосудах. К высокому показателю гемоглобина чаще всего приводят курение, чрезмерное употребление алкоголя,повышенные физические нагрузки, заболевания внутренних органов.
Что нормализовать уровень гемоглобина необходимо вести здоровый образ жизни, спокойный образ жизни с умеренными нагрузками (рекомендуют плаванье, ходьбу), пить много жидкости, чтобы разжижать кровь.
![]()
Гематоген принимают для коррекции метаболических процессов. Источник полноценных: белков, углеводов, жиров, и минералов. Содержатся в данном препарате в пропорциях, очень близких составу человеческой крови. Белок содержит все аминокислоты в разумном для организма соотношении. Гематоген стимулирует кроветворение, способствует ускоренному всасыванию железа в кишечнике. Повышает гемоглобин в крови, увеличивает содержание в плазме ферритина.
С целью профилактики гематоген принимают внутрь. Назначают детям старше 2 лет, взрослым и подросткам по 1-2 пластинки 2-3 раза в сутки в течении 1-2 месяцев. После перенесенной железодефицитной анемии гематоген назначают в сутки по 2 плитки. Принимаю на протяжении 2 месяцев.
