Соединение гемоглобина с газами спектр поглощения
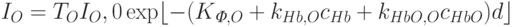
Поглощение света и цвет гемоглобина.Цвет растворенного вещества, не испускающего световые лучи, зависит от его способности поглощать падающий свет в той или иной части спектра видимого света. Как правило, каждое вещество поглощает свет лишь в определенной области спектра, тогда как свет других длин волн проходит через это вещество почти беспрепятственно. Цвет раствора вещества определяется спектральным составом прошедшего через него света.
Красный цвет растворов гемоглобина (и, следовательно, крови) обусловлен тем, что это вещество относительно сильно поглощает коротковолновый свет, т. е. в синей области спектра, а большую часть длинноволнового (красного) света пропускает.
При исследовании света, прошедшего через раствор оксигенированного гемоглобина, с помощью спектроскопа можно обнаружить не только полосу поглощения в синей области спектра (полосу Соре), но также две характерные темные полосы (полосы поглощения) в желтой и желто-зеленой областях спектра с максимумами при длинах волн 577 и 541 нм [11].
Дезоксигемоглобин несколько интенсивнее, чем оксигемоглобин, поглощает длинноволновые лучи и менее интенсивно – коротковолновые. В связи с этим венозная кровь выглядит темнее и имеет красный цвет с синеватым оттенком. При спектроскопическом исследовании выявляется одна широкая полоса поглощения в желто-зеленой части спектра с максимумом при длине волны 555 нм.
Спектрфотометрия. Для количественного анализа абсорбционных свойств окрашенного раствора используют спектрофотометры. В этих приборах видимый свет разлагается в спектр при помощи призмы или дифракционной решетки, а затем свет очень узкой области длин волн (так называемый монохроматический свет) проходит через исследуемый раствор. Поглощение света зависит от длины волны и от свойств раствора. Для определения соотношения между интенсивностью падающего (I0) и прошедшего (I) света используется фотоэлемент. Отношение I/I0 называется пропусканием, а отношение (I0 — I)/I0 – поглощением. Полный спектр поглощения раствора получают путем последовательного измерения этих величин для разных длин волн.
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 607
| Рис. 22.4. Спектры поглощения оксигемоглобина (НbО2) и дезоксигемоглобина (Hb). По оси ординат слева-коэффициент поглощения, справа -экстинкция |
Спектры поглощения.На рис. 22.4 изображены спектры поглощения оксигемоглобина ндезоксигемоглобина. Тем участкам спектра, в которых при спектроскопии обнаруживаются темные полосы, соответствуют максимумы на кривой поглощения. Для оксигемоглобина характерны два таких максимума, а для гемоглобина – один, занимающий положение между ними. Из рисунка видно, что эти максимумы приходятся на те же длины волн, что и полосы поглощения.
Точки пересечения обеих кривых поглощения, или так называемые изобестические точки, соответствуют длинам волн, при которых растворы равной концентрации Hb и НbО2 пропускают свет в одинаковой степени. Если длина волны световых лучей соответствует изобестической точке, то поглощение их гемоглобином не зависит от степени его оксигенации. Монохроматический свет такой длины волны используют в тех случаях, когда необходимо определить концентрацию гемоглобина, не подвергая его химическим модификациям (см. ниже). Если же спектрофотометрию используют для измерения насыщения гемоглобина кислородом, то, напротив, выбирают свет с такой длиной волны, при которой разница между коэффициентами поглощения оксигемоглобина и дезоксигемоглобина максимальна, т.е. 600, 577, 470 нм и т. д. (см. рис. 22.4).
Закон Ламберта-Бэра. Вкачестве количественной характеристики поглощения света часто используют также экстинкцию(Е) (на рис. 22.4 отложена по правой оси ординат):
О)
где I0-интенсивность падающего света, а I- интенсивность прошедшего света. Экстинкцию удобно использовать в связи с тем, что она прямо про-
порциональна концентрации растворенного вещества С:
(2)
где d-толщина слоя раствора, а ε – коэффициент экстинкции (величина, постоянная для каждого вещества). Линейная зависимость между экстинкцией, концентрацией и толщиной слоя раствора называется законом Ламберта-Бэра. Этот закон справедлив только для монохроматического света.
Содержание гемоглобина в крови; среднее содержание гемоглобина в эритроците
Нормальные показатели.Содержание гемоглобина в крови человека составляет в среднем 158 г/л (15.8 г/дл) у мужчин и 140 г/л (14 г/дл) у женщин. Как и практически любые биологические показатели, эта величина претерпевает определенные колебания даже у здоровых людей. Пределы колебаний определяют путем построения частотного распределениязначений для большого числа людей (рис. 22.5).
С возрастом содержание гемоглобина в крови заметно меняется. В крови новорожденного оно составляет 200 г/л. причем возможны значительные индивидуальные колебания (рис. 22.5). В течение первого года жизни содержание гемоглобина снижается примерно до 115 г/л, а затем постепенно возрастает до уровня, характерного для взрослых.
Высокое содержание гемоглобина в крови наблюдается не только у плода, но также у лиц, длительное время живущих в условиях высокогорья (с. 714). И в том и в другом случае повышение содержания гемоглобина необходимо для того, чтобы обеспечить нормальное снабжение тканей кислородом при пониженном парциальном давлении этого газа.
Уменьшение содержания гемоглобина по сравнению с нормальным уровнем называется анемией.Как правило, диагноз анемия ставят в том случае, если содержание гемоглобина меньше 130 г/л у мужчин и 120 г/л у женщин.
Измерение содержания гемоглобина.Для измерения содержания гемоглобина существует много методов, в том числе: 1) определение количества связанного О2(1 г Hb может присоединить до 1,36 мл О2); 2) анализ уровня железа в крови (содержание железа в гемоглобине составляет 0,34%); 3) колориметрия (сравнение цвета крови с цветом стандартного раствора); 4) измерение экстинкции (спектрофотометрия). При проведении рутинных определений уровня гемоглобина отдают предпочтение последнему методу, так как при использова-
6C8 ЧАСТЬ VI. ДЫХАНИЕ
нии первых двух способов необходима сложная аппаратура, а метод колориметрии неточен.
Спектрофотометрический анализ. Принцип метода состоит в определении содержания Hb в крови по экстинкции монохроматического света. Поскольку растворенный гемоглобин нестабилен, а экстинкция зависит от степени оксигенации, его необходимо предварительно перевести в стабильную форму.
Спектрофотометрические измерения содержания гемоглобина производят следующим образом. Кровь набирают в капиллярную пипетку и затем смешивают с раствором, содержащим калий железосинеродистый (K3[Fe(CN)6]), цианистый калий (KCN) и бикарбонат натрия (NaHCO3). Под действием этих веществ эритроциты разрушаются, и гемоглобин превращается в цианметгемоглобинHbCN (содержащий трехвалентное железо), способный сохраняться в течение нескольких недель. При спектрофотометрии раствор цианметгемоглобина освещают монохроматическим светом с длиной волны 546 нм и определяют экстинкцию Е. Зная коэффициент экстинкции ε и толщину слоя раствора d, можно, исходя из закона
Ламберта-Бэра [уравнение (2)], определить концентрацию раствора С непосредственно по величине экстинкции Е. Чаще предпочитают, однако, предварительно откалибровать шкалу экстинкции при помощи стандартного раствора. В настоящее время цианметгемоглобиновый метод считается наиболее точным из общепринятых способов измерения содержания гемоглобина [32].
Среднее содержание гемоглобина в эритроците.
Важным диагностическим показателем, позволяющим оценить эритропоэз и провести дифференциальную диагностику различных форм анемии, служит среднее содержание гемоглобина в одном эритроците (СГЭ) (по международной классификации-mean corpuscular hemoglobin, MCH). Эта величина отражает абсолютное количество гемоглобина, содержащееся в среднем в одном эритроците. Ее находят путем деления количества гемоглобина в определенном объеме крови на число эритроцитов в том же объеме.
Приведем пример расчета СГЭ. У здорового мужчины в 1 л крови содержится 158 г Hb и 5,1 млн ∙ 106 эритроцитов (1 л = 106 мкл). СГЭ равно отношению этих величин:
Такая же величина СГЭ характерна и для здоровых женшин:
Эритроциты с нормальным содержанием гемоглобина (26-36 пг) называют нормохромнымн. Если СГЭ патологически снижено, то эритроциты называют гипохромными, а если оно повышено – гиперхромными. Эти же термины употребляют и для обозначения различных форм анемии. Так, когда образование гемоглобина снижается в результате недостатка железа, содержание гемоглобина в расчете на эритроцит падает, и возникает гипохромная анемия. При других разновидностях анемии (например, пернициозной анемии) нарушается образование красных кровяных телец в костном мозгу, и в крови появляются деформированные эритроциты с высоким содержанием гемоглобина. В этом случае речь идет о гиперхромной анемии. После значительной кровопотери СГЭ сначала не изменяется (нормохромная анемия), а в последующем вследствие избыточной продукции эритроцитов содержание гемоглобина в них падает (гипохромная анемия).
Рекомендуемые страницы:
Гемоглобин выполняет, в организме важную роль переносчика
кислорода и принимает участие в транспорте углекислоты.
Гемоглобин представляет собой сложное химическое соединение
(молекулярный вес 68 800). Он состоит из белка глобина и четырех молекул гема.
Молекула гема, содержащая атом железа, обладает способностью соединять и
отдавать молекулу кислорода. При этом валентность железа, к которому
присоединяется кислород, не изменяется, т. е. железо остается двухвалентным.
Если обработать гемоглобин раствором соляной кислоты, то от
глобина отщепляется гем. Вступая в соединение с соляной кислотой, он
превращается в гемин
(С34Н32N4O4FeCl), образующий
кристаллы характерной формы. Проба на образование гемина производится для
доказательства присутствия крови при судебномедицинских исследованиях.
В состав молекулы гема входят четыре пиррольных кольца (два из них имеют
характер щелочи, а два – кислоты). Атом железа, содержащийся в геме, связывает
гем с белковой частью глобином. Если гем теряет атом железа, а пирроловая его
структура сохраняется, то получается гематопорфирин. Это вещество в больших
количествах образуется в организме при некоторых отравлениях или нарушениях
обмена и может выделяться с мочой.
Гем является активной, или так называемой простатической, группой
гемоглобина, а глобин — белковым носителем гема. Гемоглобин, присоединивший
кислород, превращается в оксигемоглобин (его обозначают символом
НbO2). Оксигемоглобин, отдавший кислород, называется восстановленным,
или редуцированным, гемоглобином (Нb). Оксигемоглобин, гемоглобин и
некоторые другие соединения и производные гемоглобина дают характерные полосы
поглощения лучей спектра.
Так, пропуская луч света через раствор оксигемоглобина, можно Рис. 5. Спектры поглощения оксигемоглобина (сверху) и Оксигемоглобин несколько отличается по цвету от гемоглобина, поэтому |
Значительно большее поглощение световых лучей с длиной волны 620—680 ммк
гемоглобином по сравнению с оксигемоглобином легло в основу методики измерения
степени насыщения крови кислородом — оксигемометрии. При этой методике ушную
раковину или кювету с кровью просвечивают небольшой электрической лампой и
определяют с помощью фотоэлемента интенсивность светового потока указанной длины
волны, проходящего через ткань уха или кювету с кровью. По показаниям
фотоэлемента определяют степень насыщения гемоглобина кислородом.
Кровь взрослых людей содержит в среднем 14—15% гемоглобина (у мужчин
13,5—16%, у женщин 12,5—14,5%). Общее содержание гемоглобина равно примерно 700
г.
В эмбриональном периоде в крови человека имеются разные типы гемоглобина,
отличающиеся способностью присоединять кислород в некоторыми другими химическими
свойствами. Для определения и разделения разных типов гемоглобина применяют
методику измерения оптической плотности растворов гемоглобина до и после
денатурации его едкой щелочью. Разные типа гемоглобина условно обозначают НbA,
HbF, НbР, Гемоглобин НbР встречается только в первые 7—12 недель внутриутробного
развития зародыша. На 9-й неделе появляется в крови зародыша гемоглобин HbF и
гемоглобин взрослых НbA. Существенно важным представляется тот факт, что
эмбриональный гемоглобин HbF обладает более высоким сродством к кислороду и
может насыщаться на 60% при таком напряжении кислорода, когда гемоглобин матери
насыщается всего на 30%. У разных видов позвоночных животных имеются различия в
структуре гемоглобина. Гем разных типов гемоглобина при этом одинаков, глобины
же различаются по своему аминокислотному составу.
В организме постоянно происходит синтез и распад гемоглобина, связанные с
образованием и разрушением эритроцитов. Синтез гемоглобина совершается в
эритробластах красного костного мозга. При разрушении эритроцитов, которое
происходит в ретикуло-эндотелиальной системе, главным образом в печени и
селезенке, из красных кровяных клеток выходит гемоглобин. В результате
отщепления железа от гема и последующего окисления образуется из гемоглобина
пигмент билирубин, который затем с желчью выделяется в кишечник, где
превращается в стеркобилин и уробилин, которые выводятся с калом и мочой. За
сутки разрушается и превращается в желчные пигменты около 8 г гемоглобина, т. е.
несколько более 1 %.
В организме человека и животных могут образовываться и другие соединения
гемоглобина, при спектральном анализе которых обнаруживаются характерные спектры
поглощения. К числу таких соединений гемоглобина относятся метгемоглобин и
карбокенгемоглобин. Вещества эти образуются в результате некоторых
отравлений.
Метгемоглобин (MetHb) представляет собой прочное соединение
гемоглобина с кислородом; при образовании метгемоглобина меняется валентность
железа: двухвалентное железо, входящее в молекулу гемоглобина, превращается в
трехвалентное. В случае накопления в крови больших количеств метгемоглобина
отдача кислорода тканям становится невозможной и наступает смерть от
удушення.
Метгемоглобин отличается от гемоглобина коричневым цветом и наличием полосы
поглощения в красной части спектра. Метгемоглобин образуется при действии
сильных окислителей: феррицианида (красной кровяной соли), марганцовокислого
калия, амил- и пропилнитрита, анилина, бертолетовой соли, фенацетина.
Карбоксигемоглобин (НbСО) представляет собой соединение железа
гемоглобина с окисью углерода (СО) — угарным газом. Это соединение примерно в
150—300 раз прочнее, чем соединение гемоглобина с кислородом. Поэтому примесь
даже 0,1 % угарного газа во вдыхаемом воздухе ведет к тому, что 80% гемоглобина
оказываются связанными окисью углерода и не присоединяют кислород, что является
опасным для жизни.
Слабое отравление угарным газом — обратимый процесс. Прп дыхании свежим
воздухом СО постепенно отщепляется от карбоксигемоглобнна и
выделяется.
Вдыхание чистого кислорода увеличивает скорость расщепления
карбоксигемоглобина в 20 раз. В тяжелых случаях отравления необходимо
искусственное дыхание (стр. 171) газовой смесью с 95% содержания 02 и 5% СО2, а
также переливание крови.
Миоглобин. В скелетной и сердечной мышце находится мышечный
гемоглобин, называемый миоглобином. Его простетическая группа — гем — идентична
этой же группе молекулы гемоглобина, а белковая часть — глобин — обладает
меньшим молекулярным весом, чем белок гемоглобина.
Миоглобин человека способен связывать до 14% от общего количества кислорода в
организме. Это его свойство играет важную роль в снабжении кислородом работающих
мышц. Если при сокращении мышцы кровеносные капилляры ее сжимаются и кровоток в
некоторых участках мышцы прекращается, то все же благодаря наличию кислорода,
связанного с миоглобином, в течение некоторого времепп сохраняется снабжение
мышечных волокон кислородом.
18.3. Оксиметры и пульсоксиметры
Еще в 30-х – 40-х годах ХХ в. начались разработки оксиметров – приборов для неинвазивного (без взятия пробы крови) измерения насыщения крови кислородом [
[
25
]
]. Их действие основано на специфических спектрах поглощения молекул гемоглобина, которые переносят кислород из лёгких ко всем частям тела и входят в состав эритроцитов – красных кровяных телец крови. В альвеолах легких молекулы гемоглобина (  ) химически присоединяют к себе кислород, превращаясь на оксигемоглобин (
) химически присоединяют к себе кислород, превращаясь на оксигемоглобин ( 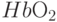 ). С потоком крови они попадают в разные органы и биологические ткани тела, где молекулы
). С потоком крови они попадают в разные органы и биологические ткани тела, где молекулы 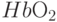 диссоциируют, отдают кислород окружающим клеткам и превращаются в восстановленный гемоглобин
диссоциируют, отдают кислород окружающим клеткам и превращаются в восстановленный гемоглобин  .
.
Этот процесс должен быть беспрерывным потому, что без постоянного поступления кислорода клетки быстро теряют способность функционировать и отмирают. Особенно болезненно реагируют на недостачу кислорода нервные клетки головного мозга. Таким образом, функции, выполняемые в организме человека молекулами гемоглобина, без всяких натяжек, жизненно важны. И показатель насыщения крови кислородом является чрезвычайно важным.
18.3.1. Спектры поглощения разных форм гемоглобина
Спектры поглощения разных форм гемоглобина показаны на
рис.
18.8. По горизонтали здесь отложена длина волны света в нанометрах (нм), а по вертикали – десятичный логарифм молярного коэффициента поглощения.
Обычно в крови в значительных количествах присутствуют лишь оксигемоглобин и восстановленный гемоглобин. Спектры этих форм гемоглобина, как видно из
рис.
18.8, на некоторых участках заметно отличаются. Сильное поглощение обеими этими формами гемоглобина фиолетового (380-450 нм), синего (450-480 нм), голубого (480-510 нм), зеленого (510-550 нм) света придают крови красную окраску. А существенно разное поглощение оксигемоглобином и восстановленным гемоглобином красного света (620-760 нм) предопределяет разные оттенки цвета артериальной (насыщенной кислородом) и венозной крови. Это различие и позволило создать интеллектуальные оксиметры, предназначенные для неинвазивного измерения насыщенности крови кислородом.
Рис.
18.8.
Спектры поглощения разных форм гемоглобина: 1 – восстановленный гемоглобин (Hb); 2 – оксигемоглобин (HbО2); 3 – карбоксигемоглобин (HbCO); 4 – метгемоглобин (Hi) при рН = 7,2; 5 – цианметгемоглобин (HiCN); 6 – сульфогемоглобин (SHb); 7 – карбоксисульфогемоглобин (SHbCO)
18.3.2. Принцип действия оксиметров
Выбирают 2 разные длины волны: одну, которую называют “опорной” или “референтной”, – в той области спектра, где 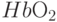 и
и  поглощают свет одинаково слабо, например, при
поглощают свет одинаково слабо, например, при 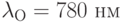 ; вторую, “измерительную”, – в том спектральном интервале, где коэффициенты поглощения молекул
; вторую, “измерительную”, – в том спектральном интервале, где коэффициенты поглощения молекул 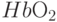 и
и  значительно отличаются, например, при
значительно отличаются, например, при  . Если сквозь какую-то часть тела, например, сквозь мочку уха или сквозь палец пропустить пучок света, в котором имеются спектральные составляющие указанных длин волны, то при прохождении сквозь тело составляющая с “измерительной” длиной волны поглощается сильнее.
. Если сквозь какую-то часть тела, например, сквозь мочку уха или сквозь палец пропустить пучок света, в котором имеются спектральные составляющие указанных длин волны, то при прохождении сквозь тело составляющая с “измерительной” длиной волны поглощается сильнее.
И на выходе из тела она оказывается значительно слабее, чем “опорная” спектральная составляющая. Интенсивность “измерительной” составляющей к тому же тем меньше, чем ниже уровень насыщения крови кислородом. Измерение и сравнение спектральных интенсивностей указанных составляющих и позволяет количественно определить насыщенность крови кислородом.
Проведем количественный расчет. Спектральная интенсивность света на выходе из тела согласно законам (18.7, 18.9) на длине волны 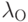 (в опорном канале) составляет
(в опорном канале) составляет
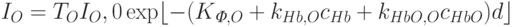 | ( 18.10) |
и на длине волны  (в измерительном канале) –
(в измерительном канале) –
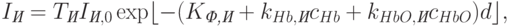 | ( 18.11) |
где 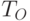 и
и 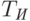 – пропускание кожи на длинах волны
– пропускание кожи на длинах волны  и
и  соответственно;
соответственно;
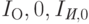 – спектральные интенсивности светового зонда при входе в тело на длине волны
– спектральные интенсивности светового зонда при входе в тело на длине волны  и
и  соответственно;
соответственно;
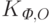 и
и 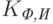 – коэффициенты “фонового” поглощения света, т.е. поглощения всеми компонентами ткани тела, кроме гемоглобина и оксигемоглобина, на длине волны
– коэффициенты “фонового” поглощения света, т.е. поглощения всеми компонентами ткани тела, кроме гемоглобина и оксигемоглобина, на длине волны  и
и  соответственно;
соответственно;
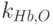 и
и  – молярные коэффициенты поглощения восстановленного гемоглобина на длине волны
– молярные коэффициенты поглощения восстановленного гемоглобина на длине волны  и
и  соответственно;
соответственно;
 и
и  – молярные коэффициенты поглощения оксигемоглобина на длинах волны
– молярные коэффициенты поглощения оксигемоглобина на длинах волны  и
и  соответственно;
соответственно;
 и
и  – молярные концентрации восстановленного гемоглобина и оксигемоглобина в ткани тела;
– молярные концентрации восстановленного гемоглобина и оксигемоглобина в ткани тела;
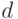 – длина пути света в ткани.
– длина пути света в ткани.
Логарифмируя выражения (18.10) и (18.11) и преобразуя их, получаем
![k_{Hb,O}c_{Hb}+k_{HbO,O}c_{HbO}= [ln(T_OI_{O,0}/I_O)-K_{textit{Ф,О}}]/d;](https://www.intuit.ru/sites/default/files/tex_cache/066feb14b99c1208474f06db5bbb10e3.png) | ( 18.12) |
![k_{Hb,textit{И}}c_{Hb}+k_{HbO,textit{И}}c_{HbO}= [ln(T_{textit{И}}I_{textit{И},0}/I_{textit{И}})-K_{textit{Ф,И}}]/d.](https://www.intuit.ru/sites/default/files/tex_cache/9725243d731080376f5142fdab404904.png) | ( 18.13) |
Полученные выражения можно рассматривать как систему двух линейных алгебраических уравнений относительно концентраций  и
и  .
.
Кислородную насыщенность крови (или насыщение крови кислородом) количественно определяют как отношение концентрации молекул оксигемоглобина к общей концентрации молекул гемоглобина и обычно выражают в %.
Решая систему (18.12-18.13), находим кислородную насыщенность крови в исследуемом участке тела
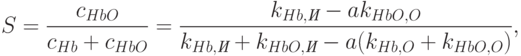 | ( 18.14) |
где
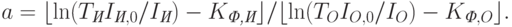 | ( 18.15) |
Здесь 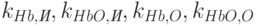 – константы, которые являются характеристиками молекул гемоглобина и оксигемоглобина;
– константы, которые являются характеристиками молекул гемоглобина и оксигемоглобина; 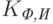 и
и 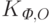 – константы, являющиеся характеристиками других компонент живой ткани;
– константы, являющиеся характеристиками других компонент живой ткани; 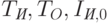 и
и 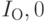 – константы прибора. Величины
– константы прибора. Величины 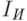 и
и  измеряются.
измеряются.
Как видим, в расчетные формулы не входит длина пути d света в ткани, поскольку при отношении концентраций она сокращается. Это очень важно, поскольку длина пути 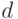 света в ткани не является здесь фиксированной, так как толщина пальца или мочки уха у разных людей разная. Таким образом, определение не абсолютной, а относительной концентрации вещества, как в данном случае, существенно упрощает задачу построения медицинского спектрофотометрического сенсора.
света в ткани не является здесь фиксированной, так как толщина пальца или мочки уха у разных людей разная. Таким образом, определение не абсолютной, а относительной концентрации вещества, как в данном случае, существенно упрощает задачу построения медицинского спектрофотометрического сенсора.
Наличие микрокомпьютера позволило быстро выполнять все необходимые вычисления в самом сенсоре и выдавать пользователю найденный уровень насыщения крови кислородом в удобной для врача форме – в процентах.
