Спектр поглощения гемоглобина и его производных

УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «ГОСУДАРСТВЕННАЯ
ОБЩЕОБРАЗОВАТЕЛЬНАЯ СРЕДНЯЯ ШКОЛА № 28 Г. ВИТЕБСКА»
СПЕКТРЫ ПОГЛОЩЕНИЯ ГЕМОГЛОБИНА И ЕГО
ПРОИЗВОДНЫХ У ЖИВОТНЫХ
Исполнители:
Шустова О.С., Савицкая Т.В., 9 «Б» класс
Научные руководители:
Баран В.П., кандидат биологических наук, доцент УО «Витебская ордена «Знак почета» государственная академия ветеринарной медицины»
Баран Е.Н., учитель биологии
Хвалько Н.Г., учитель физики
2008 г.
Цель: Исследование спектров поглощения гемоглобина и его производных у различных видов животных.
Задачи: 1)Определение содержания гемоглобина в крови животных; 2) Определение спектров поглощения оксигемоглобина, дезоксигемоглобина и метгемоглобина в крови кролика, овцы, теленка.
Гемоглобин – это глобулярный белок способный связывать и переносить молекулярный кислород. Гемоглобин является основным компонентом эритроцитов теплокровных животных. Он является основным компонентом эритроцитов высших животных. В одном эритроците содержится около 280 миллионов молекул гемоглобина, каждая из которых состоит примерно из 10 тысяч атомов водорода, углерода, азота, кислорода, серы и железа. Молекулярная масса гемоглобина человека равна 68000
Гемоглобин относят к сложным белкам, в составе которого в качестве небелковой части выступает порфириновое ядро гемма, которое связано с белком глобином. Гемм по строению одинаков у различных видов животных, а видовые различия гемоглобина связаны со строением глобина.
Основная функция гемоглобина – обратимое связывание молекулярного кислорода и доставка его во все клетки организма и связывание углекислого газа в тканях и его транспортировка к легким. В состоянии покоя в крови растворяется до 200 мл кислорода в минуту. При сильных физических нагрузках количество растворенного кислорода увеличивается в 10 раз до 2-3 л в минуту. В среднем грамм гемоглобина поглощает до 1,34 мл кислорода.
Гемоглобин – представитель гемопротеинов, т.е. группы сложных белков. Молекула его состоит из четырех субъединиц – двух α и двух β- субъединиц. Полипептидная цепь каждой из субъединиц специфическим образом уложена вокруг большого плоского железосодержащего гема. Все четыре цепи гемоглобина сходны между собой по форме. Форма и функция гемоглобинов различных животных сходны, однако аминокислотный состав их различается и тем сильнее, чем дальше эволюционно они удалены друг от друга.
Гем только в связи с нативным глобином способен лабильно связывать кислород. При поглощении кислорода β-цепи гемоглобина сближаются, при отдаче его – расходятся. Положение α-цепей при этом не меняется. Следовательно, присоединение и отдача кислорода молекулой гемоглобина сопровождается изменением его структуры, что приводит к изменению спектра поглощения гемоглобина. Присоединив молекулу кислорода, гемоглобин переходит в оксигенированную форму (HbO2) [2.503,585].
При присоединении к молекуле гемоглобина углекислого газа образуется карбоксигемоглобин. Таким образом, углекислый газ переносится от тканей к легким. Если на гемоглобин подействовать сильными окислителями (оксидами азота, парами нитробензола и другим сильными окислителями) он превращается в метгемоглобин (HbOH). В метгемоглобине железо находится в трехвалентном состоянии, в то время как в восстановленном и в оксигенированном гемоглобине – в двухвалентном. Метгемоглобин вне организма образуется при длительном выдерживании на воздухе растворов оксигемоглобина. Каждая форма гемоглобина характеризуется определенным спектром поглощения, представляющим собой зависимость оптической плотности раствора гемоглобина от длины волны света.
По литературным данным наиболее интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая порфириновой части его молекулы. По изменению положения и интенсивности поглощения этой полосы можно судить о структурных изменениях молекул различных форм гемоглобина (таблицу 1).
Спектры поглощения различных форм гемоглобина применяются в клинической практике при выявлении отравлений у человека и животных, а также в судебной медицинской и ветеринарной практике.
Таблица 1- Спектральные характеристики различных форм гемоглобина человека
α-полоса | β-полоса | Полоса Соре | ||||
λ, нм | ελ , М–1см-1 | λ, нм | ελ , М–1см-1 | λ, нм | ελ , М–1см-1 | |
Оксигемоглобин | 577 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоглобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Материалы и методы исследований. Для проведения исследований использовали венозную кровь кролика, овцы, теленка, стабилизированную гепарином, растворенным в 0,85% растворе хлорида натрия. Схема эксперимента состояла из четырех этапов: 1)Определение содержания гемоглобина в крови животных; 2) Определение спектров поглощения оксигемоглобина, дезоксигемоглобина и метгемоглобина. Материалом для исследований служила цельная стабилизированная кровь кролика, овцы, теленка, гемолизаты эритроцитов.
Исследование содержания гемоглобина в крови животных проводили гемиглобинцианидным методом с использованием наборов НТПК «Анализ Х». Стабилизированную кровь добавляли к 5 мл трансформирующего раствора. В интервале 10-45 минут содержание гемоглобина определяли фотометрией на фотоэлектроколориметре КФК-3 при длине волны 540 нм против трансформирующего раствора. Определение спектров поглощения проводили в гемолизатах крови животных, приготовленных из эритроцитарной суспензии. Для получения эритроцитарной суспензии стабилизированную кровь центрифугировали в течение 20 минут при 3000 об/мин. Полученную плазму отбирали, проводили четырехкратную отмывку эритроцитов 0,85% раствором NaCl с последующим центрифугированием. Гемолиз эритроцитов проводили дистиллированной водой. Восстановленный гемоглобин получали добавлением к раствору оксигемоглобина насыщенного раствора сульфата аммония. Раствор метгемоглобина – добавлением раствора железосинеродистого калия. Исследование спектров поглощения различных форм гемоглобина проводили в его растворах с конечным разведением 1:25. Спектры поглощения снимали на спектрофотометре СФ-46 в интервале длин волн 380-600 нм.
Собственные исследования. В результате исследования содержания гемоглобина в крови животных было установлено, что уровень гемоглобина в крови овцы 136,35 г/л, теленка -106,01 г/л, кролика-100,75 г/л и находился в пределах физиологической нормы.
Рисунок 1.- Содержание гемоглобина в крови различных сельскохозяйственных животных
Исследование спектров поглощения показало, что оксигемоглобин кролика максимальную оптическую плотность проявлял при 415, 540 и 580 нм (рис. 2). В тоже время оксигемоглобин теленка аналогичные свойства проявлял при 400,420,540 и 580 нм. Спектры поглощения оксигемоглобина овцы имели ряд особенностей, поскольку максимум оптической плотности проявлялся в интервале 410-420 нм, а также при 540 и 580 нм. Обращает на себя внимание сходность спектров поглощения всех исследованных животных при высоких длинах волн. В тоже время существенные различия проявляются в интервале 400-420 нм, что связано со свойствами и строением белковой молекулы.
Рисунок 2.-Спектры поглощения оксигемоглобина у различных видов сельскохозяйственных животных
При исследовании спектров поглощения восстановленного гемоглобина (рис. 3) было установлено, что дезоксигемоглобин кролика имел максимумы поглощения в интервале 410-420 нм, а также при 540 и 580 нм. Оптическая плотность восстановленного гемоглобина овцы была максимальной при 415, 540, 580 нм. Спектры поглощения восстановленного гемоглобина теленка имели ряд особенностей. Обращает на себя внимание примерно сходные высокие величины оптической плотности в интервале 400-420 нм, пики при 540 и 580 нм, и минимальным значением оптической плотности при 520 нм, чего не регистрировалось у других животных.
В результате исследования спектров поглощения метгемоглобина (рис.4) кролика было выявлено, что максимумы поглощения проявлялись при 415, 540, 580 нм и минимум поглощения – при 500 нм. Метгемоглобин овцы проявлял максимальные значения оптической плотности в интервале 410-415 нм, а также при 535 нм, имел минимальные значения при 580 нм. Метгемоглобин теленка характеризовался двумя интервалами максимумов оптической плотности при 400-420 нм и 535-540нм, при этом регистрировался минимум поглощения при 580 нм.
Рисунок 3.-Спектры поглощения восстановленного гемоглобина различных видов сельскохозяйственных животных
Рисунок 4.-Спектры поглощения метгемоглобина различных видов сельскохозяйственных животных
Выводы:
1.Наиболее значимые различия по спектрам поглощения окси- и дезоксигемоглобина выявлены в интервале 410-425 нм. Максимумы поглощения окси- и дезоксигемоглобина кролика и овцы при 415нм, теленка-420 нм. Спектры поглощения гемоглобина и дезоксигемоглобина у животных в зелено-желтой части спектра сходны.
2. Метгемоглобин животных имеет более широкий диапазон спектров поглощения, что выражается в наличии интервалов долин волн со сходной оптической плотностью.
Список использованной литературы:
1.Павленко, Ю.Г.Физика /Ю.Г. Павленко. -М.:Джангар,2001
2. Березов, Т.Т. Биологическая химия: учебник / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – 704 с.
3.Элементарный учебник физики /Под ред Г.С. Ландберга.-М.:Наука, 1966.4.Рубина, А.Б. Биофизика /А.Б. Рубина.-М.: Высшая школа, 1987.
Лабораторная работа №22
Изучение оптических свойств
различных форм гемоглобина
Каждая форма гемоглобина
характеризуется определенным спектром поглощения, представляющим собой зависимость
оптической плотности раствора гемоглобина от длины волны света. Наиболее
интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая
порфириновой части его молекулы (рис. 5).
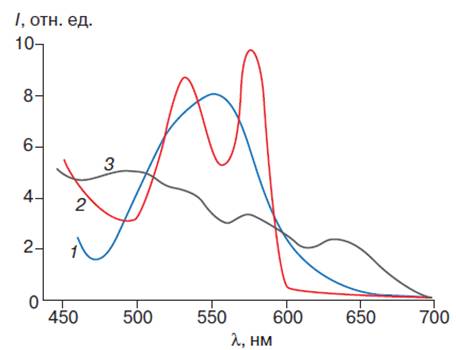
Рис. 5. Спектр поглощения
производных гемоглобина. Спектры поглощения дезоксигемоглобина (1),
оксигемоглобина (2) и ферригемоглобина (3)
По изменению положения и
интенсивности поглощения этой полосы можно судить о структурных изменениях
молекул различных форм гемоглобина (табл. 22).
Таблица 22
Спектральные характеристики различных форм
гемоглобина
Формы гемоглобина | α-Полоса | β-Полоса | Полоса | |||
λ, | ελ, | λ, | ελ, | λ, | ελ, | |
Оксигемоглобин | 557 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоголобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Оборудование
и материалы. СФ-(46) или другой спектрофотометр,
центрифуга на 9000 об/мин, центрифужные пробирки, кюветы, пенициллиновые
флаконы, пипетки Пастера, прибор для получения оксида углерода, гемоглобин кристаллический,
хлористый натрий, гепарин, бихромат калия, феррицианид калия, дитионит натрия.
Получение
раствора оксигемоглобина. Для работы рекомендуется использовать
свежеприготовленные растворы гемоглобина. Кровь берут у декапитированных животных.
Цельную кровь стабилизируют гепарином, растворенным в 0,85%-ном растворе
хлористого натрия. Для отделения плазмы стабилизированную кровь центрифугируйте
в течение 10 мин при 3000 об/мин. Плазму крови отберите пипеткой. К эритроцитам
добавьте трехкратный объем 0,85%-ного раствора хлористого натрия, осторожно при
этом размешивая суспензию стеклянной палочкой. Суспензию центрифугируйте в течение
5 мин при 6000 об/мин. Промойте эритроциты 3 раза. Промытые эритроциты
подвергните гемолизу дистиллированной водой в течение 20 мин. Стромы осадите центрифугированием
при 9000 об/мин в течение 15 мин. В прозрачном гемолизате определите содержание
гемоглобина с помощью приведенного в работе № 20 метода.
Ход
анализа
Регистрация
спектра поглощения оксигемоглобина. Раствор
оксигемоглобина разбавьте дистиллированной водой до оптической плотности
раствора, попадающей в диапазон 0,4-0,5. Снимите спектр поглощения раствора
оксигемоглобина в интервале длин волн 380-600 нм (оптическая плотность раствора
измеряется через каждые 5 нм).
Регистрация
спектра поглощения метгемоглобина. Добавьте к раствору
оксигемоглобина 1-2 капли насыщенного раствора феррицианида калия. Визуально
оцените изменение окраски. Раствор метгемоглобина имеет коричневую окраску.
Снимите спектр поглощения раствора гемоглобина в интервале длин волн 380-600
нм. Для компенсации светопоглощения за счет феррицианида в контроль добавьте
такой же объем раствора этого вещества, какой был добавлен к раствору
оксигемоглобина.
Регистрация
спектра поглощения метгемоглобина. Добавьте к водному
раствору оксигемоглобина несколько кристаллов дитионита натрия (Na2S2O4).
Визуально оцените изменение окраски. Ярко алая окраска (цвет оксигемоглобина)
переходит в синевато-красную, характерную для гемоглобина. Снимите спектр
поглощения раствора в интервале длин волн 380-600 нм.
ЗАДАНИЕ
1. Представьте в графическом виде
зависимость оптической плотности различных состояний гемоглобина от длины
поглощаемого света (спектр поглощения), откладывая по оси ординат оптическую
плотность раствора, а по оси абсцисс соответствующие длины волн.
2. Найдите минимумы и максимумы
поглощения гемоглобинов и сделайте вывод.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Щуплова Е.А.
1
Фадеев С.Б.
1
1 Институт клеточного и внутриклеточного симбиоза, Уральское отделение РАН (ИКВС УрО РАН)
Цель работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности. Материал и методы. Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры проб (сканирующий спектрофотометр «Genesys 5», США), состоящих из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В работе использовались 30 штаммов стафилококков, обладающих антигемоглобиновой активностью. Результаты. Под влиянием супернатантов штаммов стафилококков происходило снижение оптической плотности проб, содержащих гемолизат эритроцитов, в диапазонах 220-450 нм. Наиболее выраженное снижение оптической плотности происходило под действием супернатантов штаммов с высокой антигемоглобиновой активностью (р
спектральный анализ
бактерии
гемоглобин
эритроциты
1. Артюхов В.Г., Вашанов Г.А., Козлова И.Е. УФ-чувствительность димеров гемоглобина в свободном состоянии и в составе гибридов валентности: модификация серотонином // Радиационная биология. Радиоэкология. – 2001. – Т. 41, № 2. – С. 190-194.
2. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Взаимодействие бактерий и эритроцитов // Журн. микробиол. – 2005. – № 4. – С. 89-96.
3. Бухарин О.В., Усвяцов Б.Я., Ханина Е.А. Определение антигемоглобиновой активности микроорганизмов : патент России № 2262705.2005. Бюл. № 19.
4. Икрянникова С.В. Влияние экологических факторов на антиоксидантный статус и спектральные характеристики гемоглобина жителей промышленного города : дис. … канд. биол. наук. – Оренбург, 2006. – 119 с.
5. Ланг Т.А., Сесик М. Как описывать статистику в медицине. Аннотированное руководство для авторов, редакторов и рецензентов / пер. с англ. под ред. В.П. Леонова. – М. : Практическая медицина, 2011. – 480 с. : ил.
6. Путинцева О.В., Артюхов В.Г., Калаева Е.А. Оценка степени фотоповреждения хромофоров гемового и глобинового компонентов УФ-облученных молекул и электрофоретических фракций карбоксигемоглобина человека // Радиационная биология. Радиоэкология. – 2000. – Т. 40, № 4. – С. 439-445.
7. Справочник по микробиологическим и вирусологическим методам исследования / М.О. Биргер. – М. : Медицина, 1982. – 462 с.
8. Byrne D.P. Role of the cysteine protease interpain A of Prevotella intermedia in breakdown and release of hem from hemoglobin // J. Biochemistry. – 2010. – Vol. 425. – P. 257–264.
9. Perutz M.F., Heedner E.J., Zadner J.E. et al. Influence of globin structure on the state of the heme III changes in heme spectra accompanying allosteric transitions in methemoglobin and their implications for heme-heme interaction // J. Biochemistry. – 1974. – Vol. 13. – P. 2187-2200.
10. Pishchany G., Skaar E. P. Taste for Blood: Hemoglobin as a Nutrient Source for Pathogens // PLoS Pathogens. – 2012. – V. 8. – P. 1-4.
Введение
Гемоглобин эритроцитов представляет собой гетерогенную систему, включающую не только его производные (сульфгемоглобин, метгемоглобин, цианметгемоглобин), но и ряд продуктов необратимой окислительной деградации гемоглобина, причем соотношение между компонентами этой системы может меняться под воздействием различных экзогенных и эндогенных факторов. На молекулярном уровне эти изменения могут вызывать конформационные перестройки четвертичной структуры белковой части гемоглобина, влиять на состояние его простетической группы, изменять спиновое состояние гемового железа, степень его окисления (образования метгемоглобина), а также влиять на структурно-функциональные системы эритроцита [6]. Данные процессы взаимосвязаны и могут снижать сродство тетрамерной молекулы гемоглобина к кислороду, что в конечном итоге способствует развитию тканевой гипоксии и связанных с ней клеточных повреждений [4]. При развитии инфекционных процессов, сопровождающихся бактериемией, может наблюдаться феномен инвазии микроорганизмов внутрь эритроцитов [2]. При этом между эритроцитами, а точнее консолидированными компонентами крови и бактериями может происходить конкурентная борьба за гемовое железо, являющееся важным компонентом биохимических процессов, обеспечивающих рост, размножение бактериальных клеток и образование факторов патогенности [10]. Особенности влияния микроорганизмов на систему гемоглобина изучены недостаточно.
Цель настоящей работы – спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности.
Материал и методы
В работе использовали 30 клинических штаммов рода Staphylococcus (виды: S.epidermidis, S.saprophyticus, S.cohni и др.), выделенные из очагов гнойно-воспалительных заболеваний различной локализации [7], из них 15 штаммов с высоким уровнем (>3 г/л) антигемоглобиновой активности [3] и 15 – с низким (<3 г/л).
Для оценки влияния микроорганизмов на гемоглобин определяли оптические спектры пробы (сканирующий спектрофотометр «Genesys 5», США), состоящей из 2 мл супернатанта суточной исследуемой культуры штамма и 0,5 мл взвеси отмытых донорских эритроцитов человека (в концентрации 106 кл/мл) через 2, 6 и 24 ч с момента приготовления указанной пробы. В качестве контрольной использовали пробу, состоящую из 2 мл мясо-пептонного бульона (МПБ) и 0,5 мл взвеси эритроцитов в той же концентрации. Исследования проводили при постоянном температурном режиме 37 °С. Для проведения каждого измерения 0,5 мл исследуемой пробы смешивали с 0,5 мл дистиллированной воды с целью гемолиза эритроцитов. Оптическую плотность (ОП) определяли в диапазоне 450-700 нм. Полученные данные трактовали как изменение гемовой части гемоглобина [9]. Для оценки изменений в белковой части гемоглобина, вышеуказанную часть пробы дополнительно разводили дистиллированной водой в 2 раза и определяли оптическую плотность исследуемого раствора в диапазоне 220-450 нм [9].
Для оценки спектральных параметров метгемоглобина рассчитывали разностные спектры, которые строили относительно модельного спектра, содержащего оксигемоглобин [4]. Для нивелирования отличий спектральных характеристик, обусловленных разной концентрацией гемоглобина в пробах, вычисляли разностные спектры по нормированным спектрам относительно поглощения проходящего света с длиной волны 576 нм [6]. При оценке полученных графиков анализировали точки (диапазоны длин волн), соответствующие частотным интервалам поглощения проходящего света метгемоглобином и различными аминокислотами. Частотные интервалы метгемоглобина составляли для видимой области спектра: 502-505; 538-542; 560-565; 619-620; 629-632 нм и для ультрафиолетовой части спектра – 252; 268-272; 408-415 [4].
Полученные результаты были подвергнуты статистической обработке в компьютерной оболочке Windows с помощью процессора электронных таблиц Microsoft Office Excel 2007 c вычислением средней арифметической (M); средней ошибки (m); критерия значимости (t) Стьюдента. Различия считались значимыми (достоверными) при р<0,05 [5].
Результаты исследования
На первом этапе спектрального анализа гемоглобина под действием супернатантов исследуемых штаммов было установлено, что после 2 часов инкубации проб регистрировалось повышение значений оптической плотности в спектральном диапазоне (230-450 нм), соответствующем белковой части гемоглобина. При этом наибольшие значения ОП (0,130±0,001 ед.) регистрировались под действием штаммов с высоким уровнем АнтиНbА при длине волны 252 нм, что соответствует спектру поглощения ароматических аминокислот. При действии супернатантов штаммов с низким уровнем АнтиНbА, при равных условиях, значения ОП исследуемых проб (0,037±0,001 ед. ОП; р<0,05) было в 3,5 раза меньше. В контрольной пробе показания оптической плотности стремились к 0 (в сравнении с разностными спектрами), что свидетельствовало об отсутствии конформационных перестроек в белковой части гемоглобина.
При оценке спектра ОП контрольной и опытных проб через 6 ч инкубации с эритроцитами особое внимание обращали на диапазоны 246-270 нм, соответствующие полосам поглощения света аминокислотами белковой части гемоглобина и 398-422 нм – характерных для «порфиринового кармана». Показания оптической плотности проб в диапазоне, соответствующем аминокислотам (246-270 нм), под действием штаммов с высоким уровнем АнтиНbА снижались до отрицательных значений (рис. 1). Это может свидетельствовать о том, что гемовая часть в молекуле гемоглобина становится менее «защищенной» белковой структурой гемоглобина. Под действием штаммов с низким уровнем АнтиНbА наблюдали менее выраженное понижение значений оптической плотности проб в аналогичном интервале до -0,137±0,003 ед. ОП, однако в диапазоне 271-350 нм ОП увеличивалась до 0,225±0,002 ед. Такое изменение оптической плотности под действием штаммов с низким уровнем АнтиНbА свидетельствует о конформационных перестройках в белковой части гемового кармана. В контрольной пробе в диапазонах 254-366 нм (область, характерная для задержки проходящего света ароматическими и серосодержащими аминокислотами) значения ОП также оставались близкими к 0, т.е. структурные изменения белковой части гемоглобина не происходили. Под действием штаммов с высоким уровнем АнтиНbА в диапазоне 398-422 нм наблюдали снижение ОП до уровня -0,198±0,002 ед. При увеличении длины волны проходящего света регистрировалось повышение ОП этой же пробы до значения 0,063±0,006 ед. ОП (р<0,05). Такая существенная разница, по-видимому, свидетельствует о том, что наибольшие значения оптической плотности, соответствующие гемовой части гемоглобина, «смещаются» из коротковолновой в длинноволновую часть спектра. Данные изменения, вероятнее всего, связаны с тем, что микроорганизмы, изменяя белковую часть гемоглобина, затрагивают «порфириновый карман», где в гемовой части может происходить окисление железа, реализующееся в увеличении доли метгемоглобина в исследуемых пробах.
Под действием штаммов с низким уровнем АнтиНbА наблюдали аналогичные изменения ОП, которые характеризовались более низкими значениями: от -0,134±0,001 до 0,045±0,001 ед., свидетельствующие о меньшем воздействии на «порфириновый карман» и накоплении метгемоглобина.
При анализе спектральных характеристик опытных проб через 24 ч инкубации супернатантов исследуемых штаммов с эритроцитами наблюдали незначительное волнообразное изменение ОП, что говорило о дальнейших конформационных изменениях в белковой части гемоглобина. В контрольной пробе в диапазонах 230-290 нм наблюдали отрицательные значения оптической плотности.

Рисунок 1 – Изменения спектров белковой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (6 ч инкубации)
Второй этап исследований заключался в проведении спектрального анализа гемоглобина под действием супернатантов исследуемых культур в видимой области спектра (450-700 нм), позволяющего оценить долю образовавшегося метгемоглобина (МetHb). Через 2 ч инкубации происходило более выраженное увеличение оптической плотности опытных проб при длине волны проходящего света 560 нм (спектр поглощения, характерный для метгемоглобина) под действием штаммов с высоким уровнем АнтиНbА, чем с низким (0,024±0,001 против 0,019±0,001 ед. ОП; р<0,05; при пересчете на долю метгемоглобина – 6% против 4%). В контрольной пробе через 2 часа выявлялись отрицательные значения спектральных параметров полос поглощения света (при 502 нм – -0,025±0,001 ед. ОП; при 630 нм – -0,020±0,001 ед. ОП), что свидетельствует о снижении уровня метгемоглобина.
В ходе спектральной оценки образования метгемоглобина (при соответствующей длине волны проходящего света 502 нм) было установлено, что ОП проб после шестичасовой инкубации эритроцитов с супернатантами штаммов с высокой АнтиНbА характеризовались большими значениями, чем после воздействия на эритроциты штаммов с низким уровнем АнтиНbА (0,144±0,003 ед. ОП против – 0,063±0,002 ед. ОП, р<0,05; при пересчете на долю образующего метгемоглобина оказалось 9% против 4%). Спектральная оценка при длине волны 562 нм показала, что влияние штаммов с высоким уровнем АнтиНbА на образование метгемоглобина привело к большему снижению оптической плотности проб (0,032±0,001 ед. ОП; в пересчете на долю метгемоглобина – 8%), чем при воздействии изолятов с низким уровнем АнтиНbА (0,040±0,001 ед. ОП; при пересчете на долю метгемоглобина – 10%). Продолжение измерений при большей длине волны 632 нм выявило, что штаммы с высоким уровнем АнтиНbА, напротив, повышали оптическую плотность проб (0,070±0,004 ед. ОП; 9% МеtHb), по сравнению со штаммами, обладающими низким уровнем АнтиНbА (0,047±0,001 ед. ОП; р<0,05; 5% – МеtHb). В контрольной пробе значения спектральных параметров гемоглобина оказались отрицательными, что свидетельствует о наименьшем образовании метгемоглобина.
После 24 ч инкубации опытных проб наблюдали наиболее выраженные изменения значений спектров, соответствующих метгемоглобину, под действием штаммов с высоким уровнем АнтиНbА, чем с низким уровнем данного свойства (рис. 2). 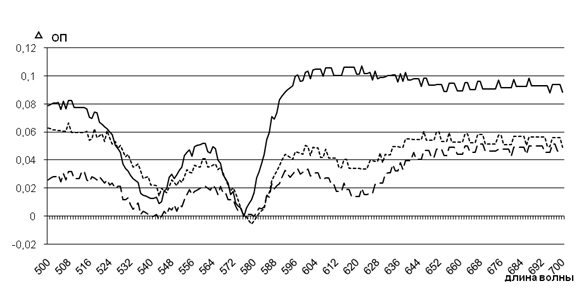
![]() – – – контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
– – – контроль штамм с высоким уровнем АнтиНbА ——— штамм с низким уровнем АнтиНbА
Рисунок 2 – Изменения спектров гемовой части гемоглобина в эритроцитах под действием супернатантов исследуемых штаммов (24 ч инкубации)
При длине волны 619 нм наблюдали максимальные значения оптической плотности спектров проб под действием штаммов с высоким уровнем АнтиНbА, что в 3,1 раза выше, чем спектральные параметры проб под действием штаммов с низким уровнем данного свойства (0,106±0,001 против 0,034±0,001 ед. ОП; р<0,05), что указывает на значимое повышение долей метгемоглобина (в 3,3 раза, 13% против 4% соответственно). Спектральные характеристики контрольной пробы показали незначительное повышение оптической плотности полос поглощения света, что при пересчете на долю метгемоглобина составило 2-2,2%.
Обсуждение полученных результатов
Инфекционные процессы, сопровождающиеся транзиторной или постоянной бактериемией, как правило, клинически характеризуются развитием гипохромной анемии. Однако только в последние годы стало уделяться внимание взаимодействию гемоглобина и бактерий. Как известно, гемоглобин обладает антимикробным действием [2]. С другой стороны, микроорганизмы содержат широкий спектр средств защиты от факторов неспецифической противоинфекционной резистентности, в том числе и антигемоглобиновую активность [2]. Важным моментом во взаимодействии микроорганизмов с эритроцитами является возможность получения гемового железа при внутриклеточном персистировании.
В настоящей работе показано, что продукты жизнедеятельности стафилококков могут вызывать конформационные изменения белковой части гемоглобина, делая для бактерий доступным «порфириновый карман», содержащий собственно гем. Причем стафилококки с высоким уровнем АнтиНbА нарушают белковую структуру гемоглобина в большей степени, чем микроорганизмы с низкими показателями активности. Следующий момент воздействия бактерий на гемоглобин заключается в повышении доли его производного – метгемоглобина, содержащего не двух-, а трехвалентные ионы железа. Неспособность метгемоглобина рыхло и обратимо связывать кислород в конечном итоге может быть одним из факторов развития тканевой гипоксии. При этом штаммы с высоким уровнем АнтиНbА более «успешны», под их действием доля метгемоглобина увеличивается до 13%, тогда как под влиянием стафилококков с низкой АнтиНbА доля метгемоглобина через 6 часов инкубации достигает 10%, а к 24-м часам снижается до 4%. В последнем случае трансформация гемоглобина носит отчасти обратимый характер. В целом полученные результаты раскрывают первые этапы взаимодействия микроорганизмов с эритроцитами человека – нарушение конформационной структуры белковой части гемоглобина, «открытие» порфиринового кармана, переход оксигемоглобина в метгемоглобин. Все это дает возможность бактериям захватывать железо непосредственно из гема и использовать его для собственного бактериального метаболизма. Аналогичные результаты были получены зарубежными авторами при изучении влияния протеазы Prevotella intermedia на образование метгемоглобина [8]. В других работах были показаны изменения в молекуле гемоглобина под действием УФ-света, также приводящие к повышению образования метгемоглобина [1; 6].
Таким образом, спектральный анализ структуры гемоглобина под действием микроорганизмов с разным уровнем антигемоглобиновой активности показал, что продукты жизнедеятельности бактерий способны нарушать конформационную структуру белковой части гемоглобина, а также влиять на гем, увеличивая долю метгемоглобина.
Авторы выражают благодарность к.б.н. Икрянниковой С.В. и д.м.н., профессору Красикову С.И. (кафедра медицинской и фармацевтической химии ОрГМА) за помощь в проведении исследований.
Рецензенты:
Карташова О.Л., д.б.н., профессор кафедры микробиологии и заразных болезней ФГБОУ ВПО «Оренбургский государственный аграрный университет», г. Оренбург.
Чайникова И.Н., д.м.н., профессор кафедры микробиологии, иммунологии и вирусологии ФГБОУ ВПО «Оренбургская медицинская академия», г. Оренбург.
Библиографическая ссылка
Щуплова Е.А., Фадеев С.Б. СПЕКТРАЛЬНЫЙ АНАЛИЗ ГЕМОГЛОБИНА ПОД ДЕЙСТВИЕМ МИКРООРГАНИЗМОВ С РАЗНЫМ УРОВНЕМ АНТИГЕМОГЛОБИНОВОЙ АКТИВНОСТИ // Современные проблемы науки и образования. – 2013. – № 2.;
URL: https://science-education.ru/ru/article/view?id=8791 (дата обращения: 28.10.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
