Спектры поглощения соединения гемоглобина
Лабораторная работа №22
Изучение оптических свойств
различных форм гемоглобина
Каждая форма гемоглобина
характеризуется определенным спектром поглощения, представляющим собой зависимость
оптической плотности раствора гемоглобина от длины волны света. Наиболее
интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая
порфириновой части его молекулы (рис. 5).

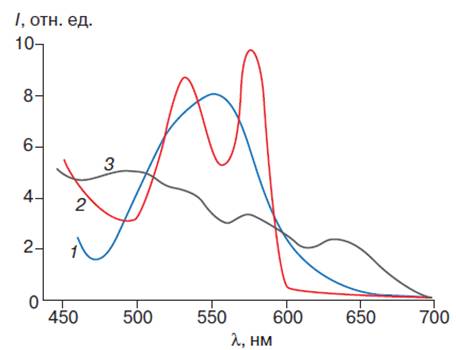
Рис. 5. Спектр поглощения
производных гемоглобина. Спектры поглощения дезоксигемоглобина (1),
оксигемоглобина (2) и ферригемоглобина (3)
По изменению положения и
интенсивности поглощения этой полосы можно судить о структурных изменениях
молекул различных форм гемоглобина (табл. 22).
Таблица 22
Спектральные характеристики различных форм
гемоглобина
Формы гемоглобина | α-Полоса | β-Полоса | Полоса | |||
λ, | ελ, | λ, | ελ, | λ, | ελ, | |
Оксигемоглобин | 557 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоголобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Оборудование
и материалы. СФ-(46) или другой спектрофотометр,
центрифуга на 9000 об/мин, центрифужные пробирки, кюветы, пенициллиновые
флаконы, пипетки Пастера, прибор для получения оксида углерода, гемоглобин кристаллический,
хлористый натрий, гепарин, бихромат калия, феррицианид калия, дитионит натрия.
Получение
раствора оксигемоглобина. Для работы рекомендуется использовать
свежеприготовленные растворы гемоглобина. Кровь берут у декапитированных животных.
Цельную кровь стабилизируют гепарином, растворенным в 0,85%-ном растворе
хлористого натрия. Для отделения плазмы стабилизированную кровь центрифугируйте
в течение 10 мин при 3000 об/мин. Плазму крови отберите пипеткой. К эритроцитам
добавьте трехкратный объем 0,85%-ного раствора хлористого натрия, осторожно при
этом размешивая суспензию стеклянной палочкой. Суспензию центрифугируйте в течение
5 мин при 6000 об/мин. Промойте эритроциты 3 раза. Промытые эритроциты
подвергните гемолизу дистиллированной водой в течение 20 мин. Стромы осадите центрифугированием
при 9000 об/мин в течение 15 мин. В прозрачном гемолизате определите содержание
гемоглобина с помощью приведенного в работе № 20 метода.
Ход
анализа
Регистрация
спектра поглощения оксигемоглобина. Раствор
оксигемоглобина разбавьте дистиллированной водой до оптической плотности
раствора, попадающей в диапазон 0,4-0,5. Снимите спектр поглощения раствора
оксигемоглобина в интервале длин волн 380-600 нм (оптическая плотность раствора
измеряется через каждые 5 нм).
Регистрация
спектра поглощения метгемоглобина. Добавьте к раствору
оксигемоглобина 1-2 капли насыщенного раствора феррицианида калия. Визуально
оцените изменение окраски. Раствор метгемоглобина имеет коричневую окраску.
Снимите спектр поглощения раствора гемоглобина в интервале длин волн 380-600
нм. Для компенсации светопоглощения за счет феррицианида в контроль добавьте
такой же объем раствора этого вещества, какой был добавлен к раствору
оксигемоглобина.
Регистрация
спектра поглощения метгемоглобина. Добавьте к водному
раствору оксигемоглобина несколько кристаллов дитионита натрия (Na2S2O4).
Визуально оцените изменение окраски. Ярко алая окраска (цвет оксигемоглобина)
переходит в синевато-красную, характерную для гемоглобина. Снимите спектр
поглощения раствора в интервале длин волн 380-600 нм.
ЗАДАНИЕ
1. Представьте в графическом виде
зависимость оптической плотности различных состояний гемоглобина от длины
поглощаемого света (спектр поглощения), откладывая по оси ординат оптическую
плотность раствора, а по оси абсцисс соответствующие длины волн.
2. Найдите минимумы и максимумы
поглощения гемоглобинов и сделайте вывод.
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «ГОСУДАРСТВЕННАЯ
ОБЩЕОБРАЗОВАТЕЛЬНАЯ СРЕДНЯЯ ШКОЛА № 28 Г. ВИТЕБСКА»
СПЕКТРЫ ПОГЛОЩЕНИЯ ГЕМОГЛОБИНА И ЕГО
ПРОИЗВОДНЫХ У ЖИВОТНЫХ
Исполнители:
Шустова О.С., Савицкая Т.В., 9 «Б» класс
Научные руководители:
Баран В.П., кандидат биологических наук, доцент УО «Витебская ордена «Знак почета» государственная академия ветеринарной медицины»
Баран Е.Н., учитель биологии
Хвалько Н.Г., учитель физики
2008 г.
Цель: Исследование спектров поглощения гемоглобина и его производных у различных видов животных.
Задачи: 1)Определение содержания гемоглобина в крови животных; 2) Определение спектров поглощения оксигемоглобина, дезоксигемоглобина и метгемоглобина в крови кролика, овцы, теленка.
Гемоглобин – это глобулярный белок способный связывать и переносить молекулярный кислород. Гемоглобин является основным компонентом эритроцитов теплокровных животных. Он является основным компонентом эритроцитов высших животных. В одном эритроците содержится около 280 миллионов молекул гемоглобина, каждая из которых состоит примерно из 10 тысяч атомов водорода, углерода, азота, кислорода, серы и железа. Молекулярная масса гемоглобина человека равна 68000
Гемоглобин относят к сложным белкам, в составе которого в качестве небелковой части выступает порфириновое ядро гемма, которое связано с белком глобином. Гемм по строению одинаков у различных видов животных, а видовые различия гемоглобина связаны со строением глобина.
Основная функция гемоглобина – обратимое связывание молекулярного кислорода и доставка его во все клетки организма и связывание углекислого газа в тканях и его транспортировка к легким. В состоянии покоя в крови растворяется до 200 мл кислорода в минуту. При сильных физических нагрузках количество растворенного кислорода увеличивается в 10 раз до 2-3 л в минуту. В среднем грамм гемоглобина поглощает до 1,34 мл кислорода.
Гемоглобин – представитель гемопротеинов, т.е. группы сложных белков. Молекула его состоит из четырех субъединиц – двух α и двух β- субъединиц. Полипептидная цепь каждой из субъединиц специфическим образом уложена вокруг большого плоского железосодержащего гема. Все четыре цепи гемоглобина сходны между собой по форме. Форма и функция гемоглобинов различных животных сходны, однако аминокислотный состав их различается и тем сильнее, чем дальше эволюционно они удалены друг от друга.
Гем только в связи с нативным глобином способен лабильно связывать кислород. При поглощении кислорода β-цепи гемоглобина сближаются, при отдаче его – расходятся. Положение α-цепей при этом не меняется. Следовательно, присоединение и отдача кислорода молекулой гемоглобина сопровождается изменением его структуры, что приводит к изменению спектра поглощения гемоглобина. Присоединив молекулу кислорода, гемоглобин переходит в оксигенированную форму (HbO2) [2.503,585].
При присоединении к молекуле гемоглобина углекислого газа образуется карбоксигемоглобин. Таким образом, углекислый газ переносится от тканей к легким. Если на гемоглобин подействовать сильными окислителями (оксидами азота, парами нитробензола и другим сильными окислителями) он превращается в метгемоглобин (HbOH). В метгемоглобине железо находится в трехвалентном состоянии, в то время как в восстановленном и в оксигенированном гемоглобине – в двухвалентном. Метгемоглобин вне организма образуется при длительном выдерживании на воздухе растворов оксигемоглобина. Каждая форма гемоглобина характеризуется определенным спектром поглощения, представляющим собой зависимость оптической плотности раствора гемоглобина от длины волны света.
По литературным данным наиболее интенсивной полосой в спектре поглощения гемоглобина является полоса Соре, принадлежащая порфириновой части его молекулы. По изменению положения и интенсивности поглощения этой полосы можно судить о структурных изменениях молекул различных форм гемоглобина (таблицу 1).
Спектры поглощения различных форм гемоглобина применяются в клинической практике при выявлении отравлений у человека и животных, а также в судебной медицинской и ветеринарной практике.
Таблица 1- Спектральные характеристики различных форм гемоглобина человека
α-полоса | β-полоса | Полоса Соре | ||||
λ, нм | ελ , М–1см-1 | λ, нм | ελ , М–1см-1 | λ, нм | ελ , М–1см-1 | |
Оксигемоглобин | 577 | 14600 | 542 | 13800 | 412 | 135000 |
Дезоксигемоглобин | 555 | 13500 | 430 | 119000 | ||
Карбоксигемоглобин | 569 | 13400 | 539 | 13400 | 419 | 191000 |
Материалы и методы исследований. Для проведения исследований использовали венозную кровь кролика, овцы, теленка, стабилизированную гепарином, растворенным в 0,85% растворе хлорида натрия. Схема эксперимента состояла из четырех этапов: 1)Определение содержания гемоглобина в крови животных; 2) Определение спектров поглощения оксигемоглобина, дезоксигемоглобина и метгемоглобина. Материалом для исследований служила цельная стабилизированная кровь кролика, овцы, теленка, гемолизаты эритроцитов.
Исследование содержания гемоглобина в крови животных проводили гемиглобинцианидным методом с использованием наборов НТПК «Анализ Х». Стабилизированную кровь добавляли к 5 мл трансформирующего раствора. В интервале 10-45 минут содержание гемоглобина определяли фотометрией на фотоэлектроколориметре КФК-3 при длине волны 540 нм против трансформирующего раствора. Определение спектров поглощения проводили в гемолизатах крови животных, приготовленных из эритроцитарной суспензии. Для получения эритроцитарной суспензии стабилизированную кровь центрифугировали в течение 20 минут при 3000 об/мин. Полученную плазму отбирали, проводили четырехкратную отмывку эритроцитов 0,85% раствором NaCl с последующим центрифугированием. Гемолиз эритроцитов проводили дистиллированной водой. Восстановленный гемоглобин получали добавлением к раствору оксигемоглобина насыщенного раствора сульфата аммония. Раствор метгемоглобина – добавлением раствора железосинеродистого калия. Исследование спектров поглощения различных форм гемоглобина проводили в его растворах с конечным разведением 1:25. Спектры поглощения снимали на спектрофотометре СФ-46 в интервале длин волн 380-600 нм.
Собственные исследования. В результате исследования содержания гемоглобина в крови животных было установлено, что уровень гемоглобина в крови овцы 136,35 г/л, теленка -106,01 г/л, кролика-100,75 г/л и находился в пределах физиологической нормы.
Рисунок 1.- Содержание гемоглобина в крови различных сельскохозяйственных животных
Исследование спектров поглощения показало, что оксигемоглобин кролика максимальную оптическую плотность проявлял при 415, 540 и 580 нм (рис. 2). В тоже время оксигемоглобин теленка аналогичные свойства проявлял при 400,420,540 и 580 нм. Спектры поглощения оксигемоглобина овцы имели ряд особенностей, поскольку максимум оптической плотности проявлялся в интервале 410-420 нм, а также при 540 и 580 нм. Обращает на себя внимание сходность спектров поглощения всех исследованных животных при высоких длинах волн. В тоже время существенные различия проявляются в интервале 400-420 нм, что связано со свойствами и строением белковой молекулы.
Рисунок 2.-Спектры поглощения оксигемоглобина у различных видов сельскохозяйственных животных
При исследовании спектров поглощения восстановленного гемоглобина (рис. 3) было установлено, что дезоксигемоглобин кролика имел максимумы поглощения в интервале 410-420 нм, а также при 540 и 580 нм. Оптическая плотность восстановленного гемоглобина овцы была максимальной при 415, 540, 580 нм. Спектры поглощения восстановленного гемоглобина теленка имели ряд особенностей. Обращает на себя внимание примерно сходные высокие величины оптической плотности в интервале 400-420 нм, пики при 540 и 580 нм, и минимальным значением оптической плотности при 520 нм, чего не регистрировалось у других животных.
В результате исследования спектров поглощения метгемоглобина (рис.4) кролика было выявлено, что максимумы поглощения проявлялись при 415, 540, 580 нм и минимум поглощения – при 500 нм. Метгемоглобин овцы проявлял максимальные значения оптической плотности в интервале 410-415 нм, а также при 535 нм, имел минимальные значения при 580 нм. Метгемоглобин теленка характеризовался двумя интервалами максимумов оптической плотности при 400-420 нм и 535-540нм, при этом регистрировался минимум поглощения при 580 нм.
Рисунок 3.-Спектры поглощения восстановленного гемоглобина различных видов сельскохозяйственных животных
Рисунок 4.-Спектры поглощения метгемоглобина различных видов сельскохозяйственных животных
Выводы:
1.Наиболее значимые различия по спектрам поглощения окси- и дезоксигемоглобина выявлены в интервале 410-425 нм. Максимумы поглощения окси- и дезоксигемоглобина кролика и овцы при 415нм, теленка-420 нм. Спектры поглощения гемоглобина и дезоксигемоглобина у животных в зелено-желтой части спектра сходны.
2. Метгемоглобин животных имеет более широкий диапазон спектров поглощения, что выражается в наличии интервалов долин волн со сходной оптической плотностью.
Список использованной литературы:
1.Павленко, Ю.Г.Физика /Ю.Г. Павленко. -М.:Джангар,2001
2. Березов, Т.Т. Биологическая химия: учебник / Т.Т. Березов, Б.Ф. Коровкин. – М.: Медицина, 1998. – 704 с.
3.Элементарный учебник физики /Под ред Г.С. Ландберга.-М.:Наука, 1966.4.Рубина, А.Б. Биофизика /А.Б. Рубина.-М.: Высшая школа, 1987.
Гемоглобин выполняет, в организме важную роль переносчика
кислорода и принимает участие в транспорте углекислоты.
Гемоглобин представляет собой сложное химическое соединение
(молекулярный вес 68 800). Он состоит из белка глобина и четырех молекул гема.
Молекула гема, содержащая атом железа, обладает способностью соединять и
отдавать молекулу кислорода. При этом валентность железа, к которому
присоединяется кислород, не изменяется, т. е. железо остается двухвалентным.
Если обработать гемоглобин раствором соляной кислоты, то от
глобина отщепляется гем. Вступая в соединение с соляной кислотой, он
превращается в гемин
(С34Н32N4O4FeCl), образующий
кристаллы характерной формы. Проба на образование гемина производится для
доказательства присутствия крови при судебномедицинских исследованиях.
В состав молекулы гема входят четыре пиррольных кольца (два из них имеют
характер щелочи, а два – кислоты). Атом железа, содержащийся в геме, связывает
гем с белковой частью глобином. Если гем теряет атом железа, а пирроловая его
структура сохраняется, то получается гематопорфирин. Это вещество в больших
количествах образуется в организме при некоторых отравлениях или нарушениях
обмена и может выделяться с мочой.
Гем является активной, или так называемой простатической, группой
гемоглобина, а глобин — белковым носителем гема. Гемоглобин, присоединивший
кислород, превращается в оксигемоглобин (его обозначают символом
НbO2). Оксигемоглобин, отдавший кислород, называется восстановленным,
или редуцированным, гемоглобином (Нb). Оксигемоглобин, гемоглобин и
некоторые другие соединения и производные гемоглобина дают характерные полосы
поглощения лучей спектра.
Так, пропуская луч света через раствор оксигемоглобина, можно Рис. 5. Спектры поглощения оксигемоглобина (сверху) и Оксигемоглобин несколько отличается по цвету от гемоглобина, поэтому |
Значительно большее поглощение световых лучей с длиной волны 620—680 ммк
гемоглобином по сравнению с оксигемоглобином легло в основу методики измерения
степени насыщения крови кислородом — оксигемометрии. При этой методике ушную
раковину или кювету с кровью просвечивают небольшой электрической лампой и
определяют с помощью фотоэлемента интенсивность светового потока указанной длины
волны, проходящего через ткань уха или кювету с кровью. По показаниям
фотоэлемента определяют степень насыщения гемоглобина кислородом.
Кровь взрослых людей содержит в среднем 14—15% гемоглобина (у мужчин
13,5—16%, у женщин 12,5—14,5%). Общее содержание гемоглобина равно примерно 700
г.
В эмбриональном периоде в крови человека имеются разные типы гемоглобина,
отличающиеся способностью присоединять кислород в некоторыми другими химическими
свойствами. Для определения и разделения разных типов гемоглобина применяют
методику измерения оптической плотности растворов гемоглобина до и после
денатурации его едкой щелочью. Разные типа гемоглобина условно обозначают НbA,
HbF, НbР, Гемоглобин НbР встречается только в первые 7—12 недель внутриутробного
развития зародыша. На 9-й неделе появляется в крови зародыша гемоглобин HbF и
гемоглобин взрослых НbA. Существенно важным представляется тот факт, что
эмбриональный гемоглобин HbF обладает более высоким сродством к кислороду и
может насыщаться на 60% при таком напряжении кислорода, когда гемоглобин матери
насыщается всего на 30%. У разных видов позвоночных животных имеются различия в
структуре гемоглобина. Гем разных типов гемоглобина при этом одинаков, глобины
же различаются по своему аминокислотному составу.
В организме постоянно происходит синтез и распад гемоглобина, связанные с
образованием и разрушением эритроцитов. Синтез гемоглобина совершается в
эритробластах красного костного мозга. При разрушении эритроцитов, которое
происходит в ретикуло-эндотелиальной системе, главным образом в печени и
селезенке, из красных кровяных клеток выходит гемоглобин. В результате
отщепления железа от гема и последующего окисления образуется из гемоглобина
пигмент билирубин, который затем с желчью выделяется в кишечник, где
превращается в стеркобилин и уробилин, которые выводятся с калом и мочой. За
сутки разрушается и превращается в желчные пигменты около 8 г гемоглобина, т. е.
несколько более 1 %.
В организме человека и животных могут образовываться и другие соединения
гемоглобина, при спектральном анализе которых обнаруживаются характерные спектры
поглощения. К числу таких соединений гемоглобина относятся метгемоглобин и
карбокенгемоглобин. Вещества эти образуются в результате некоторых
отравлений.
Метгемоглобин (MetHb) представляет собой прочное соединение
гемоглобина с кислородом; при образовании метгемоглобина меняется валентность
железа: двухвалентное железо, входящее в молекулу гемоглобина, превращается в
трехвалентное. В случае накопления в крови больших количеств метгемоглобина
отдача кислорода тканям становится невозможной и наступает смерть от
удушення.
Метгемоглобин отличается от гемоглобина коричневым цветом и наличием полосы
поглощения в красной части спектра. Метгемоглобин образуется при действии
сильных окислителей: феррицианида (красной кровяной соли), марганцовокислого
калия, амил- и пропилнитрита, анилина, бертолетовой соли, фенацетина.
Карбоксигемоглобин (НbСО) представляет собой соединение железа
гемоглобина с окисью углерода (СО) — угарным газом. Это соединение примерно в
150—300 раз прочнее, чем соединение гемоглобина с кислородом. Поэтому примесь
даже 0,1 % угарного газа во вдыхаемом воздухе ведет к тому, что 80% гемоглобина
оказываются связанными окисью углерода и не присоединяют кислород, что является
опасным для жизни.
Слабое отравление угарным газом — обратимый процесс. Прп дыхании свежим
воздухом СО постепенно отщепляется от карбоксигемоглобнна и
выделяется.
Вдыхание чистого кислорода увеличивает скорость расщепления
карбоксигемоглобина в 20 раз. В тяжелых случаях отравления необходимо
искусственное дыхание (стр. 171) газовой смесью с 95% содержания 02 и 5% СО2, а
также переливание крови.
Миоглобин. В скелетной и сердечной мышце находится мышечный
гемоглобин, называемый миоглобином. Его простетическая группа — гем — идентична
этой же группе молекулы гемоглобина, а белковая часть — глобин — обладает
меньшим молекулярным весом, чем белок гемоглобина.
Миоглобин человека способен связывать до 14% от общего количества кислорода в
организме. Это его свойство играет важную роль в снабжении кислородом работающих
мышц. Если при сокращении мышцы кровеносные капилляры ее сжимаются и кровоток в
некоторых участках мышцы прекращается, то все же благодаря наличию кислорода,
связанного с миоглобином, в течение некоторого времепп сохраняется снабжение
мышечных волокон кислородом.
