Стенокардия на фоне анемии
Ишемическая болезнь сердца (ИБС) – патология, в основе которой лежит поражение миокарда, обусловленное недостаточным его кровоснабжением. Атеросклеротическое сужение коронарных артерий является патогенетической основой ИБС, но для развития ишемии миокарда требуется еще дополнительный фактор, ведущий к нарушению баланса пропускной способности коронарных артерий и потребности миокарда в кислороде.
Чаще всего это увеличение работы ЛЖ (тахикардия, повышение систолического АД) или недостаточность коронарного кровотока (тромбообразование в венечных артериях, спазм). Реже как факторы, способствующие развитию или прогрессированию ИБС, рассматриваются снижение перфузионного давления (ДАД) или нарушение кислород-транспортной функции крови и т. д.
Для наглядности приводим выписки из историй болезни пациентов, у которых эти факторы играли роль «запускающего механизма». Мнение о том, что штаны принято носить только мужчинам, а женщины должны быть утонченные и элегантные, отдавая предпочтение юбкам и платьям, в нынешнее время абсолютно не актуально.
Клинический случай 1
Больной Ш., 84 года, был госпитализирован в мае 2013 г. с жалобами на давящие боли за грудиной при небольшой физической нагрузке и в покое.
Более 30 лет регистрируются высокие цифры АД (до 200/120 мм рт. ст.), сахарный диабет 2-го типа.
4 мес. назад перенес острый инфаркт миокарда без зубца Q боковой стенки левого желудочка. При коронарографии: передняя межжелудочковая ветвь (ПМЖВ) левой коронарной артерии (ЛКА) стенозирована в проксимальной трети на 50%, в дистальной трети — последовательные стенозы 30–50%; огибающая артерия (ОА) стенозирована в средней трети на 70%, правая коронарная артерия (ПКА) субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Выполнено стентирование средней трети ОА. Реканализацию ПКА выполнить не удалось.
Обращено внимание на наличие гипохромной анемии легкой степени (гемоглобин -106 г/л). Проведенное обследование возможного источника кровотечения не выявило. Выписан в удовлетворительном состоянии с рекомендацией приема ацетилсалициловой кислоты и клопидогрела, сахароснижающей терапии, препаратов железа.
Дома рекомендованные препараты принимал нерегулярно, врача не посещал.
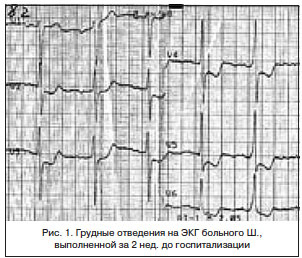
Около 2 мес. назад отметил нарастание слабости. Стали беспокоить редкие приступы загрудинных болей. На ЭКГ от 10.05.13 г.: на фоне синусового ритма с ЧСС 75 уд./мин — выраженная депрессия сегмента ST в отведениях V2-6 (рис. 1). От предложенной госпитализации отказался.
Последние 2 нед. участились приступы загрудинных болей давящего характера, они стали возникать при минимальной физической нагрузке и в покое, сублингвальный прием нитроглицерина оказывал кратковременное действие, появилось чувство нехватки воздуха. Обратился в поликлинику, откуда был доставлен в ЦКБ с диагнозом «ИБС, прогрессирующая стенокардия».
При поступлении: кожные покровы бледные. Отеков нет. ЧД — 18 в 1 мин. Дыхание жесткое. Пульс — 72, АД — 140/70 мм рт. ст. на обеих руках. Систолический шум в точке Боткина и на верхушке, проводящийся в левую подмышечную область.
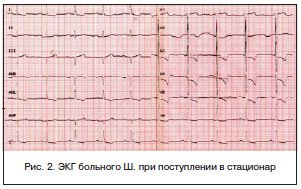
ЭКГ при поступлении (рис. 2): синусовый ритм с ЧСС 59 уд./мин, замедление атриовентрикулярной проводимости (PQ — 0,24 с). Замедление проводимости по левому предсердию и желудочку. Гипертрофия левого желудочка. Нарушение реполяризации в V2-5.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 240 г). Утолщение межжелудочковой перегородки (МЖП), более выраженное в базальной части (1,6–1,8 см), без признаков обструкции выходного отдела ЛЖ. Толщина ЗСЛЖ — 1,5 см. Сократительная способность миокарда ЛЖ удовлетворительная (ФВ по Тейхольцу — 63%), КСР — 3,6 см, КДР — 5,5 см, ЛП — 5,1 см. Зон нарушенной кинетики не выявлено. Изменение диастолической функции ЛЖ по первому типу.
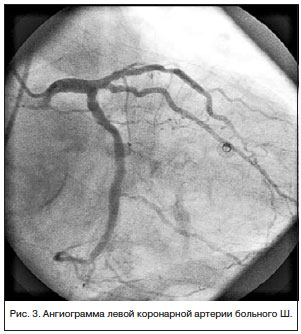
В экстренном порядке выполнена коронароангиография (КАГ) (рис. 3): ствол ЛКА не изменен. ПМЖВ стенозирована на границе передней и средней третей на 50%, на протяжении дистальной трети — последовательные стенозы 30–60%. 1ДВ — анатомически некрупная, стенозирована в устье на 80%, окклюзирована в средней трети, дистальная часть слабо контрастируется по интерартериальным коллатералям. ВТК стенозирована в устье до 50%. ОВ анатомически крупная, проходима на всем протяжении, ранее имплантированные стенты — без стенотических изменений. ПКА субокклюзирована в передней трети, окклюзирована в средней трети, дистальная часть слабо контрастируется по меж- и интраартериальным анастомозам. Сбалансированный тип коронарного кровоснабжения.

Учитывая отсутствие динамики стенозов-КА по сравнению с КАГ от января 2013 г., чрескожное коронарное вмешательство не проводилось.
В анализе крови: гемоглобин — 61 г/л, эритроциты — 2,30×10*12, ЦП — 0,8, гематокрит — 18,5, лейкоциты — 7,7×10*9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
В анализе мочи: удельный вес — 1020, белок — 0,15, лейкоциты — 0–5 в поле зрения, эритроциты — 100–150 в поле зрения.
Дополнительный целенаправленный расспрос позволил выяснить, что на протяжении последних 4 мес. неоднократно были эпизоды выделения темно-красной мочи, иногда длившиеся по несколько дней (макрогематурия?).
Убедительных данных, говорящих об остром очаговом поражении миокарда, на момент госпитализации не получено. Учитывая наличие анемии тяжелой степени, произведена трансфузия отмытых эритроцитов (1150 мл за 2 сут) с положительным эффектом: уровень гемоглобина повысился до 100 г/л, число эритроцитов — до 3,59×10*12, гематокрит — до 29,4.
На ЭКГ через 1 сут после последней гемотранфузии отмечается нормализация конечной части желудочковых комплексов в грудных отведениях (в V4 — зубец Т слабоотрицательный).
Самочувствие пациента значительно улучшилось: в течение последующих 3 сут при расширении двигательного режима до уровня физических нагрузок, соответствующих 3 функциональному классу, боли в грудной клетке не возникали, выраженность одышки существенно уменьшилась, объем нагрузок ограничивался главным образом мышечной утомляемостью. Эпизоды макрогематурии не повторялись. В удовлетворительном состоянии больной переведен для дообследования в урологическое отделение.
Клинический случай 2
Больной К., 50 лет, госпитализирован в стационар в декабре 2014 г. с клиникой прогрессирования стенокардии напряжения, одышки, возникающих при минимальной физической нагрузке, в покое, с нарастанием общей слабости в течение последнего месяца.
В анамнезе: АГ с максимально известными значениями АД 200/100 мм рт. ст. давностью более 15 лет; регулярно принимает антигипертензивные препараты, однако контроль АД нерегулярный. В 2002 г. перенес ОИМ, в этом же году выполнено аортокоронарное шунтирование (АКШ) ПМЖА, ПКА, ОА. В 2009 г. развилась клиника прогрессирующей стенокардии, в связи с чем выполнено стентирование шунта к ОВ ЛКА. В мае 2014 г. — повторный ОИМ задней стенки левого желудочка, проводился системный тромболизис, чрескожное коронарное вмешательство с реканализацией и стентированием АКШ к ОА. После выписки и до настоящей госпитализации — состояние стабильное.
Сопутствующие заболевания: сахарный диабет 2-го типа, мочекаменная болезнь, хронический геморрой, железодефицитная анемия легкой степени регистрируется с 2009 г. (препараты железа не принимал).
При поступлении: кожные покровы бледные, сухие. ЧД — 18 уд./мин. Дыхание жесткое, небольшое количество свистящих хрипов на выдохе. Тоны сердца глухие. ЧСС -76 уд./мин. АД — 150/90 мм рт. ст. на обеих руках.
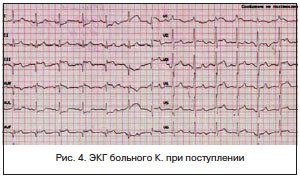
ЭКГ зарегистрирована на фоне болевого приступа (рис. 4): ритм синусовый, ЧСС — 88 уд./мин, смещение сегмента ST вверх от изолинии в отведениях III, aVF, V1. В отведениях I и aVL смещение сегмента ST книзу от изолинии. Зубец Q длительностью 0,04 с во II, III, aVF отведениях.
ЭхоКГ: гипертрофия миокарда ЛЖ (ММЛЖ — 213 г, МЖП — 1,5 см, ЗСЛЖ — 1,2 см). Дилатация левого предсердия (5,3×6,1 см). Нарушение диастолической функции левого желудочка по первому типу. Гипокинез диафрагмального, заднебазального и заднебоковых сегментов. ФВ — 54% по Тейхольцу.
В общем анализе крови: гемоглобин — 70 г/л, эритроциты — 4,29×10*12, гематокрит -23,5, ЦП — 0,48, гипохромия, анизоцитоз, пойкилоцитоз (овалоциты, мишеневидные эритроциты), лейкоциты — 5,9×10*9. Сывороточное железо — 1,9.
Кардиоспецифические ферменты (КФК МВ, тропонин Т) находились в пределах референсных значений.
Таким образом, убедительных данных, свидетельствующих об остром очаговом поражении миокарда, на момент госпитализации не получено. Высказано предположение, что причиной прогрессирования стенокардии являлась тяжелая железодефицитная анемия, вероятнее всего, постгеморрагическая. Проведена трансфузия эритроцитной взвеси 630 мл за первые сутки, начато парентеральное введение препаратов железа.
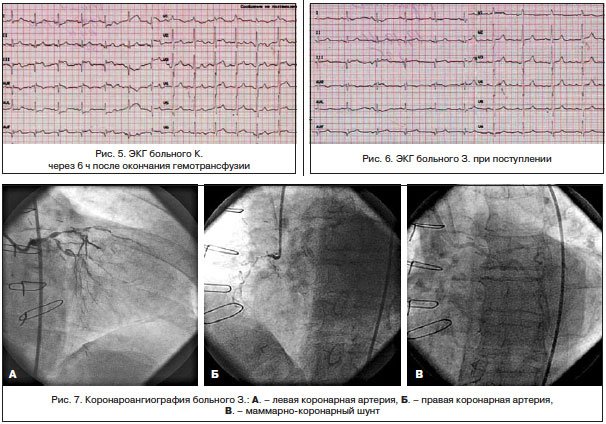
Трансфузионную терапию перенес хорошо. Ангинозные боли не рецидивировали. На ЭКГ, зарегистрированной после гемотрансфузии (рис. 5): ЧСС — 62 уд./мин. Сегмент ST вернулся к изолинии.
В анализе крови спустя 1 сут: уровень гемоглобина возрос до 105 г/л, число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, гипохромия, анизоцитоз сохраняются. Лейкоциты — 8×10*9.
В течение 3 сут пациент находился в ОРИТ, антиангинальной терапии не требовалось, т. к. приступы стенокардии не рецидивировали.
Проводился поиск возможного источника кровопотери, онкопоиск: при колоноскопии выявлен хронический комбинированный геморрой 3 ст. Другой патологии, которая могла бы объяснить наличие анемии, не найдено.
Проводилось постепенное расширение двигательного режима. Физические нагрузки, соответствующие уровню 3 функционального класса, приступов стенокардии и ЭКГ-признаков ишемии миокарда не вызывают.
Через 12 дней в стабильном состоянии пациент выписан для дальнейшего лечения в амбулаторных условиях. Хирургом рекомендовано выполнение в плановом порядке дезартеризации геморроидальных узлов под ультразвуковым контролем.
Клинический случай 3
Больной З., 82 года, госпитализирован в стационар с жалобами на дискомфорт за грудиной, нехватку воздуха, возникающие без четкой связи с физической нагрузкой, длительностью до 4–5 мин, накануне был затяжной приступ длительностью более 1 ч, выраженную слабость, потливость. Настоящее ухудшение состояния отмечает в течение последних 3 дней на фоне появившейся гипотонии.
В течение 2 нед. до госпитализации принимал по поводу дорсалгии нестероидные противовоспалительные препараты (НПВП) (кеторолак). 4 дня назад отметил появление учащенного жидкого стула темной окраски, необычно низкое АД — 80/40 мм рт. ст.
В 1995 г. перенес ОИМ нижней стенки ЛЖ. В этом же году выполнено маммарно-коронарное шунтирование ПМЖА, АКШ ЗБВ ОА и ПКА. В 2003 г. — линейное аортобедренное шунтирование синтетическим протезом слева. Ранний послеоперационный период осложнился развитием повторного ОИМ нижней стенки ЛЖ.
С 2009 г. — пароксизмы мерцательной тахиаритмии.
Постоянно принимает бисопролол — 2,5 мг/сут, периндоприл — 5 мг/сут, аторвастатин — 20 мг/сут, варфарин — 5 мг/сут. Контроль МНО не проводился более года.
При поступлении: кожные покровы и видимые слизистые бледные. Число дыханий — 20 в 1 мин. Дыхание ослабленное, жесткое. Тоны сердца глухие, ритмичные. ЧСС — 76 уд./мин. АД — 110/70 мм рт. ст.
Лабораторные данные: гемоглобин — 91 г/л, эритроциты — 3,93×10*12, гематокрит — 33,0, ЦП — 0,84, лейкоциты — 10,2–10,6×10*9, тромбоциты — 223×10*9, анизоцитоз, анизохромия.
Кардиоспецифические ферменты: КФК — 268 при поступлении, через 10 ч — 319, КФК МВ — 30 при поступлении, через 10 ч — 42, тропонин Т при поступлении — 177, через 10 ч — 538.
Сывороточное железо — 13 мкмоль, белки транспорта железа в границах нормы. Коагулограмма: АЧТВ — нет коагуляции, МНО — нет коагуляции, фибриноген — 3,3 г/л, Д-димер — 1147.
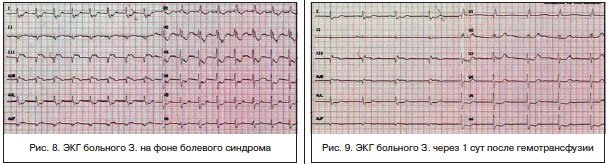
ЭКГ (рис. 6) при поступлении: синусовый ритм, АВ-блокада I ст., рубцовые изменения нижней стенки ЛЖ, смещение сегмента ST во II, III и avF отведениях, высокий R — в V1-2. Архив ЭКГ не предоставлен.
ЭхоКГ: склероз и кальциноз стенок аорты, кольца и створок АК. ММЛЖ — 204 г, толщина МЖП — 1,0 см, ЗСЛЖ — 1,0 см. Дилатация левых отделов сердца (ЛП — 4,5×5,5 см, левый желудочек: КСО — 92, КДО — 171). Относительная недостаточность МК II степени. Гипокинез среднего заднего и заднебокового сегментов ЛЖ. Снижение глобальной сократительной способности миокарда ЛЖ (ФВ по Тейхольцу — 47%). Диастолическая дисфункция левого желудочка первого типа.
С учетом жалоб, анамнеза, лабораторно-инструментальных данных у больного диагностирован повторный ОИМ диафрагмальной и заднебазальной локализации.
Не исключалось состоявшееся желудочно-кишечное кровотечение на фоне приема НПВП и орального антикоагулянта, в связи с чем экстренно выполнена ЭГДС: эндоскопические признаки хронического эзофагита, язва нижней трети пищевода Forrest II C. Острая язва желудка Forrest II B (без признаков продолжающегося кровотечения). Язва привратника Forrest I B (с признаками продолжающегося кровотечения). После эндоскопического инъекционного гемостаза кровотечение остановлено.
Причиной ОИМ, вероятно, явилась гипотония и анемия на фоне желудочно-кишечного кровотечения. Начата консервативная гемостатическая, противоязвенная терапия. От проведения КАГ с возможным чрескожным коронарным вмешательством решено воздержаться до стабилизации состояния.
На фоне лечения цифры АД стабилизировались на уровне 120/85 мм рт. ст., уровень гемоглобина повысился до 110 г/л, возросло число эритроцитов — до 5,71×10*12, гематокрит — 38,3, ЦП — 0,55, лейкоциты — 8×10*9, гипохромия, анизоцитоз сохраняются.
Уровень активности КФК снизился до 113 ед, МВ КФК — до 12,7, тропонина Т — до 225.
ЭГДС через 2 сут: язва нижней трети пищевода Forrest III, острая язва желудка Forrest III, язва привратника Forrest II С (отсутствие признаков кровотечения, появление в области дна фибрина).
На 3-й день пребывания в стационаре возобновились кратковременные приступы сжимающих болей за грудиной (2 приступа: во время приема пищи и при попытке сесть в кровати).
По экстренным показаниям выполнена коронароангиография (рис. 7): ствол ЛКА стенозирован на протяжении передней и средней трети до 70%, субокклюзирован в дистальной трети с переходом на устья ОВ и ПМЖВ; ПМЖВ субокклюзирована в устье, стенозирована в передней трети на 80%, окклюзирована в средней трети, дистальная часть контрастируется по функционирующему маммарно-коронарному шунту. ОВ субокклюзирована в устье, стенозирована в передней трети на 80%; ПКА субокклюзирована на протяжении передней и средней трети, окклюзирована на границе средней и дистальной третей, дистальная часть контрастируется по межартериальным анастомозам.
Правый тип коронарного кровоснабжения.
Маммарно-коронарный шунт из правой маммарной артерии в дистальной трети ПМЖВ проходим. Шунты к ОА и ПКА не визуализируются.
Попытка реканализации стенозированных артерий — без успеха в связи с выраженным кальцинозом.
В течение последующих суток — состояние с отрицательной динамикой: в виде учащения кратковременных приступов стенокардии, сопровождающихся выраженными ЭКГ-признаками ишемии миокарда (рис. 8). Отмечено снижение гемоглобина со 110 до 87 г/л, гематокрита — до 26,0.
Кардиоспецифические ферменты в пределах нормальных значений. ЭхоКГ: размер левых отделов сердца прежний, новых участков нарушения движений стенок ЛЖ не выявлено.
Гастроскопия: активное кровотечение из острого дефекта слизистой кардиоэзофагеального перехода (Forrest I). Эндоскопическая остановка кровотечения.
После переливания 600 мл эритроцитной взвеси состояние с положительной динамикой: ангинозные боли и ЭКГ-признаки ишемии миокарда не рецидивируют (рис. 9), восстановление уровня гемоглобина (110 г/л), эритроцитов (3,85×10*12), гематокрита -33,7.
При контрольной ЭГДС через 10 дней положительная динамика — уменьшение в размерах язвенных дефектов без признаков кровотечения.
На фоне терапии ингибиторами протонной помпы, β-блокаторами, клопидогрелом 75 мг/сут показатели красной крови стабильны, двигательный режим расширен и по уровню нагрузок соответствует 3 ФК.
ХМЭКГ: ритм синусовый, ЧСС (за сут/днем/ночью): 78/77/78 уд/мин, максимальная ЧСС — 99 уд/мин, минимальная — 64 уд/мин. Отмечается появление депрессии сегмента ST при увеличении ЧСС свыше 90 уд/мин.
Приведенные случаи демонстрируют возможность проявления коронарной недостаточности на фоне снижения кислород-транспортной способности крови как у пациентов с тяжелым, так и умеренным поражением коронарного русла. Устранение анемии во всех трех случаях способствовало повышению коронарного резерва и стабилизации состояния.
Давайте обратим внимание на анемию. Анемия (или как ранее называли – малокровие) – это синдром снижения концентрации гемоглобина в единице объема крови, нередко сочетающийся со снижением количества эритроцитов ниже нормы и сопровождающийся специфическими симптомами (головокружение, шум в ушах, головные боли, мелькание мушек перед глазами, слабость, утомляемость, снижение работоспособности, хроническая усталость, бледность кожи и слизистых, сердцебиение, одышка при незначительной физической нагрузке). Поскольку при сниженном гемоглобине ухудшается снабжение тканей организма кислородом с нарастанием анемии одышка усиливается. Чтобы компенсировать недостаток кислорода, сердце начинает работать активнее, что ведет к учащению пульса (тахикардии) и болям в сердце. В наиболее тяжелых случаях низкий уровень гемоглобина приводит к увеличению сердца и развитию сердечной недостаточности даже у тех, кто ранее не жаловался на проблемы с сердцем.
Если же у пациента есть заболевания сердечно-сосудистой системы, то анемия может только привести к ухудшению их состояния.
Многочисленными исследованиями установлено значение анемии как фактора риска неблагоприятного прогноза при различных формах ишемической болезни сердца, в частности, при остром коронарном синдроме и сердечной недостаточности. При остром инфаркте миокарда анемия сочетается с повышенным риском развития постинфарктной стенокардии, рецидивированием инфаркта миокарда, неблагоприятным течением кардиогенного шока и развитием более тяжелых проявлений сердечной недостаточности. Анемия, различной степени выраженности, является нередким спутником и хронической сердечной недостаточности, и только ухудшает прогноз этой группы пациентов.
Коррекция анемии может существенно облегчить симптомы при сердечно-сосудистых заболеваниях, а если у пациента нет фонового заболевания сердца, то при адекватном лечении наиболее распространенных форм анемии возможно и полностью устранить симптомы.
Узнать о том, есть ли у Вас анемия или нет, можно из общего анализа крови (проводимого во всех лабораториях).
Анемический синдром — нередкое явление среди коронарных больных, и в России ее встречаемость, по данным литературы, выше, чем в странах Запада [4]. Установлено существенное значение анемии как фактора риска неблагоприятного прогноза при различных формах ишемической болезни сердца (ИБС), в частности при остром коронарном синдроме и сердечной недостаточности [4, 6].
Различной степени выраженности анемия является нередким спутником хронической сердечной недостаточности (ХСН) [4, 8]. Частота такого сочетания колеблется от 10 до 79 %, в зависимости от возраста и пола больных, тяжести клинических проявлений, а также критериев диагностики анемии [4]. При остром инфаркте миокарда анемия сочетается с [3] повышенным риском развития постинфарктной стенокардии, рецидивированием инфаркта миокарда, неблагоприятным течением кардиогенного шока и развитием более тяжелых проявлений сердечной недостаточности после инфаркта миокарда [3]. Кроме того, анемический синдром считается одним из экстракардиальных механизмов, способствующих проявлению ишемической болезни сердца, в связи с чем считается целесообразным учитывать данный фактор при классификации нестабильной стенокардии [5].
Следует отметить, что анемия у стационарных больных с ишемической болезнью сердца не отражена как проблема ни в одном национальном руководстве. Данные о причинах развития анемического синдрома у коронарных больных немногочисленны и противоречивы. Потенциальными причинами развития анемического синдрома на фоне ИБС, в том числе, являются болезни желудочно-кишечного тракта, но исследованы они в этом контексте недостаточно.
В этой связи была поставлена задача: изучить взаимосвязь хронических заболеваний верхних отделов желудочно-кишечного тракта и анемии у стационарных больных с ишемической болезнью сердца.
Материалы и методы исследования
Исследование выполнено в два этапа. Первоначально были проанализированы истории болезни с результатами обследования 514 пациентов, которые последовательно поступили в кардиологический стационар за 2006-2008 год, по поводу проявлений и осложнений ишемической болезни сердца, средний возраст больных составил 55,6 ± 12 лет, из общего числа обследованных было 229 женщин.
Все пациенты получали консервативную терапию, основанную на рекомендациях ESC и ВНОК, в зависимости от формы заболевания.
Критерии исключения: опасные для жизни нарушения ритма, признаки развития острого или обострения хронического инфекционного заболевания, тяжелая по критериям ВОЗ анемия, сердечная недостаточность в III стадии, злокачественные новообразования, острая фаза или осложненное течение гастроэнтерологических заболеваний, перенесенное обострение подобного заболевания с явным или возможным кровотечением в последние 3 месяца, установленное хроническое заболевание почек, другие опасные для жизни заболевания и состояния, любые кровотечения в течение полугода.
Из общего числа пациентов у 142 в стационаре были выполнены эндоскопия верхних отделов пищеварительного тракта и ультразвуковое исследование органов брюшной полости по назначению лечащего врача. У этой категории больных нами учитывались наличие гастроэзофагеальной рефлюксной болезни (ГЭРБ), хронического эрозивного гастрита, язвенной болезни, хронического панкреатита и калькулезного холецистита, стеатоза печени. В значительном большинстве случаев диагноз подтверждался данными предыдущих инструментальных обследований и клинической картиной.
На втором этапе после предварительного анализа полученных первоначально данных проведено обследование 152 пациентов с ИБС, поступивших в клинику в 2009 году, женщин — 72, средний возраст 59,7 ± 11,1, из которых 78 наряду с ИБС отмечалась эндоскопически позитивная ГЭРБ. При отборе в данную группу, кроме вышеописанных критериев исключения, учитывались дополнительные: острый коронарный синдром, гемодинамически значимые аритмии, язвенная форма эзофагита.
ИБС подтверждалась наличием перенесенного Q-инфаркта миокарда, или типичной клиникой ИБС в совокупности с положительным результатом стресс-тестов и/или в совокупности с подтвержденными ЭКГ, в том числе при мониторировании, эпизодами ишемии миокарда, и/или нарушением локальной сократимости миокарда по данным эхокардиографии. У 68 % больных отмечалась артериальная гипертония, 54 % пациентов перенесли раний инфаркт миокарда, у 65 % — хроническая сердечная недостаточность II и у 10 % — III класса. Группы с наличием и отсутствием ГЭРБ были сопоставимы по тяжести кардиальной патологии, полу и возрасту.
В качестве контрольной группы использовались данные о 73 пациентах с эндоскопически позитивной ГЭРБ, не страдающих ИБС и другой тяжелой кардиальной патологией. Из них 37 женщин, средний возраст 56,2 ± 10,5. Учитывались результаты эндоскопии, в том числе катаральная, либо эрозивная форма ГЭРБ в соответствии с классификацией Savary-Miller [2], гематологические показатели, уровень железа в сыворотке крови. Использовали гематологический анализатор Beckman coulter Act 5 diff — (США) и биохимический анализатор HITACHY-911 (Япония). Анемия определялась по критериям ВОЗ как снижение уровня гемоглобина ниже 120 г/л у женщин и 130 г/л у мужчин [6, 8, 10].
Для статистической обработки применялся однофакторный и многофакторный дисперсионный (MANOVA) анализ, таблицы сопряженности с критериями хи-квадрат и Фишера, непараметрический корреляционный анализ. В качестве меры вариабельности использовалось среднее квадратичное отклонение (SD).
Результаты исследования и их обсуждение
Многофакторный анализ (MANOVA) показал, что независимыми статистически значимыми (p 12 / л
Из табл. 2 видно, что в целом у пациентов с комбинацией ИБС и ГЭРБ гемоглобин был несколько снижен, еще более низким был этот показатель у больных с сочетанием коронарной болезни сердца и эрозивной формы эзофагита. Среди подобных пациентов анемия встречалась в 35 %. Следует отметить, что среди пациентов с ГЭРБ без ИБС значимой взаимосвязи формы эзофагита и уровня гемоглобина не установлено.
Таблица 2
Показатели эритроцитов, гемоглобина крови и железа сыворотки в зависимости
от наличия ИБС и формы эзофагита при ГЭРБ (М ± SD). Результаты MANOVA
Как часто, занимаясь приготовлением тех или иных блюд, многие хозяйки стремятся накормить семью так, чтобы это было вкусно и полезно. Однако в чем, собственно, польза, нередко не знают. “Народная газета” обратилась к известному кардиологу кандидату медицинских наук Татьяне НЕЧЕСОВОЙ с просьбой рассказать, какое меню можно считать “сердечным” и попадали ли в поле зрения ученых продукты, полезные людям с сердечно-сосудистыми заболеваниями.
— И не раз! — вносит ясность ученый. — Почему мы говорим, что чеснок — активный борец с атеросклерозом? Да потому что в нем много селена, который обладает антиоксидантным действием и противохолестериновым эффектом. Поэтому противосклеротические рецепты тибетских монахов, основанные на чесноке, оправданны, это доказано. Чеснок также препятствует опасному тромбообразованию в сосудах, выделяя тромболитик ахоен.
Не ешьте витамины тоннами!
Но как тогда быть с утверждением ученых: чтобы получить необходимые витамины и минералы из овощей и фруктов, витаминную продукцию нужно употреблять десятками килограммов, задаю вопрос собеседнице.
— Не килограммами нужно есть витамины, а употреблять их регулярно, — советует опытный доктор. — Если вы думаете, что, “уговорив” за раз килограмм бананов, можно получить нужную дозу калия, вы абсолютно неправы! Наш организм возьмет ровно столько, сколько ему необходимо, все остальное выйдет через кишечник, поэтому одноразовый набег на фрукты и овощи пользы не принесет.
Татьяна Нечесова обращает особое внимание на цветные овощи и фрукты, богатые антиоксидантами, — оранжевую морковь, красно-желтый перец, апельсины и мандарины, черную смородину. Сегодня ученые придают большое значение оксидативному стрессу, агрессивным радикалам, уточняет специалист. (Радикалы — чисто химическое понятие, подразумевающее агрессивно активные молекулы расщепленного кислорода. Считается, что из-за свободных радикалов с возрастом у людей грубеет кожа, становятся жесткими и хрупкими кровеносные сосуды, а здоровые клетки перерождаются в злокачественные. — Н.Н.). Если у человека много свободных радикалов, значит, так называемый плохой холестерин будет оседать на стенках сосудов, а затем и повреждать их. Однако, обогатив ежедневное меню достаточным количеством овощей и фруктов, которые мы любим и летом употребляем часто, этого можно избежать — многие витамины обладают антиоксидантным действием. Правда, употреблять овощи и фрукты нужно не только летом, но и круглый год.
При этом нет особого смысла гоняться за экзотическими плодами. Томаты, например, содержат много ценнейшего антиоксиданта ликопена, который останавливает цепную реакцию молекул свободных радикалов кислорода.
Все хорошо в меру
Поскольку август — настоящий овощной и фруктовый рай, специалист советует чаще готовить свежевыжатые соки.
Если отправить в соковыжималку петрушку, кабачок, огурец и сельдерей, добавить немного лимонного сока, в результате получится полезнейший витаминный коктейль. А выжимать летом сок из цитрусовых все-таки не стоит: это не сезонные фрукты, потому и пользы от них будет мало.
У многих на даче растут антистрессовые растения — сельдерей, чеснок, снижающие к тому же холестерин и способствующие нормализации давления.
Сейчас самое время заморозить голубику, запастись боярышником, высушить мелиссу и мяту. А заварив травы и добавив пол чайной ложки меда, вы приготовите напиток, который поможет быстро уснуть. Этот природный транквилизатор избавит вас от приема снотворного.
Орехи полезны, в этом нет сомнения, но если вы, например, будете ежедневно съедать по 200 г миндаля, а этот орех — лучший продукт для тех, у кого повышен уровень холестерина в крови, то, несомненно, наберете лишний вес и добьетесь противоположного желаемому эффекта.
Зачем отказываться от мяса?
Специалист говорит, что кардиологические больные часто спрашивают, стоит ли им отказаться от мяса.
— Конечно, нет, — объясняет Татьяна Нечесова. — Откуда же организму брать гемоглобин? Между тем низкий гемоглобин провоцирует приступы стенокардии, потому что кровь, обедненная красными тельцами, доносит до органов и тканей меньше кислорода. Именно поэтому многие вегетарианцы страдают анемией. А если человек отказывается от мяса, то его питание должно быть контролируемым. Никакого крена в сторону углеводов — это однозначно приведет к наращиванию массы тела. Людям, страдающим заболеваниями сердца, следует отдавать предпочтение жирным сортам рыбы, употребляя ее не менее трех раз в неделю.
Правда ли, что оливковое масло полезнее обычного растительного только потому, что во время жарки в нем образуется меньше канцерогенов, интересуюсь у специалиста.
— Польза оливкового масла доказана многократно, основная его ценность все-таки в высоком содержании очень полезных для сердца и сосудов полиненасыщенных жирных кислот, — объясняет врач-кардиолог. — Однако это не означает, что, заправляя салат, можно не скупиться. Любое масло очень калорийно. Жиры растительного происхождения более приветствуются потому, что они легко воспринимаются и усваиваются нашим организмом. Хотя очевидно и другое: во время жарки как в оливковом, так и в растительном масле выделяются канцерогены. Особенно если на одном и том же масле готовят несколько раз. На мой взгляд, еще больше канцерогенов в шашлыках, которые жарят на открытом огне. Жир капает на угли, а затем вместе с канцерогенами попадает на кусочки мяса.
Вообще заблуждений по поводу вреда или пользы продуктов много, считает Татьяна Нечесова. Например, часто больные сердечно-сосудистыми заболеваниями признаются, что отказались от куриных яиц, потому что в них очень много холестерина. Специалист предупредила, что не следует бросаться из одной крайности в другую. В курином желтке, между прочим, содержится много полезных веществ, и все зависит от того, как приготовлено яйцо. Если вы растопите сливочное масло или обжарите бекон, а затем разобьете в сковороду яйцо, это, несомненно, будет вредно для печени, сосудов и сердца. Но в вареном яйце ничего плохого нет. Съев этот продукт, вы получите полезные вещества и неагрессивный холестерин. А перепелиные яйца вообще обладают лечебным эффектом, заключила специалист.
- По данным некоторых исследований, бокал красного вина в день обладает антисклеротическим эффектом и защищает сердце от инфаркта.
- Молоко спасает от сердечных проблем. Ученые из Детройта доказали, что ежедневное употребление двух чашек обезжиренного молока в два раза сокращает риск заболеваний сердечно-сосудистой системы.
- Продукты, богатые витамином Е (овощи, фрукты, сыр, творог, бобовые, растительное масло), укрепляют сердце, утверждают ученые из Национального института кардиологии США.
- Употребление рыбы раз в неделю может до 44 процентов сократить риск сердечного приступа.
- Грецкие орехи почти на семь лет продлевают жизнь человека. По словам профессора Гарри Купера из Университета Калифорнии, в состав орехов входят вещества, которые предохраняют сердце от вредного воздействия холестерина.
- Использование малинового варенья вместо сахара способствует расширению коронарных артерий. Малина к тому же содержит много витаминов С и Р, которые укрепляют стенки сосудов.
Загрузка…
Adblock
detector
