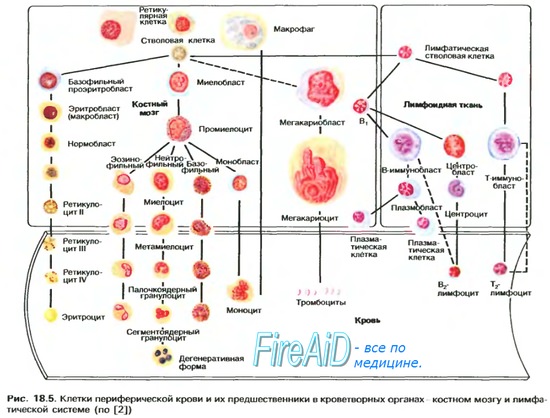
У гемоглобина сродство к кислороду выше чем у миоглобина
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Особые свойства молекулы гемоглобина, которые делают его столь эффективным переносчиком кислорода в крови, легче всего уяснить из сравнения миоглобина и гемоглобина в отношении их сродства к кислороду. На рис. 8-16 показаны кривые насыщения кислородом для гемоглобина и миоглобина, характеризующие степень насыщения этих белков кислородом (т.е. отношение числа участков молекулы, связывающих кислород, к общему числу участков, способных к такому связыванию) в зависимости от парциального давления газообразного кислорода, находящегося в равновесии с раствором белка.
Рис. 8-15. Фоток рафия нормальных эритроцитов человека, полученная при помощи сканирующего электронного микроскопа.
Прежде всего из графика ясно, что миоглобин имеет очень высокое сродство к кислороду: при парциальном давлении кислорода, равном всего лишь 1-2 мм рт. ст., он уже на 50% насыщен кислородом. Кроме того, мы видим, что кривая насыщения миоглобина кислородом имеет вид простой гиперболы, как и следует ожидать из закона действующих масс применительно к равновесной реакции:
При парциальном давлении кислорода, равном 20 мм рт. ст., миоглобин оказывается насыщенным кислородом более чем на 95%. В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду; кроме того, кривая насыщения гемоглобина кислородом имеет сигмоидную, т.е. S-образную, форму (рис. 8-16). Это означает, что при связывании первой молекулы кислорода (нижняя часть S-образной кривой, соответствующая парциальным давлениям кислорода ниже 10 мм рт. ст.), гемоглобин имеет очень низкое сродство к кислороду, тогда как при связывании следующих молекул кислорода его сродство к ним становится намного выше, о чем свидетельствует крутая часть -образной кривой.
Рис. 8-16. Кривые насыщения кислородом для миог лобина и гемоглобина. Миоглобин обладает намного более высоким сродством к кислороду, чем гемоглобин. 50%-ное насыщение миоглобина кислородом достигается уже тогда, когда парциальное давление О, составляет всего 1 -2 мм рт. ст., тогда как для гемоглобина такое насыщение кислородом наступает лишь при парциальном давлении кислорода около 26 мм рт. ст. Обратите внимание, что в артериальной крови, вытекающей из легких (при парциальном давлении кислорода около 100 мм рт. ст.) оба белка – и миоглобин и гемоглобин – насыщены кислородом более чем на 95 %„ тогда как в покоящейся мыщце, где парциальное давление кислорода равно 40 мм рт. ст., гемоглобин насыщен кислородом лишь на 75%, а в работающей мышце при парциальном давлении кислорода всего около 10 мм рт. ст. только на 10%. Таким образом, гемоглобин очень эффективно отдает свой кислород в мышцах и других периферических тканях. Что же касается миоглобина, то при парциальном давлении кислорода, равном всего 10 мм рт. ст„ он все еще остается насыщенным кислородом почти на 90% и поэтому даже при столь низких парциальных давлениях кислорода отдает очень малую часть связанного с ним кислорода. Таким образом, сигмоидная кривая насыщения гемоглобина кислородом является результатом молекулярной адаптации гемоглобина к выполнению им транспортной функции в составе эритроцитов.
Фактически после связывания первой молекулы кислорода сродство повышается почти в 500 раз. Таким образом, четыре гемсодержащие полипептидные субъединицы гемоглобина различаются по степени их сродства к кислороду и зависят друг от друга в процессе его связывания.
Как только первая гемсодержащая полипептидная субъединица свяжет молекулу кислорода, она передает информацию об этом остальным субъединицам, у которых сразу же резко повышается сродство к кислороду. Такой обмен информацией между четырьмя гемсодержащими полипептидными субъединицами гемоглобина обусловлен кооперативным взаимодействием между субъединицами. Поскольку связывание первой молекулы кислорода одной из субъединиц гемоглобина увеличивает вероятность связывания следующих молекул кислорода остальными субъединицами, мы говорим, что гемоглобин имеет положительную кооперативностъ. Для положительной кооперативности характерны сигмоидные кривые связывания, подобные кривой насыщения гемоглобина кислородом. При связывании кислорода миоглобином, содержащим одну гемогруппу, молекула белка может присоединить только одну молекулу кислорода; в этом случае кооперативного связывания не наблюдается и кривая насыщения имеет вид простой гиперболы. Теперь мы понимаем. почему миоглобин и гемоглобин столь сильно различаются между собой по кислород-связывающей способности.
Мы будем использовать термин лиганд для обозначения специфической молекулы, связывающейся с белком; это может быть, например, молекула кислорода, если речь идет о гемоглобине (слово «лиганд» происходит от латинского слова, которое переводится как «связывать», «присоединять» и буквально означает «то, что присоединяется»). Многие другие олигомерные белки тоже имеют по нескольку лиганд-связывающих центров и, подобно гемоглобину, проявляют положительную кооперативность. Однако есть олигомерные белки, проявляющие отрицательную кооперативность: в этом случае связывание одной молекулы лиганда уменьшает вероятность связывания других молекул лиганда.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июля 2013;
проверки требуют 29 правок.
Эффект Вериго — Бора (синонимы — эффект Вериго, эффект Бора) — зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в альвеолярном воздухе и крови, при снижении которого сродство кислорода к гемоглобину повышается, что затрудняет переход кислорода из капилляров в ткани. Эффект этот был открыт независимо друг от друга Б. Ф. Вериго в 1892 году[1] и датским физиологом К. Бором в 1904 году[2].
История открытия[править | править код]
Основу разработки проблемы гипоксии заложил русский учёный-физиолог И. М. Сеченов фундаментальными работами по физиологии дыхания и газообменной функции крови. Большое значение имеют также исследования русского физиолога Б. Ф. Вериго по физиологии газообмена в лёгких и тканях. Опираясь на идеи Сеченова о сложных формах взаимодействия между диоксидом углерода и кислородом в крови (Вериго работал в лабораториях Сеченова, И. Р. Тарханова и И. И. Мечникова), он впервые установил зависимость степени диссоциации оксигемоглобина от величины парциального давления углекислоты в крови.
Биохимический механизм[править | править код]
Эффект Вериго — Бора: влияние pH на кривую насыщения гемоглобина кислородом
В клетках периферических тканей органическое топливо окисляется в митохондриях с использованием кислорода (клеточное дыхание), доставляемого гемоглобином из лёгких; при этом в качестве продуктов образуются углекислый газ, вода и другие соединения. Образование углекислого газа в тканях одновременно приводит и к повышению концентрации ионов H+ (то есть к понижению pH), поскольку при гидратации CO2 образуется H2CO3 — слабая угольная кислота, диссоциирующая на ионы H+ и бикарбонат-ионы:
H2CO3 ⇄ H+ + HCO3-.
Гемоглобин переносит значительную долю (около 20 %) общего количества CO2 и ионов H+, образующихся в тканях и поступающих в лёгкие и почки, обеспечивающих выделение этих продуктов.
За много лет до открытия этого механизма было обнаружено, что на связывание кислорода гемоглобином очень сильное влияние оказывает pH и концентрация CO2: при присоединении CO2 и ионов H+ способность гемоглобина связывать O2 снижается. Действительно, в периферических тканях с относительно низким значением pH и высокой концентрацией CO2 сродство гемоглобина к кислороду падает. И наоборот, в лёгочных капиллярах выделение CO2 и сопутствующее ему повышение pH крови приводит к увеличению сродства гемоглобина к кислороду. Это влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином и называют эффектом Вериго — Бора.
Реакция связывания кислорода гемоглобином в виде
Hb + O2 ⇄ HbO2
в действительности отражает неполную картину, поскольку не учитывает дополнительные лиганды H+ и CO2.
Чтобы объяснить влияние концентрации ионов H+ на связывание кислорода, следует записать эту реакцию в иной форме:
HHb+ + O2 ⇄ HbO2 + H+,
где HHb+ — протонированная форма гемоглобина. Из этого уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации ионов H+. Гемоглобин связывает и O2, и ионы H+, но между этими двумя процессами существует обратная зависимость. Если парциальное давление кислорода велико (что наблюдается, например, в лёгких), то гемоглобин связывает его, освобождая при этом ионы H+. При низком парциальном давлении кислорода (что имеет место в тканях) связываться с гемоглобином будут ионы H+.
Эффективность связывания гемоглобином углекислого газа (с образованием карбаминогемоглобина, чаще именуемого карбгемоглобином[3]) находится в обратной зависимости от связывания кислорода. В тканях часть избыточного CO2 связывается с гемоглобином, сродство последнего к O2 снижается, и происходит высвобождение кислорода. В лёгких же связывается избыток O2 воздуха, тем самым сродство гемоглобина к CO2 уменьшается, и CO2 выделяется в альвеолярный воздух, способствуя лёгкому закислению крови за счёт ионов H+, возникающих при диссоциации угольной кислоты (см. выше).
Описанные зависимости делают молекулу гемоглобина великолепно приспособленной к осуществлению совместного переноса эритроцитами кислорода, углекислого газа и ионов H+[4].
См. также[править | править код]
- Эффект Холдейна (открыт Джоном Скоттом Холдейном)
Примечания[править | править код]
- ↑ Verigo B. F. Zur Frage über die Wirkung des Sauerstoff auf die Kohlensäureausscheidung in den Lungen // Archiv für die gesammte Physiologie des Menschen und der Thiere : статья. — 1892. — № 51. — С. 321—361.
- ↑ Chr. Bohr, K. Hasselbalch, and August Krogh. Concerning a Biologically Important Relationship — The Influence of the Carbon Dioxide Content of Blood on its Oxygen Binding // Skand. Arch. Physiol. : статья. — 1904. — № 16. — С. 401—412.
- ↑ Карбгемоглобин // Биологический энциклопедический словарь (рус.).
- ↑ Ленинджер А. Основы биохимии: В 3-х томах. Том 1. — М.: Мир, 1985. — С. 208—210. — 367 с.
Литература[править | править код]
- Вериго эффект // Большой медицинский словарь (рус.). — 2000.
Лекция № 9.
План изложения:
1.Хромопротеины. Гемоглобин и миоглобин. Строение, функции, биологическое значение для организма, отличия.
2.Оксигенирование гемоглобина и миоглобина.
3.Синтез гема.
4.Распад гемоглобина в организме.
5.Клиническое значение исследования пигментов. Лабораторные показатели желтух.
К хромопротеинам относятся гемоглобин, миоглобин, хлорофилл.
Гемоглобин и миоглобин – сложные белки класса хромопротеинов подгруппы гемопротеинов, так как небелковой их частью является гемм.
Уникальным свойством этих белков является обратимое связывание с молекулами кислорода без изменения степени окисления иона железа
(Fe 2 +).
Отличаются эти белки локализацией и функциями.
1.Гемоглобин находится в эритроцитах, транспортирует кислород из лёгких к тканям, а из тканей в лёгкие переносит углекислый газ и протоны водорода. Эта его функция тесно связана с регуляцией кислотно-основного состояния в организме.
2.Миоглобин локализуется в цитоплазме мышечных клеток (красные мышцы), особенно много его в миокарде, сохраняет запас кислорода для анаэробного митохондриального окисления при интенсивной мышечной работе и транспортирует кислород внутриклеточно к митохондриям.
3.Сродство миоглобина к кислороду выше, чем у гемоглобина.
Различия в функциях этих белков обусловлены разной структурной организацией их молекул.
1.Миоглобин состоит из одной полипептидной цепи, содержащей 153 остатка аминокислот.
2.Гемоглобин имеет четыре попарно идентичные полипептидные цепи. У основного гемоглобина взрослых HbA комбинируются 2 альфа цепи, состоящие из 141 остатка аминокислот, и 2 вета-цепи, содержащие по 146 остатков.
3.Третичная конформация этих цепей очень похожа на аналогичную в молекуле миоглобина с той разницей, что в альфа цепи имеется семь спирализованных участков.
Каждая полипептидная цепь, соединённая с молекулой гема, образует субъединицу. Четыре субъединицы, взаимодействуя между собой нековалентными связями, укладываются в форме тетраэдра, образуя глобулярную четвертичную структуру.
Присоединение молекулярного кислорода к гемоглобину и миоглобину осуществляется через ион железа гема. Этот процесс называют оксигенированием(не окислением, так как он не приводит к изменению степени окисления железа!). Оксигенированные белки называют оксигемоглобинами (HbO 2) и оксимиоглобинами (MyoHbO 2).
На процесс оксигенирования гемоглобина влияют:
1.парциальное давление кислорода, углекислого газа,
2.концентрация протонов водорода (pH)
3.концентрация 2,3 – дифосфоглицерата (2,3- ДФГ) – промежуточного метаболита гликолиза в эритроцитах.
Четвертичная структура гемоглобина наделяет гемоглобин уникальной способностью насыщаться кислородом постепенно, достигая максимума при высоком парциальном давлении, и отдавать часть кислорода в ткани при снижении pO 2.
Пусковым механизмом изменения конформации гемоглобина при взаимодействии с О 2 при его высоком давлении служит перемещение иона железа в плоскость порфиринового кольца.
Максимальное насыщение кислородом ( на 96%) происходит в эритроцитах лёгочных капилляров при pO 2 = 100 мм рт.ст. В венозной крови гемоглобин насыщен кислородом только на 64%, следовательно 32% кіслорода переходит в ткани. Другими словами, на уровне периферических тканей происходит снижение сродства гемоглобина к кислороду и частичное дезоксигенирование.
Этому способствуют следующие условия:
1.низкое парциальное давление кислорода в периферических тканях (40 мм рт.ст.), а в работающих мышцах 20 мм рт. ст., так как в тканях кислород быстро используется на окислительное фосфорилирование для получения АТФ и некоторые другие процессы;
2.высокое pCO 2 образующееся в тканях в результате декарбоксилирования альфа- кетокислот, аминокислот, других карбоновых кислот в процессе метаболизма.
3. увеличение концентрации 2,3 – ДФГ, стимулируемое высоким рCO 2 Молекула оксігемоглобіна связывается определённым центром с молекулой 2, 3- дифосфоглицерата, что приводит к изменению конформации и освобождению части О 2.
Таким образом, оксигемоглобин снабжает ткани кислородом.
Оксигенирование миоглобина в мышцах и быстро и при низком парциальном давлении О 2 (20мм рт. ст.). Сродство миоглобина к кислороду выше, чем у гемоглобина. При интенсивной мышечной работе, приводящей к быстрому кислородному голоданию (рО 2 снижается до 5 мм рт. ст.) в клетке, оксимиоглобин переносит О 2, к митохондриям и отдаёт его в матрикс, где находится фермент цитохромоксидаза, имеющий более высокое сродство
к О 2, чем гемоглобин., и использующий кислород в качестве акцептора электронов.